N 端前脑钠肽稳定保存体系的优化①
王 翠 王云龙 明 亮 郑配国 谢南昌 李玉林 王继创
(郑州大学第一附属医院内科,郑州 450052)
心衰是多种心血管疾病发展到终末阶段的主要临床表现,其发病过程非常复杂[1]。近年来研究发现:B 型脑钠肽(BNP)或其非活性的N 末端前脑钠肽(NT-proBNP)是心衰时较好的心脏标志物[2],它在血液中的含量能反映心室容积扩大、心室超负荷和心脏功能损伤及损伤程度[3-7]。与BNP 相比,NTproBNP 因其半衰期长(120 min)、心衰时大幅度升高而更有利于临床疾病诊断[6,8,9]。因此,检测血液中的NT-proBNP 含量,对于无症状心衰的早期诊断、急性心衰的严重程度评价、监测心衰病程的发展和疗效观察及鉴别心源性和非心源性的呼吸困难均具有重要意义。
诊断试剂盒的研发为血清中NT-proBNP 的定量检测提供了重要的检测手段,而试剂盒中质控品的质量是保证NT-proBNP 定量检测准确与否的前提条件。目前检测试剂中常用的质控品主要有干粉和液体两种,干粉质控品制备是一个非常复杂的物理化学变化过程,在冻干过程中,电解质浓度的改变、溶液pH 值的变化以及生产和贮存过程中的温度变化都会对制备的质控品质量产生影响,另外,其稳定性亦受溶剂质量、溶剂量、保存温度及时间等多种因素的影响,导致检测结果质控变异系数增大,成为检测试剂盒研制工作中的一个难题[10]。近年来使用的液体质控品,避免了冻干、复溶及分装等步骤,能有效克服以上各环节造成的误差,因此从经济和使用便捷性方面考虑,市场更青睐可长期稳定保存的液体质控品。但液体质控品在实际应用中存在容易降解的现象,导致检测值出现偏差,严重影响了检测结果的准确性。因此,如何延长液体质控品的保存时间是目前研究的热点之一。本试验通过ELISA 法对NT-proBNP 检测试剂中NT-proBNP 的保存条件进行深入的研究,旨在寻找一种简便、有效的NT-proBNP 血清质控品保存方法。
1 材料与方法
1.1 材料 NT-proBNP 定值血清P1 为3 000 pg/ml、P2 为200 pg/ml、NT-proBNP 低值血清P3 <20 pg/ml:由郑州大学第一附属医院提供,为无溶血、常规传染病检测阴性的样品。
1.2 试验方法
1.2.1 NT-proBNP 样品的前处理 NT-proBNP 血清于60℃灭活1 h 后,5 000 r/min 离心30 min 去除杂质,采用0.22 μm 的无菌滤器过滤至15 ml 无菌管中,分装后于-20℃保存备用。
取灭菌离心管,将定值血清P1 用试验中采用的不同成分的保存液分别稀释至200 pg/ml 或用P3稀释至200 pg/ml(P4)待用。
1.2.2 检测方法 采用双抗体夹心ELISA 法定量检测NT-proBNP 含量。
1.2.3 基础缓冲体系的确定 以去离子水、pH6.8、7.2、8.0、8.8 的Tris 缓冲液,pH6.4、6.8、7.2、7.8 的PB 和PBS 缓冲液共13 种溶液作为基础缓冲体系的候选缓冲液,以NT-proBNP 血清P4 作为试验结果参照标准。分别用候选基础缓冲液稀释10%小牛血清作为NT-proBNP 保存液稀释P1 至200 pg/ml 进行酶免反应,每组实验至少有3 个重复。以接近血清P4 检测结果(OD 值)的缓冲体系确定为NT-proBNP 保存试验中的基础缓冲体系。
1.2.4 保存液成分的确定
1.2.4.1 防腐剂的选择 选择已优化的基础缓冲体系进行防腐剂的选择实验,分别用10%小牛血清、10%小牛血清添加1/1 000 Proclin300 作为保存液稀释P1 至200 pg/ml 进行NT-proBNP 血清保存试验。样品分为3 份,分别置于-20℃、4℃、37℃。4℃、-20℃中保存样品7 d,37℃保存样品每天取样至第4 天,已取样样品置于-20℃中保存,至第7 天后统一检测样本OD 值的变化,以OD 值降低相对较缓慢的条件确定为优选的保存液成分。试验重复3 次。
1.2.4.2 抗生素的选择 选择已确定的基础缓冲体系、小牛血清及防腐剂进行抗生素的选择实验。分别用添加青霉素(100 U/ml)、链霉素(100 U/ml)、链霉素(100 U/ml)和青霉素(100 U/ml)三组实验作为保存液稀释P1 至200 pg/ml 进行NTproBNP 血清保存试验。样品分为3 份,分别置于-20℃、4℃、37℃。4℃、-20℃中保存样品7 d,37℃保存样品每天取样至第5 天,已取样样品置于-20℃中保存,至第7 天后统一检测样本OD 值的变化,以OD 值降低相对较缓慢的条件确定为优选的保存液成分。试验重复3 次。
1.2.5 最佳保存液组分的确定 根据上述试验确定的NT-proBNP 保存液成分设计正交试验表L9(34)(表1),分别用各组保存液稀释P1 至200 pg/ml 进行试验,样品于37℃保存8 d,从第3 天开始每天取样至第8 天,-20℃保存,至第8 天后统一检测样本OD 值的变化,以OD 值降低相对较缓慢的条件为最佳的保存液组分。试验重复3 次。
1.2.6 验证试验 按照优选的最佳保存液稀释P1获得5份NT-proBNP参考品(P5:2 5 0 pg/ml、P6:200 pg/ml、P7:150 pg/ml、P8:100 pg/ml、P9:50 pg/ml),于-20℃、4℃、37℃条件下进行为期7 d 的保存实验,绘制标准曲线,并标定NT-proBNP 定值血清P2,以标定的P2 结果判断线性参考品保存情况,用P4 标本在37℃中NT-proBNP 的降解情况为对照。

表1 正交设计因素水平表Tab.1 Factors and levels in L9(34)orthogonal test
1.3 统计学分析 实验数据采用SPSS19.0 软件进行统计分析,数据以±s 表示。批内组间采用单因素方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 基础缓冲体系的确定 按照设计的13 种候选基础缓冲体系进行ELISA 检测,结果如表2:不同的缓冲体系及其pH 值均影响NT-proBNP 的检测。其中,去离子水反应体系中标本(200 pg/ml)检测OD均值为0.391;pH6.4 的PB 缓冲液中标本的检测OD 均值为0.681;pH6.8~8.0 的Tris 缓冲液中标本的检测OD 均值在0.6 左右;pH7.2 的PBS 缓冲液中标本的检测OD 均值为0.73,与P4 血清的检测结果(OD=0.733)无显著差异(P >0.05),因此,本试验基础缓冲体系选择0.02 mol/L pH7.2 的PBS缓冲液。
2.2 保存体系成分的确定
2.2.1 防腐剂的确定 选择已确定的基础缓冲体系进行37℃保存实验,结果如表3:选用10%小牛血清作为NT-proBNP 保存液时,NT-proBNP 样本于37℃保存1 d 检测OD 值已经开始下降(P <0.01)。选择10%小牛血清中添加防腐剂Proclin300 作为NT-proBNP 保存液时,NT-proBNP 样本于37℃保存2 d 检测OD 值开始下降(P <0.05)。NT-proBNP 在两组保存液中于4℃和-20℃保存7 d 后检测OD值均无明显变化(P >0.05)。因此,试验选择在NT-proBNP 保存液中添加防腐剂Proclin300 来延长NT-proBNP 样本保存时间。
2.2.2 抗生素的选择 选择已确定的基础缓冲体系、10%小牛血清及1/1 000 Proclin300 进行抗生素选择实验,结果如表4:保存液中添加100 U/ml 青霉素或100 U/ml 链霉素,NT-proBNP 样本于37℃保存第3 天检测OD 值开始下降(P <0.01)。保存液中同时添加100 U/ml 青霉素和100 U/ml 链霉素,NT-proBNP 样本于37℃保存第4 天检测OD 值开始下降(P <0.05)。但NT-proBNP 在4℃和-20℃保存7 d 后其OD 值均无明显变化(P >0.05)。因此,试验选择青霉素和链霉素作为NT-proBNP 保存液中添加的抗生素。
2.3 最佳保存液组分的确定 正交试验结果如图1:NT-proBNP 在第8 组及第9 组保存体系中,于37℃中保存7 d 降解不明显(P >0.05),能够满足常规实验室存放液体血清制品的需求。考虑到经济因素,本试验选择第8 组:20%小牛血清添加1/1 000 Proclin300、120 U/ml 青霉素及80 U/ml 链霉素作为NT-proBNP 血清的保存液。
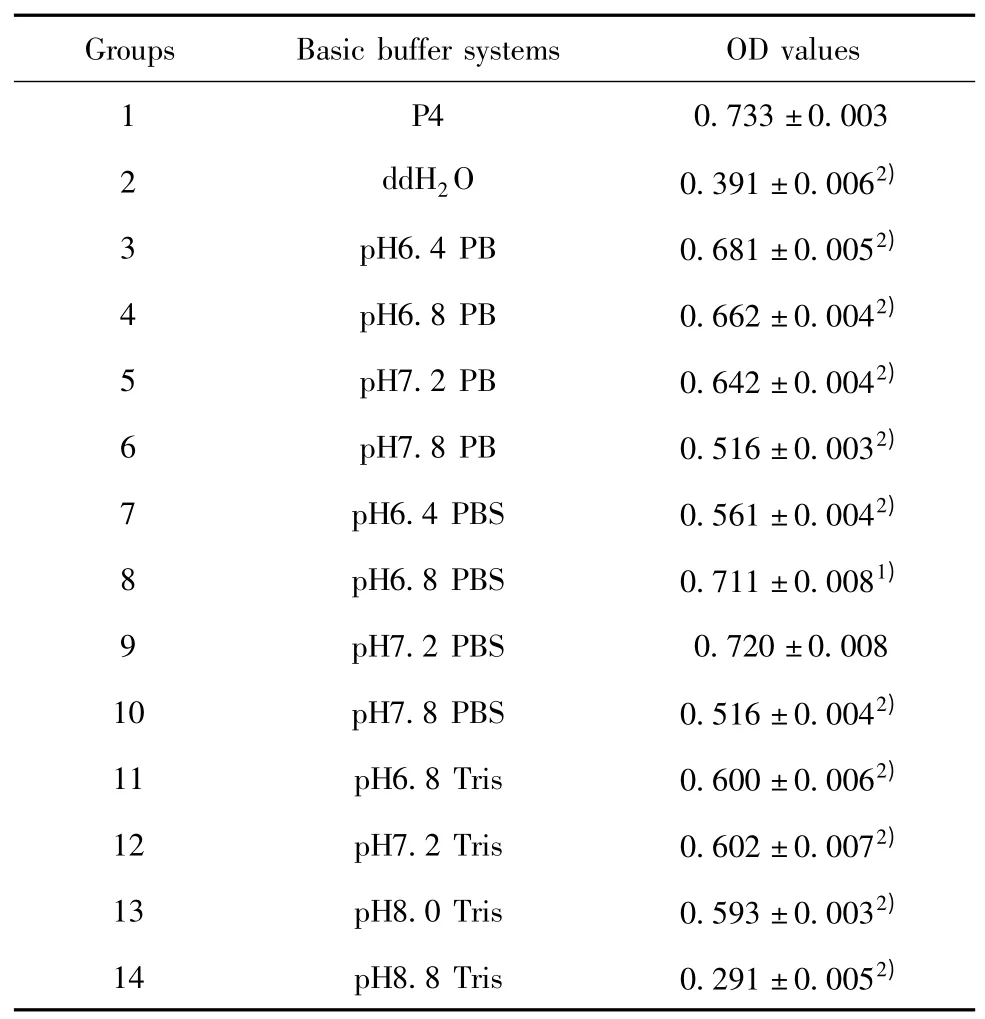
表2 不同缓冲体系保存NT-proBNP 的ELISA 检测结果(n=3)Tab.2 Different basic buffer systems in comparison with normal human serum(n=3)
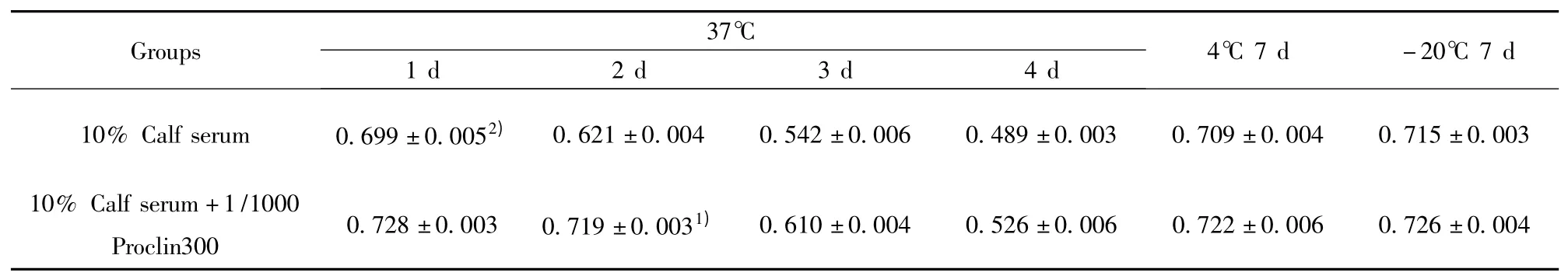
表3 防腐剂对NT-proBNP 保存的影响(n=3)Tab.3 Influence of NT-proBNP level by using Proclin300(n=3)
2.4 参考品保存验证试验 正常人血清稀释的样本P4 进行的保存对照试验结果如表5:血清P4 在37℃中保存1 d 即降解(P=0.05)。采用本实验优化的保存液保存NT-proBNP 参考品,分别在37℃、4℃和-20℃中保存7 d 后通过ELISA 检测结果见表6:选用保存的参考品绘制的标准曲线线性关系良好(R2>0.99),用绘制的标准曲线测定一份定值血清P2 及回测P5、P6、P7、P8、P9,结果显示:37℃、4℃和-20℃中保存7 d 的NT-proBNP参考品检测结果无显著差异(P >0.05)。37℃保存的参考品标定P2 中NT-proBNP 的含量比4℃中保存的参考品标定P2 结果仅降低了1.3%,该保存液保存的NT-proBNP 参考品基本满足检测试剂盒的保存要求。

图1 不同保存组分检测结果(37℃)(n=3)Fig.1 NT-proBNP level under different storage conditions at 37℃(n=3)

表4 抗生素成分的确定(n=3)Tab.4 Influence of NT-proBNP level by using different antibiotics(n=3)

表5 P4 检测结果(n=3)Tab.5 Results of product P4(n=3)

表6 线性参考品验证结果(n=3)Tab.6 Validation results of standard linear products(n=3)
3 讨论
目前检测试剂常用液体质控品的来源主要有基因工程表达蛋白及血液制品,因血液制品中的检测蛋白或抗体为天然构象,在检测过程中能更准确地反映检测结果而受到人们的青睐。但血液质控品成分较复杂,在保存过程中易受多种蛋白质、离子、pH值、化学反应、微生物活动及自身稳定性等因素的影响,随时间的延长其浓度必然发生变化。另外,血液质控品的稳定性与保存时间和温度也有关[11]:一般情况下,血清(浆)标本在22℃~24℃可以保存2 h,2℃~4℃可以保存4 h,-20℃可以保存2 周,-70℃可以保存6 个月。罗氏研发的NT-proBNP 诊断试剂[12]中显示NT-proBNP 血清能够在20℃~25℃稳定3 d,在2℃~8℃稳定6 d,在-24℃稳定24个月。
为了提高NT-proBNP 血清质控品的保存时间,本试验研究发现,NT-proBNP 血清保存基础缓冲液选择缓冲体系比选择去离子水更有利于抗原抗体的结合,这主要是因为抗原与抗体发生结合后,由亲水胶体变为疏水胶体的过程中须有离子参与才能进一步使抗原抗体复合物表面失去电荷,水化层破坏,复合物相互靠拢聚集,形成大块的凝集或沉淀。在PBS、PB 和Tris 三种缓冲体系进行的NT-proBNP 高值血清稀释对比试验中发现:选择0.02 mol/L pH7.2 的PBS 缓冲液体系较0.02 mol/L pH6.4~7.8 的PB 和0.02 mol/L pH6.8~8.8 的Tris 更接近正常人血清稀释的检测结果,表明选用0.02 mol/L pH7.2 的PBS 作为基础缓冲体系较接近血清自身的微环境,有利于抗原抗体的结合反应。相比较PB缓冲液,PBS 中的K+及不同的离子强度能够促进抗原抗体反应,而Tris 缓冲液因其缓冲能力较强,在pH6.8~8.0 时检测结果相对较稳定,但因Tris 缓冲液有可能影响生物活性,导致检测结果偏低,检测结果不如 PBS 缓冲体系。因此,本试验选择0.02 mol/L pH7.2 的PBS 缓冲液作为NT-proBNP保存的基础缓冲液。
另外,我们研究发现在基础缓冲液中常规添加10%小牛血清与1/1 000 防腐剂Proclin300 的情况下,添加抗生素(青霉素、链霉素)比单纯添加其中一种抗生素能够在37℃保存条件下延长NT-proBNP保存时间1 d。这可能是因为血清质控品中的成分较复杂,在制备及反复使用过程中存在细菌污染的情况,而细菌在生长过程中分泌的一些酶会对抗原抗体等蛋白产生分解作用;另外,一些细菌的内源性酶如大肠杆菌的β-半乳糖苷酶本身会对用相应酶作标记的测定方法产生非特异性干扰。因此,本试验通过研究确定在NT-proBNP 参考品的保存液中添加120 U/ml 青霉素与80 U/ml 链霉素,提高了NT-proBNP 的保存时间。
通过对NT-proBNP 血清保存各成分条件优化,本试验最终确定了NT-proBNP 血清的保存液配方为0.02 mol/L pH7.2 的PBS 作为基础缓冲液配制20%小牛血清,添加1/1 000 Proclin300、120 U/ml青霉素及80 U/ml 链霉素。该保存液保存的NTproBNP 参考品在37℃保存7 d 后检测结果显示线性关系良好,R2>0.99,且37℃、4℃和-20℃中保存7 d 的NT-proBNP 参考品检测结果无显著差异(P >0.05)。基本满足检测试剂盒的保存要求。
试剂盒中血液制品有效期的确定可以通过加速降解实验及长期稳定性实验进行[13,14],加速降解实验通常的做法是:有效期1 年的试剂盒37℃放置7 d 后检验,各项性能指标均应符合产品质量标准规定。本实验确定的NT-proBNP 血清保存液能够在37℃条件下保存NT-proBNP 7 d 不降解,初步满足了一般检测试剂中液体参考品保存期限的要求。后期我们将通过长期稳定性检测最终确定NT-proBNP在该保存液中于4℃储存条件下的实际保存期限。
本文为NT-proBNP 血清质控品及常规检验中血清的保存提供了一种简便、经济、有效的保存方法,为后期试剂盒的建立提供了技术保障。
[1]姚 红,武 烨,张 帆,等.心衰过程中β3 AR 自身抗体的产生与T 细胞亚群变化的相关研究[J].中国免疫学杂志,2013,29(9):943-947.
[2]Emdin M,Passino C,Prontera C,et al.Comparison of brain natriuretic peptide(BNP)and amino-terminal proBNP for early diagnosis of heart failure[J].Clin Chem,2007,53(7):1289-1297.
[3]Green SM,Redmond P,Januzzi JL,et al.The impact of amino-terminal pro-brainnatriuretic peptide testing on hospital length of stay and morbidity in patients with acute decompensated heart failure[J].Arch Pathol Lab Med,2007,131(3):473-476.
[4]Kim JY,Lee EY,Jee JH,et al.N-terminal pro-brain natriuretic peptide(NT-proBNP)in Type 2 diabetes with left ventricular dysfunction[J].Diabetes Res Clin Pract,2007,77(3):S238-S242.
[5]Lüthje L,Vollmann D,Drescher T,et al.Intrathoracic impedance monitoring to detect chronic heart failure deterioration:relationship to changes in NT-proBNP[J].Eur J Heart Fail,2007,9(6-7):716-722.
[6]Schou M,Gustafsson F,Corell P,et al.The relationship between Nterminal pro-brain natriuretic peptide and risk for hospitalization and mortality is curvilinear in patients with chronic heart failure[J].Am Heart J,2007,154(1):123-129.
[7]高 科,燕培荣.NT-proBNP 检测在慢性心力衰竭诊断中的临床应用[J].沈阳医学院学报,2014,16(1):15-17.
[8]Fonseca C,Sarmento PM,Minez A,et al.Comparative value of BNP and NTproBNP in diagnosis of heart failure[J].Rev Port Cardiol,2004,23(7-8):979-991.
[9]Doust JA,Pietrzak E,Dobson A,et al.How well does B-type natnuretic peptide predict death and cardiac events in patients with heart failure:systematic review[J].BMJ,2005,330(7492):625.
[10]刘建礼,朱 红,张绍福.HIV 质控血清稳定性的关键影响因素研究[J].中国国境卫生检疫杂志,2011,34(1):4-6.
[11]丛玉隆,张海鹏,任珍祥.血液学检验分析前质量控制的重要因素——标本的留取及其控制[J].中华医学检验杂志,1998,21(1):52-55.
[12]Yeo KT,Wu AH,Apple FS,et al.Multicenter evaluation of the Roche NT-proBNP assay and comparison to the Biosite Triage BNP assay[J].Clin Chim Acta,2003,338(1-2):107-115.
[13]徐伟文.体外诊断试剂研制常用技术指标之分析性能评估[J].分子诊断与治疗杂志,2010,2(2):140-144.
[14]张 林,刘睿斌,李秀梅.加速试验在确定血液制品有效期中的应用[J].中国药业,2009,18(4):41-42.