IL-28B 基因多态性与丙型肝炎自然转归的相关性研究①
陈秋宇 熊华平 许 茹 王 敏 廖 峭 黄 珂 黄杰庭 戎 霞 付涌水
(广州医科大学研究生学院,广州 510182)
丙型肝炎是由丙型肝炎病毒(Hepatitis C virus,HCV)引起的一种呈世界性分布的传染性疾病,主要通过静脉毒品注射、输血和器官移植等途径传播[1]。目前全世界大约有2 亿人感染HCV,占全世界人口的3%[2],而在我国就有约3 700~4 000 万人感染了HCV。HCV 感染后,20%~30%感染者会发生自发性清除,70%~80% 将会持续感染[3]。HCV 感染后的转归受环境因素、病毒本身(HCV 基因型、病毒载量)和宿主因素(人种、性别、年龄、宿主遗传基因多态性)等多方面因素的影响,其中关于宿主基因多态性与HCV 感染转归的研究成果不断被报道,如人类白细胞抗原(HLA)、炎症趋化因子、白细胞介素等。有学者通过全基因组基因多态性关联研究(Genome-wide association studies,GWAS)发现,IL-28B 基因多态性与HCV 的清除和持续感染密切相关[4,5],而位于IL-28B 基因上游3 kb 处的rs12979860 位点与HCV 的自发清除和抗病毒治疗应答相关性更加密切[5],但在中国人群中尚缺乏相关报道,本研究收集了来自广州地区无偿献血者中266 名HCV 感染者与97 名健康对照者,检测IL-28B rs12979860 基因型和等位基因,以探讨IL-28B rs12979860 基因多态性与丙型肝炎自然转归间的联系。
1 材料与方法
1.1 研究对象 随机选取了2009 年6 月至2011 年11 月在广州血液中心参加无偿献血的献血者,其中HCV 感染者266 名,包括HCV 慢性感染者(HCV 抗体和HCV RNA 均阳性)159 名和自发清除者(HCV 抗体阳性,HCV RNA 阴性)107 名,健康对照人群97 名(抗-HCV、抗-HIV、HBsAg、HBV 和HCV 核酸均阴性)。在266 名HCV 感染者中,男性196 人,女性70 人,平均年龄(32.1±9.7)岁;97 名 健 康 对 照 者,男 性48名,女性49 名,平均年龄(28.8±8.2)岁;HCV慢性感染者中,男性125 人,女性34 人,平均年龄(32.8±9.6)岁;自发清除者中,男性71 人,女性36 人,平均年龄(31.2±9.8)岁。
1.2 HCV 抗体的ELISA 检测 采用两种抗HCV抗体酶联免疫吸附试验(ELISA)试剂盒检测HCV抗体,包括丽珠(中国珠海丽珠试剂公司)和科华(Kehua Biotech Co.Ltd,Shanghai,China)的ELISA试剂,实验操作按试剂盒说明书进行。
1.3 HCV-RNA 的检测 采用美国诺华公司的核酸试剂盒(NAT;the Proclein Ultrio Assay,Gen-Probe,San Diego,CA,USA)检测HCV RNA,实验操作按试剂盒说明书进行。
1.4 RIBA 确证 对于ELISA 检测双试剂阳性,NAT 检测阴性的标本采用HCV BLOT 3.0 试剂盒(新加坡MP 生物医学公司)进行HCV 抗体确证试验,实验操作按说明书进行。
1.5 基因组DNA 的提取 静脉采血5 ml 加入ACD 抗凝后,按照DNA 提取纯化试剂盒QIAamp DNA Blood Mini Kit(Qiagen,Chatsworth,CA)的操作说明提取全血中的DNA,DNA 的浓度采用微量紫外核酸蛋白分析仪进行检测。
1.6 IL-28B rs12979860基因型检测采用ABI9700 PCR 扩增仪对所提取的DNA 进行PCR 扩增,扩增体系20 μl。PCR 引物序列如下:GGAAGGAGCAGTTGCGCTGC(上游引物)和ACCGCTACGTAAGTCACCGC(下游引物)。反应条件为:95℃预变性5 min,95℃变性50 s,60℃退火50 s,72℃延伸50 s,共32 个循环,最终72℃延长7 min。所获得的PCR 产物经QIA-quick PCR 产物纯化试剂盒(QIAGEN 公司)纯化,紫外分光光度计定量后,用PCR引物和ABI 公司的测序试剂盒对PCR 产物进行双向测序,获得的序列用DNAStar 软件中的Seqman 软件与参考序列比对,获得rs12979860 基因型和等位基因分布结果。
1.7 统计学分析 采用SPSS16.0 软件进行统计学分析,对HCV 感染组、健康对照组,HCV 慢性感染组和自发清除HCV 组基因型分布进行哈迪温伯格平衡检验(Hardy-Weinberg Equilibrium test,HWE)。利用χ2检验分析HCV 感染组与健康对照组,HCV慢性感染组和健康对照组、自发清除HCV 组与HCV 慢性感染组IL-28B rs12979860 基因型和等位基因的分布情况,并计算比值比OR(Odds ratio,OR)及95%可信区间(Confidential interval,CI),双侧检验,P <0.05 视为有统计学意义。
2 结果
2.1 哈迪温伯格平衡检验 对HCV 感染组、健康对照组、慢性感染组与自发清除组的IL-28B rs12979860 基因多态性进行哈迪温伯格遗传平衡检验。结果显示均符合哈迪温伯格平衡定律,χ2值分别为1.02、0.50 和1.26、0.06,P 均大于0.05,具有人群代表性(表1)。
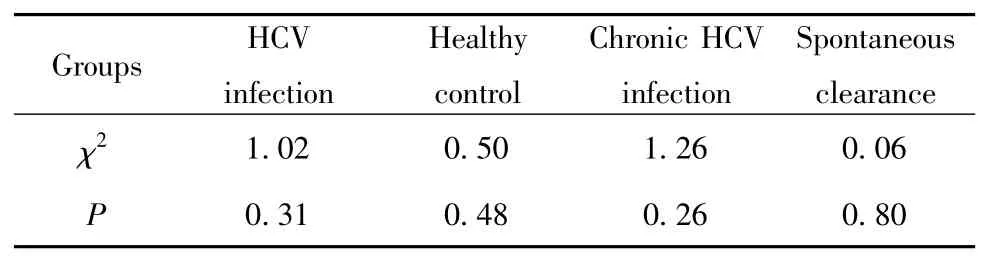
表1 哈迪温伯格遗传平衡检验Tab.1 Hardy-Weinberg genetic equilibrium test
2.2 rs12979860 等位基因的测定 PCR 扩增产物经Sanger 测序法测序后用DNAStar 软件分析,C/C基因型在序列分析图中只可见单峰图(图1),如箭头所指位置;C/T 基因型在序列分析图中可见双峰图(图2),如箭头所示位置;未发现T/T 基因型。
2.3 IL-28B rs12979860 基因型和等位基因在HCV感染人群和健康人群中的分布 HCV 感染组266人,C/C 基因型为235 人(88.3%),C/T 为31 人(11.7%),C 等位基因的频率为94.2%,T 等位基因的频率为5.8%。健康对照组97 人,C/C 基因型为84 人(86.6%),C/T 为13 人(13.4%),C 等位基因的频率为93.3%。HCV 感染组与健康对照组基因型及等位基因比较,χ2分别为0.204、0.191,P 值分别为0.652、0.662,二者之间差异无统计学意义,见表2。

图1 rs12979860 C/C 基因型序列分析图Fig.1 rs12979860 C/C genotype sequence analysis chart
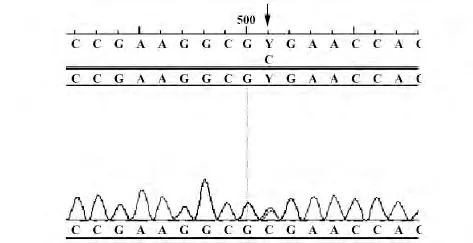
图2 rs12979860 C/T 基因型序列分析图Fig.2 rs12979860 C/T genotype sequence analysis chart
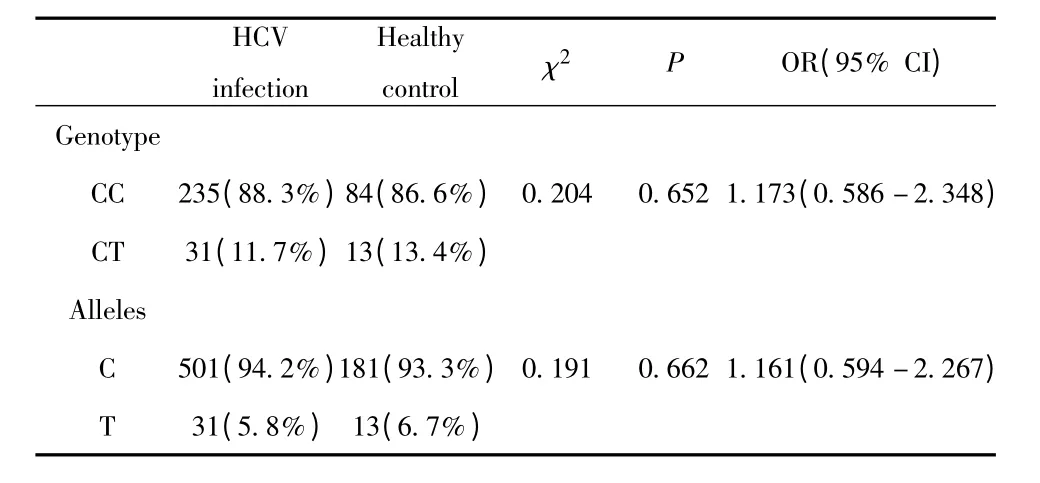
表2 rs12979860 基因型、等位基因在健康对照组和HCV感染组的分布Tab.2 rs12979860 genotype and allele distribution in healthy control group and HCV infection group
2.4 IL-28B rs12979860 基因型和等位基因在HCV慢性感染人群和健康人群中的分布 HCV 慢性感染组159 人,C/C 基因型为133 人(83.6%),C/T 为26 人(16.4%),C 等位基因的频率为91.8%,T 等位基因的频率为8.2%。健康对照组97 人,C/C 基因型为84 人(86.6%),C/T 为13 人(13.4%),C 等位基因的频率为93.3%。HCV 慢性感染组与健康对照组基因型及等位基因比较,χ2分别为0.406、0.373,P 值分别为0.524、0.542,二者之间差异无统计学意义,见表3。
2.5 IL-28B rs12979860 基因型和等位基因在HCV慢性感染人群和自发清除HCV 人群中的分布HCV慢性感染组159人,其中C/C基因型为133人(83.6%),C/T 为26 人(16.4%),C 等位基因的频率91.8%;HCV 自发清除组107 人,C/C 基因型为102 人(95.3%),C/T 为5 人(4.7%),C 等位基因的频率为97.7%。HCV 慢性感染组与自发清除组基因型分布差异有统计学意义(χ2=8.474,P=0.004),C/T 等位基因中C 和T 所占比例在自发清除组和慢性感染组中有显著差异,等位基因C 在自发清除患者中的比率明显高于慢性组,OR=0.251(95%CI:0.093 -0.676),见表4。

表3 rs12979860 基因型、等位基因在HCV 慢性感染组和健康对照组的分布Tab.3 rs12979860 genotype and allele distribution of HCV chronically infected patients and healthy control group
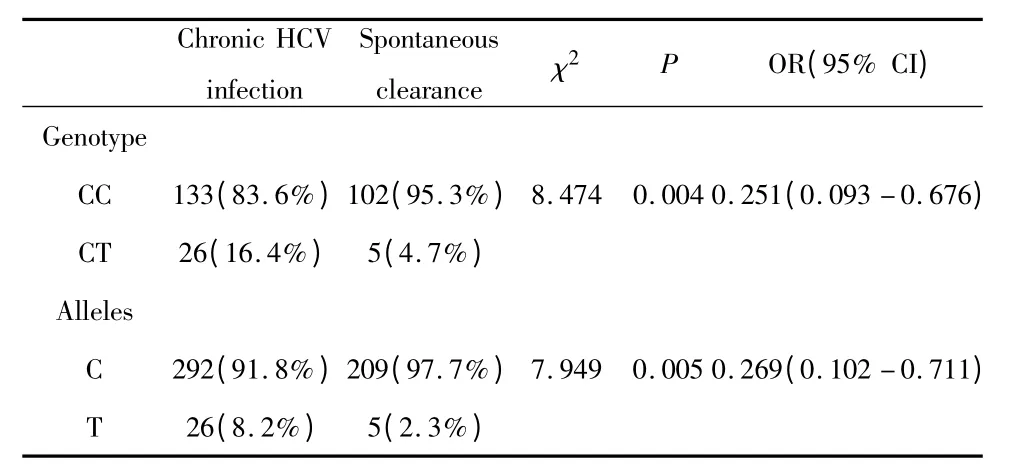
表4 rs12979860 基因型、等位基因在慢性HCV 感染组和自发清除HCV 组的分布Tab.4 rs12979860 genotype and allele distribution in chronic HCV infection and spontaneous HCV clearance
3 讨论
IL-28B 编码基因位于19 号染色体长臂(19q13.13),全长1.58 ×103bp,由6 个外显子和5个内含子组成,编码IFN-λ3,主要在树突细胞和外周血单核细胞等抗原呈递细胞中表达。IFN-λ3 属于Ⅲ型干扰素家族成员(即Interferon-λs,IFN-λs),其信号转导机制是通过诱导受体异二聚体,激活JAK-STAT 通路上调干扰素刺激基因(IFNstimulated genes,ISGs)发挥直接抗病毒、抑制细胞生长和免疫调控作用。近年来,各国学者通过全基因组关联分析(GWAS)研究发现:IL-28B 区域附近7个SNP 位点的基因多态性与HCV 感染的自发清除高度相关,而且还与丙型肝炎病毒感染者对治疗的应答有关[4,6-9],这些位点包括 rs12979860、rs8099917、rs12980275、rs10853728 等。Ge 等[4]通过对北美1 137 例HCV 基因1 型患者分析发现,在IL-28B 基因区的7 个SNP 中,rs12979860 与HCV 的自发清除和治疗相关性最强,随后各国学者也有陆续报道。然而有关中国人群rs12979860 与HCV 感染相关性的研究还很少见。
本研究通过对HCV 感染人群和健康人群IL-28B rs12979860 基因型和等位基因分布进行了比较,发现CC 基因型和C 等位基因在两组中的分布频 率 几 乎 一 致(88.3% vs 86.6%,94.2% vs 93.3%),没有统计学差异(P >0.05),这与文献报道结论相一致,由此我们推测IL-28B rs12979860 可能与HCV 的易感性并无相关性,C 等位基因对于健康人群可能无保护性作用。目前多数学者在研究IL-28B rs12979860 基因多态性与丙型肝炎相关性时,很少采用健康人群做对照来研究丙型肝炎的易感性,相关的报道也比较少。
Thomas 等[5]对620 例慢性丙肝患者及388 例自发清除患者的基因型进行了分析,发现rs12979860 位点C/T 等位基因中C 和T 所占的比率在自发清除者和慢性感染者中有显著差异,C 等位基因在自发清除患者中的比例明显高于慢性化患者,含CC 基因型的患者比含CT 或TT 基因型患者的HCV 更容易被清除。此后,该发现在许多不同人群中得到印证,即IL-28B rs12979860 位点的CC 基因型在HCV 自发清除人群中均具有较高频率[10,11]。在本研究中,IL-28B rs12979860 位点与HCV 感染相关性的研究结果与国外的主流研究报道类似,自发清除组中CC 基因型分布明显高于慢性感染组(95.3%vs 83.6%),同样自发清除组C 等基因频率也高于慢性感染组(97.7% vs 91.8%)。国内也有研究认为rs12979860 位点与HCV 自发清除并无关联[12]。结果不一致的原因可能与样本数量及人群不同有关。本研究266 名HCV 感染者均来自无偿献血者,感染者均未知自己曾经或现在感染了HCV,也未进行过治疗,这或许更能反应IL-28B rs12979860 基因多态性与人体感染HCV 后自然转归的关联性。
不同种族人群中rs12979860 的等位基因分布频率不尽相同。Ge 等[4]发现对HCV 感染者具有保护作用的C 等位基因在东亚裔人群中最高(95%);Thomas 等[5]研究在另一项随机多种族人群的研究中发现,C 等位基因频率的分布规律,在东亚人群最高,欧洲人群次之,非洲最低。本研究中也发现C等位基因的频率基因(97.7%)远远高于其他人群[13]。同时研究已证明HCV 在不同人群中的清除率也不相同,若单独考虑宿主IL-28B rs12979860 等位基因对HCV 清除人群的影响,东亚人群中的自发清除率可能是最高,但在实际情况中,东亚人群的自发清除率并不是最高的,这可能与所感染的HCV 基因型、宿主遗传等多方面的因素有关。IL-28B rs12979860 不但与HCV 自发清除具有相关性,还与丙型肝炎患者的治疗应答相关。Mangia 等[14]在对慢性丙型肝炎患者的研究中发现IL-28B rs12979860基因型与患者抗病毒治疗的快速病毒学应答(Rapid virological response,RVR)及持续病毒学应答(Sustainde viral response,SVR)也具有较强的相关性。Thomas 等[5]对经PEG-IFN-α(聚乙二醇干扰素α)及RBV(利巴韦林)联合治疗的慢性丙型肝炎患者进行了研究,也发现IL-28B rs12979860 基因C/C 型更易获得SVR,肝内ISGs 表达减少与之高度相关,这跟其他学者研究在不同种族人群中HCV 自发清除率表现出高度一致性[2,4,7,8,15-18],推断其原因可能是IL-28B 基因的遗传变异通过调节肝脏对HCV 的固有免疫反应,使患者在接受外源性IFN 治疗时出现较强的ISGs 反应。由于客观原因的限制,本研究目前尚未开展治疗相关的研究,但这是目前的一个研究热点,也是我们下一步的研究方向。
总之,IL-28B rs12979860 基因多态性在丙型肝炎病毒感染的自发清除和治疗应答过程中都起着重要的作用,C 等位基因可能有利于HCV 的自然清除。本研究的发现将有助于预测HCV 感染后的自然转归及临床治疗方案的制定。
[1]Martins T,Narciso-Schiavon JL,Schiavon Lde L,et al.Epidemiology of hepatitis C virus infection[J].Rev Assoc Med Bras,2011,57:107-112.
[2]Ghany MG,Strader DB,Thomas DL,et al.Diagnosis,management and treatment of hepatitis C:an update[J].Hepatology,2009,49(4):1335-1374.
[3]Global Burden of Hepatitis C Working Group.Global burden of disease(GBD)for hepatitis C[J].Clin Pharmacol,2004,44(1):20-29.
[4]Ge D,Fellay J,Thompson AJ,et al.Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance[J].Nature,2009,461(7262):399-401.
[5]Thomas DL,Thio CL,Martin MP,et al.Genetic variation in IL28B and spontaneous clearance of hepatitis C virus[J].Nature,2009,461(7265):798-801.
[6]Honda M,Sakai A,Yamashita T,et al.Hepatic ISG expression is associated with genetic variation in IL28B and the outcome of IFN therapy for chronic hepatitis C[J].Gastroenterology,2010,139(2):499-509.
[7]Suppiah V,Moldowan M,Ahlenstiel G,et al.IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy[J].Nat Genet,2009,41(10):1100-1104.
[8]Tanaka Y,Nishida N,Sugiyama M,et al.Genome-wide association of IL28B with response to pegylated interfere-alpha and ribavirin therapy for chronic hepatitis C[J].Nat Genet,2009,41(10):1105-1181.
[9]沈文娟,哈明昊.白细胞介素28B 基因多态性与慢性HBV、HCV 感染的相关性[J].临床肝胆病杂志,2014,30(10):1087-1090.
[10]Montes-Cano MA,García-Lozano JR,Abad-Molina C,et al.Interleukin-28B genetic variants and hepatitis virus infection by different viral genotypes[J].Hepatology,2010,52(1):33-37.
[11]Tillmann HL,Thompson AJ,Patel K,et al.A polymorphism near IL28B is associated with spontaneous clearance of acute hepatitis C virus and jaundice[J].Gastroenterology,2010,139 (5):1586-1592.
[12]丛 瑞,佟小非,刘三都,等.白细胞介素28B(IL-28B)基因多态性与丙型肝炎病毒(HCV)感染者自发清除的相关性[J].首都医科大学学报,2012,33(3):326-329.
[13]马 柯,张阿梅,夏雪山.IL28B 在HCV 感染中的作用和应用前景[J].遗传,2013,35(11):1244-1252.
[14]Mangia A,Thompson AJ,Santoro R,et al.An IL-28B Polymorphism determines treatment response of hepatitis C virus genotype 2 or 3 patients who do not achieve a rapid virologic response[J].Gastroenterology,2010,139(3):821-827.
[15]Zeuzem S,Berg T,Moeller B,et al.Expert opinion on the treatment of patients with chronic hepatitis C[J].J Viral Hepatitis,2009,16(2):75-90.
[16]Hadziyannis SJ,Sette H,Morgan TR,et al.Peginterferon-alpha2a and ribavirin combination therapy in chronic hepatitis C-Arandomized study of treatment duration and ribavirin dose[J].Ann Intern Med,2004,140(5):346-355.
[17]Liu CH,Liu CJ,Lin CL,et al.Pegylated interferon-alpha-2a plus ribavirin for treatment-naive Asian patients with hepatitis C virus genotype 1 infection:a multicenter,randomized controlled trial[J].Clin Infect Dis,2008,47(10):1260-1269.
[18]Yan KK,Guirgis M,Dinh T,et al.Treatment responses in Asians and Caucasians with chronic hepatitis Cinfection[J].World J Gastroenterol,2008,14(21):416-420.