不同产地尖顶羊肚菌多酚组成及抗氧化活性研究
卢可可,谭玉荣,吴素蕊,明 建,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
不同产地尖顶羊肚菌多酚组成及抗氧化活性研究
卢可可1,谭玉荣1,吴素蕊2,明 建1,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
摘 要:为研究不同产地羊肚菌多酚的抗氧化活性及组成,以3 种不同产地(云南、西藏、新疆)尖顶羊肚菌为原料,提取羊肚菌游离酚和结合酚,测定其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、还原力、2,2’-联苯-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除能力和抗氧化能力指数(oxygen radical absorbance capacity,ORAC)值,并通过高效液相色谱(high performance liquid chromatography,HPLC)分析其组分。结果表明,3 种尖顶羊肚菌平均总酚含量为5.958 mg GAE/g,游离酚约为结合酚的25 倍;云南尖顶羊肚菌游离酚、结合酚含量最高((6.157±0.192)、(0.250±0.018) mg GAE/g),西藏尖顶羊肚菌游离酚、结合酚含量最低((4.928±0.045)、(0.188±0.026) mg GAE/g)。3 种尖顶羊肚菌多酚组分主要为酚酸和黄酮,组成较一致,但含量差异显著。体外抗氧化结果表明:3 种尖顶羊肚菌多酚均具有一定的抗氧化活性,其中对DPPH自由基的清除能力最强;西藏尖顶羊肚菌多酚的DPPH自由基清除能力和还原力最强;新疆尖顶羊肚菌多酚的ABTS+·清除能力最强,ORAC值也最高。
关键词:尖顶羊肚菌;多酚;抗氧化活性;抗氧化能力指数;高效液相色谱
尖顶羊肚菌(Morchella conica Pers.)别名圆锥羊肚菌、阳雀菌,隶属于子囊菌门(Ascomycota)子囊菌纲(Ascomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)羊肚菌属(Morchella),是一种珍贵的食药用菌[1]。尖顶羊肚菌是我国羊肚菌中最常见品种之一,主要分布在云南、西藏、新疆等地。已有研究表明尖顶羊肚菌营养丰富,药用价值极高,富含蛋白质、纤维素、矿质元素(包括锌、铁等微量元素)和多种氨基酸,其中有7 种为人体必需氨基酸[2];另外尖顶羊肚菌中还含有多种活性物质,如多糖[3]等,具有抗氧化[3]、抗增殖[4]、降血压[5]、降血脂[6]和抗衰老[7]等功效。人们普遍认为,食用菌的生理功能主要是由食用菌多糖,特别是活性多糖所致[5,7]。近年来,人们进一步发现,植物多酚结构中存在的羟基基团可与体内自由基结合,从而消灭自由基,因而具有抗氧化、抗癌等功能活性[8-9],并成为国内外研究的热点。目前羊肚菌研究主要集中在羊肚菌分类[10]、地理分布[11]、人工栽培[12]和发酵产物[13]、活性多糖提取纯化及功能活性[14]等,而对羊肚菌多酚类物质的研究还鲜有报道。
本实验以3 种不同产地(云南、西藏、新疆)尖顶羊肚菌为原料,提取尖顶羊肚菌游离酚和结合酚,并对其体外抗氧化活性进行测定,比较不同品种尖顶羊肚菌多酚含量及抗氧化活性,为尖顶羊肚菌综合利用和产品开发提供参考。
1 材料与方法
1.1材料与试剂
云南尖顶羊肚菌(Morchella conica Pers. Yunnan)、西藏尖顶羊肚菌(Morchella conica Pers. Tibet)、新疆尖顶羊肚菌(Morchella conica Pers. Xinjiang),由中华全国供销合作总社昆明食用菌研究所提供。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、抗坏血酸(VC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、2,2’-联苯-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、荧光素钠盐(fluorescein disodium salt,FL)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox,分析纯) 美国Sigma公司;2,2’-偶氮二异丁基脒盐酸盐(2,2’-azobis(2-methylpropionamidine)dihydrochloride,ABAP) 日本Wako Chemicals公司;甲醇(色谱级) 天津四友精细化学品有限公司;其他试剂均为分析纯。
1.2仪器与设备
DHG-9140A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;JYL-A110粉碎机 上海恒平科学仪器有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;VDRTEX-5漩涡振荡器 其林贝尔仪器制造有限公司;XHF-D均质机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发仪、SHZ-III循环水真空泵 上海亚荣生化仪器厂;5810型台式高速离心机 德国Eppendorf公司;TGL-16G离心机 上海安亭科学仪器厂;DF8517冰箱(-80 ℃) 韩国Ilshin公司;722分光光度计 上海精科科学仪器厂;KQ-100型超声波清洗器昆山市超声仪器有限公司;PB-10 pH计 德国赛多利斯公司;SpectraMax M2多功能酶标仪 美国Molecular公司。
1.3方法
1.3.1 材料预处理
3 种尖顶羊肚菌采摘后12 h内速冻,于-20 ℃条件下冻藏,实验前取出冷冻羊肚菌于50 ℃烘箱烘干至恒质量,分别用中药粉碎机粉碎,过80 目筛后密封备用。
1.3.2 尖顶羊肚菌多酚的提取
1.3.2.1 游离酚的提取
参考Okarter等[15]的方法,并根据实验室条件稍作修改。准确称取2.00 g样品于100 mL离心管中,加入50 mL 80%的预冻丙酮溶液(-4 ℃),均质2 min后充分搅拌提取10 min。2 500×g离心10 min,取上清液。残渣重复提取一次,合并上清液,抽滤后于45 ℃旋转蒸干,用甲醇定容至25 mL。过0.45 μm有机滤膜后贮于-80 ℃条件下备用。
1.3.2.2 结合酚的提取
参考Nuntila等[16]的方法,并根据实验室条件稍作修改。收集1.3.2.1节游离酚提取后的残渣,加入20 mL 2 mol/L NaOH溶液,室温处理1.5 h,再用浓盐酸调至pH 2左右。加入正己烷25 mL,放置10 min后离心,除去脂肪层。加入20 mL乙酸乙酯并充分搅拌提取10 min,2 500×g离心后取上清液,重复提取5 次(每次离心加大离心率500×g),合并上清液,抽滤后于45 ℃旋转蒸干,用甲醇定容至10 mL。过0.45 μm有机滤膜后贮于-80 ℃备用。
1.3.3 多酚含量测定
没食子酸标准曲线制作:参考Chu Yifang等[17]的方法,称取25 mg没食子酸,加入适量去离子水充分溶解,定容至25 mL,得到1 mg/mL的没食子酸溶液。取5 mL 1 mg/mL的没食子酸溶液,用去离子水定容至50 mL容量瓶中,即得0.1 mg/mL的没食子酸溶液,然后配成0、20、100、150、200、300、400、500、600 μg/mL的没食子酸标准液。取200 μL标准液加入试管中,再依次加入800 μL去离子水、200 μL Folin-酚试剂,振摇试管使样品充分混合,避光保存6 min,再加入2 mL 7% Na2CO3溶液和1.6 mL去离子水,在避光条件下放置90 min后于760 nm波长处测定吸光度。以多酚质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程为y=0.004 3x+0.016 8(R2=0.998 3)。
羊肚菌多酚含量测定:采用Folin-酚法,取200 μL提取液(可作适当稀释)并用去离子水补至1 mL,后续操作同标准曲线的制备。结果以每克羊肚菌样品中所含的没食子酸当量(mg GAE/g)表示。每个样品做3 组平行,结果表示为
1.3.4 尖顶羊肚菌多酚抗氧化活性测定
1.3.4.1 DPPH自由基清除率测定
参考Cheung等[18]的方法,将多酚提取液做相应稀释后,取1 mL不同质量浓度的样液和5 mL 0.1 mmol/L的DPPH溶液加入到10 mL的试管中,以抗坏血酸作为对照,混合均匀后在室温条件下避光反应50 min,然后于520 nm波长处测定吸光度Ai,以甲醇溶液做试剂空白,测定空白样吸光度Aj。按公式(1)计算样品DPPH自由基清除率。
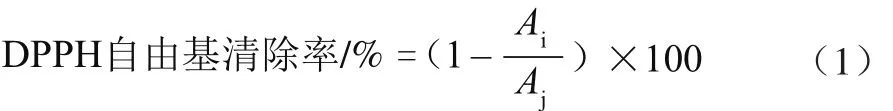
1.3.4.2 还原力测定
参考Ardestani等[19]的方法,将多酚提取液做相应稀释后,取1 mL不同质量浓度的样液、25 mL磷酸盐缓冲液(phosphate buffered saline,PBS,0.2 mol/L,pH 6.6)溶液和25 mL 1%铁氰化钾溶液加入到10 mL的离心管中,混合均匀后在50 ℃条件下水浴20 min。取出冷却后加入25 mL的10%三氯乙酸溶液,混合物于3 000×g离心10 min,取上清液25 mL,再加入25 mL去离子水和0.5 mL 0.1%氯化铁溶液,混合均匀后于700 nm波长处测定吸光度,以吸光度表示还原力,吸光度越大,还原力越大。以甲醇溶液做空白,抗坏血酸作为对照。
1.3.4.3 ABTS+·清除率测定
参考Soong等[20]的方法,即将5 mL的7 mmol/L ABTS溶液和88 μL的140 mmol/L过硫酸钾溶液混合,在室温、避光条件下静置过夜(12~16 h),形成ABTS+·储备液。将生成的ABTS+·溶液用10 mmol/L pH 7.4的磷酸盐缓冲液稀释,使其在室温条 件下734 nm波长处的吸光度为0.70±0.02,得到ABTS+·工作液。将多酚提取液做相应稀释后,取3 mL不同浓度的样品液和1 mL ABTS+·工作液于10 mL的试管中,以抗坏血酸为对照,混合均匀后30 ℃水浴反应6 min,然后于734 nm波长处测定吸光度Ai,以甲醇溶液做试剂空白,测定空白样吸光度Aj。按公式(2)计算样品的ABTS+·清除率。
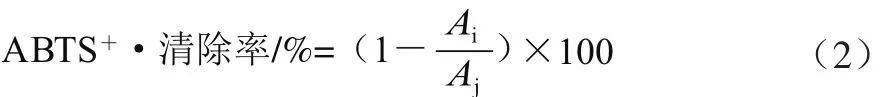
为直观表现不同样品的DPPH自由基和ABTS+·清除能力的大小,本实验引入半数抑制率IC50值作为评价标准[21],即清除率达到50%时所需抗氧化剂的质量浓度(μg/mL),IC50值越小,说明抗氧化剂的抗氧化效果越好。1.3.4.4抗氧化能力指数(oxygen radical absorbance capacity,ORAC)值测定
参照Wolfe等[22]的方法,并根据本实验室条件稍作修改,分别精确吸取20 μL磷酸盐缓冲液(空白液)、Trolox标准液(6.25 μmol/L)和不同质量浓度的样品液,一式三份点样到96 孔黑色底部透明的酶标板。在37 ℃温育10 min,设置酶标仪参数。加入200 μL 0.96 μmol/L的荧光工作液,再在37 ℃温育至少20 min并间歇摇动,等酶标板温度达到37 ℃后,迅速加入新鲜配制的119 mmol/L ABAP工作液20 μL,于激发波长485 nm、入射波长520 nm条件下立即读数,每4.5 min进行一次读数,共检测2.5 h。按照公式(3)计算荧光衰减曲线下的面积(the area of fluorescence decay curve,AUC),按照公式(4)计算ORAC值。
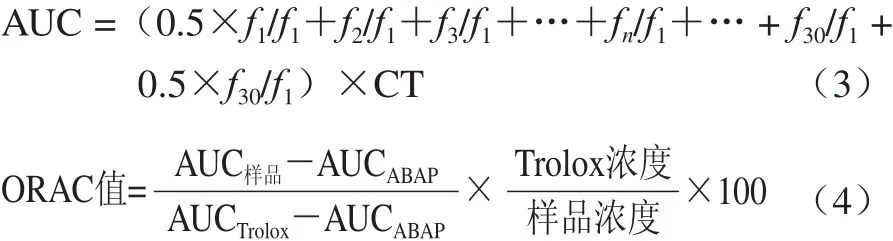
式中:f1为第一次荧光读数值;fn为第n次荧光读数值;CT为间隔测定时间。
最终的ORAC值以Trolox当量表示(μmol TE/100 g)。
1.3.5 高效液相色谱(high performance liquid chromatography,HPLC)法鉴定尖顶羊肚菌多酚组分
1.3.5.1 标准品及样品溶液的配制
标准品配制:准确称取没食子酸、原儿茶酸、对羟基苯甲酸、儿茶素和绿原酸标准品各10 mg,用甲醇溶解后定容至10 mL,并稀释成不同质量浓度溶液(0、1、5、25、50、100、200 μg/mL),经0.45 μm有机滤膜过滤,备用。
样品配制:取羊肚菌多酚提取液 1 mL,用0.45 μm有机膜过滤,备用。
1.3.5.2 色谱条件
参照Liang等[23]的方法并适当修改:色谱柱:Thermo BDS C18(250 mm×4.6 mm,5 μm),流动相A:0.2 %甲酸;流动相B:100%乙腈;梯度洗脱程序为0~5 min,B为10%;5~25 min,B为10%~40%;25~35 min,B为40%~90%;35~40 min,B为90%;40~45 min,B为90%~10%;45~50 min,B为10%。流速:0.7 mL/min;进样量:8 μL;柱温:40 ℃;检测波长280 nm。
1.4数据处理
数据采用Origin 8.0统计分析,实验重复3次,结果用±s表 示,并用SPSS软件进行统计处理,采用ANOVA进行Turkey多重比较分析(P<0.05)。
2 结果与分析
2.1不同产地尖顶羊肚菌多酚含量分析
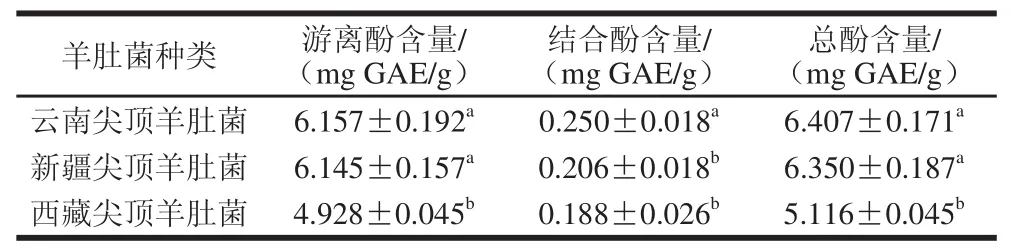
表1 3种尖顶羊肚菌中游离酚、结合酚和总酚含量Table 1 Contents of free, bound and total polyphenols in three kinds of Morchella cnica Pers.
由表1可知,3 种尖顶羊肚菌游离酚含量为4.928~6.157 mg GAE/g,结合酚含量为0.188~0.250 mg GAE/g,游离酚含量约为结合酚25 倍。对于游离酚而言,云南尖顶羊肚菌含量最高((6.157±0.192) mg GAE/g),西藏尖顶羊肚菌含量最低((4.928±0.045) mg GAE/g),新疆和云南尖顶羊肚菌含量无显著差异,但均显著高于西藏尖顶羊肚菌(P<0.05)。对于结合酚而言,云南尖顶羊肚菌最高(0.250 mg GAE/g),显著高于新疆和西藏尖顶羊肚菌(P<0.05),西藏尖顶羊肚菌含量最低(0.188 mg GAE/g)。与其他植物比较,羊肚菌中多酚含量也属较高水平,3 种尖顶羊肚菌平均总酚含量可达5.958 mg GAE/g,比香菇[24]和香蕉果肉[25]中的多酚含量高,但略低于苹果果肉多酚[26]。
2.2不同产地尖顶羊肚菌多酚清除DPPH自由基能力比较

表2 3种尖顶羊肚菌多酚DPPH自由基清除率回归方程Table 2 regression equations for DPPH radical scavengin g capacity of polyphenols in three kinds of Morchella conica Peerrss.
DPPH自由基是一种稳定的自由基,能接受电子或氢自由基,形成一个稳定的反磁性分子,抗氧化剂对DPPH自由基的清除原理,是基于它的供氢能力[27]。表2为3 种不同产地尖顶羊肚菌多酚DPPH自由基清除率回归方程。对比不同质量浓度下多酚提取液DPPH自由基清除能力发现,随着提取液中羊肚菌多酚(游离酚,结合酚)质量浓度升高,其DPPH自由基清除率不断升高。

图1 3种尖顶羊肚菌多酚DPPH自由基清除率(IICC5500)Fig.1 DPPH radical scavenging rates (IICC5500) of polyphenols in three kinds of Morchella conica Pers.
由图1可知,尖顶羊肚菌结合酚清除DPPH自由基能力显著强于游离酚,且两者均强于对照抗坏血酸,说明尖顶羊肚菌多酚具有较强的DPPH自由基清除能力;西藏尖顶羊肚菌游离酚的IC50值(0.572 μg/mL)显著低于云南尖顶羊肚菌(0.737 μg/mL)和新疆尖顶羊肚菌(0.800 μg/mL)(P<0.05);而其结合酚的IC50值(0.061 μg/mL)与新疆尖顶羊肚菌(0.056 μg/mL)无显著差异,但显著低于云南尖顶羊肚菌(0.114 μg/mL)(P<0.05),因此,西藏尖顶羊肚菌多酚清除DPPH自由基能力强于云南和新疆尖顶羊肚菌多酚。
2.3不同产地尖顶羊肚菌多酚的还原力比较
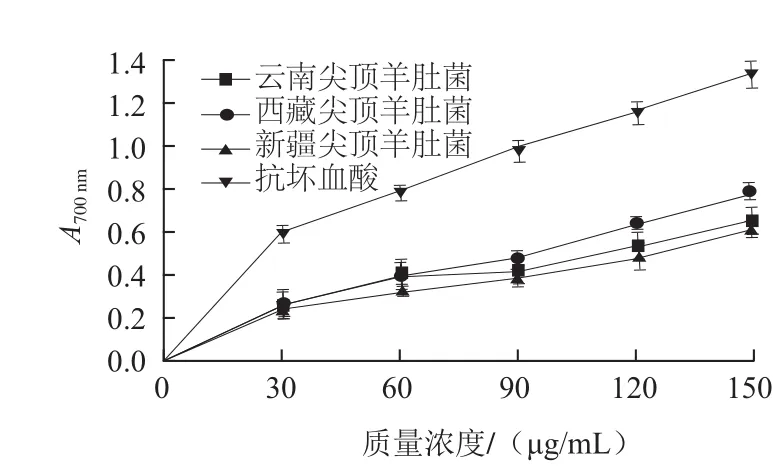
图2 3种尖顶羊肚菌游离酚的还原力Fig.2 Reducing power of free phenols in three kinds of Morchella conica Pers.
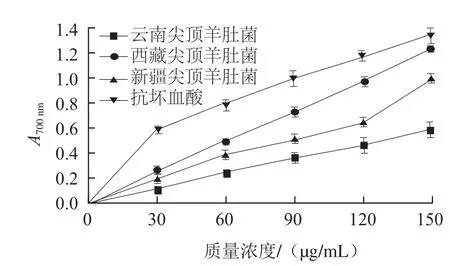
图3 3种不同羊肚菌结合酚的还原力Fig.3 Reducing power of bound phenols in three kinds of Morchella conica Pers.
化合物的还原力是基于Fe3+向Fe2+转换的原理来判断其潜在抗氧化活性的一个重要指标[28]。由图2、3可知,随着多酚提取液质量浓度升高,其吸光度也不断提升,表明其抗氧化能力随多酚质量浓度的增加而提高;同等质量浓度下尖顶羊肚菌多酚还原力弱于对照抗坏血酸。当质量浓度为90 μg/mL时,西藏、云南、新疆羊肚菌游离酚的吸光度分别为0.484、0.422、0.388;结合酚的吸光度分别为0.737、0.512、0.368,表明在一定质量浓度下,结合酚还原力强于游离酚,其中西藏尖顶羊肚菌多酚还原力最强。
2.4不同产地尖顶羊肚菌多酚清除ABTS+·能力比较
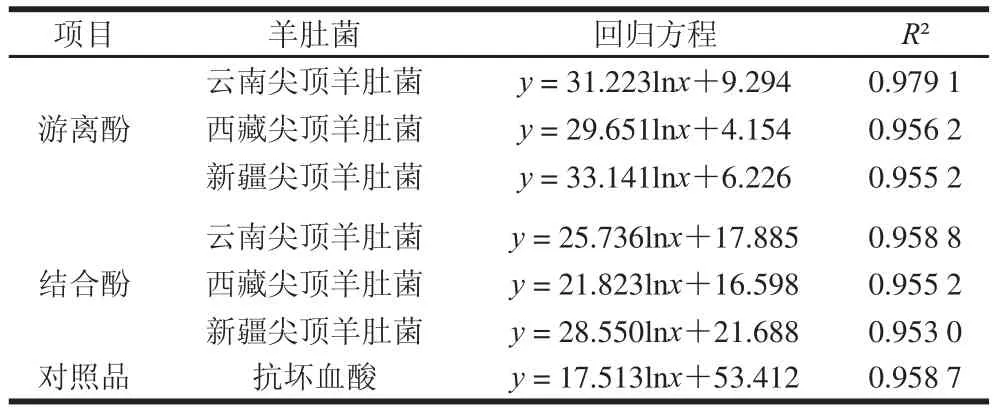
表3 3种尖顶羊肚菌多酚ABTS+·清除率回归方程Table 3 Regression equation of ABTS+radical scavenging capacity off polyphenols in three kinds of Morchella conica Peerrss..
蓝绿色的ABTS+·稳定性高,当存在具有供氢能力的抗氧化剂时,可使其还原成无色的ABTS,根据ABTS+·溶液前后吸光度的变化可测定样品抗氧化能力[29]。表3 为3 种不同产地尖顶羊肚菌多酚ABTS+·清除率回归方程。对比不同质量浓度下多酚提取液ABTS+·清除能力发现,随着羊肚菌多酚(游离酚、结合酚)提取液质量浓度的升高,其ABTS+·清除率不断升高。
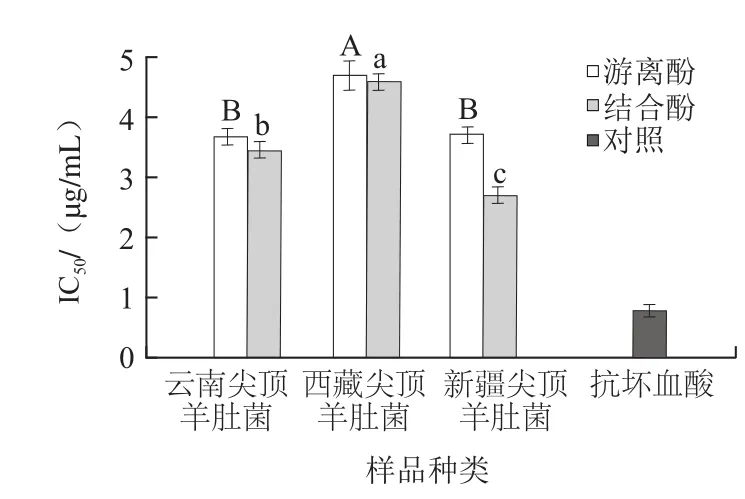
图4 3种尖顶羊肚菌多酚ABTS+·清除率(IICC5500)Fig.4 ABTS+· scavenging capacity (IICC5500) of polyphenols in three kinds of Morchella conica Pers.
由图4可知,尖顶羊肚菌结合酚清除ABTS+·能力强于游离酚,但两者均弱于对照抗坏血酸;新疆尖顶羊肚菌游离酚的IC50值(3.746 μg/mL)显著低于西藏尖顶羊肚菌(4.694 μg/mL),但与云南尖顶羊肚菌(3.683 μg/mL)无显著差异;而其结合酚的IC50值(2.696 μg/mL)显著低于西藏和云南尖顶羊肚菌(P<0.05),表明新疆尖顶羊肚菌多酚具有较好的ABTS+·清除能力。
2.5不同产地尖顶羊肚菌多酚的抗氧化能力指数比较
ORAC法是根据ABAP自由基破坏荧光探针(荧光素钠),使荧光强度产生变化的原理,以Trolox为定量标准,在多功能荧光酶标仪中进行分析的方法。荧光强度变化大小反映ABAP的破坏程度,当抗氧化剂存在时,它可延缓ABAP引起的荧光变化,其抑制程度反映了它对自由基的抗氧化能力[30],ORAC值越大,表明抗氧化剂的抗氧化能力越强。
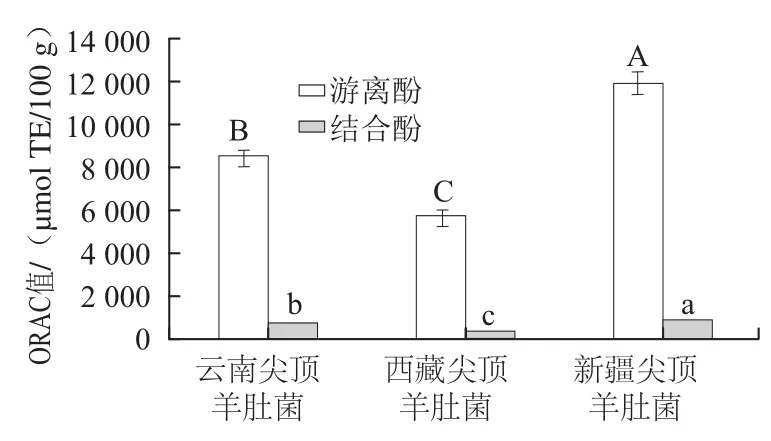
图5 3种尖顶羊肚菌多酚ORAC值Fig.5 ORAC values of polyphenols in three kinds of Morchella conica Pers.
由图5可知,3 种尖顶羊肚菌游离酚的ORAC值均显著高于结合酚(P<0.05);新疆尖顶羊肚菌游离酚和结合酚的ORAC值分别为11 973 μmol TE/100 g和916 μmol TE/100 g,均分别显著高于另外两个产地尖顶羊肚菌的游离酚和结合酚(P<0.05),表明新疆尖顶羊肚菌多酚具有较强的抗氧化能力;而西藏尖顶羊肚菌游离酚和结合酚的ORAC值较低,分别为5 774.51、291 μmol TE/100 g,不足新疆尖顶羊肚菌多酚ORAC值的一半。
2.6尖顶羊肚菌多酚组分分析
由紫外二极管矩阵检测器200~600 nm波长范围内扫描可得各色谱峰的光谱图。由于各多酚类物质在280 nm波长左右均有较大吸收,因此实验选择检测波长为280 nm。图6为5 种标准品的高效液相色谱图。通过计算峰面 积与样品质量浓度之间的关系,得到多酚标准品的回归方程,见表4。
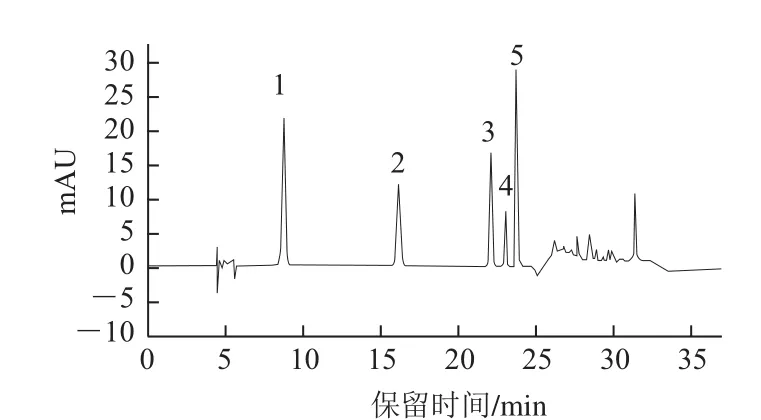
图6 多酚标准品HPLC色谱图Fig.6 Chromatogram of polyphenol standard mixture

表4 5种标准品的回归方程Table 4 regression equations of 5 stnard substances
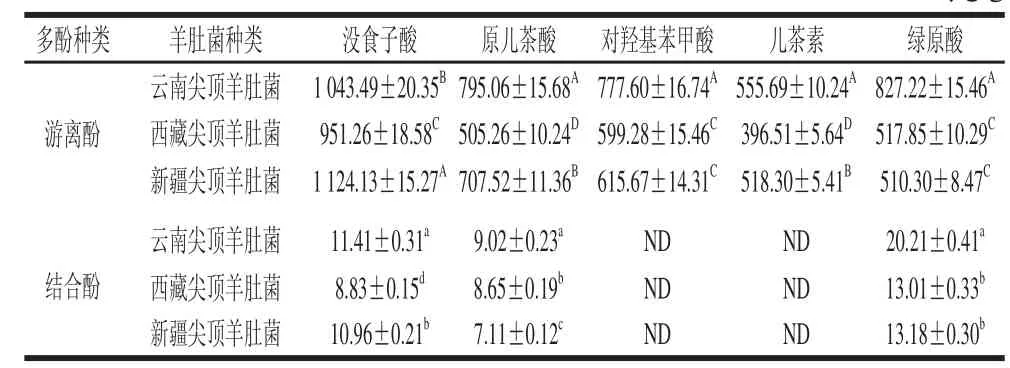
表5 3种尖顶羊肚菌多酚成分和含量Table 5 Compounds and contents of polyphenols in Morchella conica Peerrss. μg/g
由表5可知,游离酚主要由没食子酸、原儿茶酸、对羟基苯甲酸、绿原酸4 种酚酸和1 种黄酮类物质儿茶素组成,结合酚主要由没食子酸、原儿茶酸、绿原酸3 种酚酸组成,说明尖顶羊肚菌多酚组分主要为酚酸类,少量为黄酮,与Palacios等[31]研究结果一致。3 种尖顶羊肚菌游离酚组分中,没食子酸含量均为最高,分别为云南尖顶羊肚菌1 043.49 μg/g、西藏尖顶羊肚菌951.20 μg/g、新疆尖顶羊肚菌1 124.13 μg/g;儿茶素含量较低,分别为云南尖顶羊肚菌555.69 μg/g、西藏尖顶羊肚菌396.51 μg/g、新疆尖顶羊肚菌518.30 μg/g。结合酚组分中,绿原酸含量最高,分别为云南尖顶羊肚菌20.21 μg/g、西藏尖顶羊肚菌13.01 μg/g、新疆尖顶羊肚菌13.18 μg/g;原儿茶酸含量最低,分别为云南尖顶羊肚菌9.02 μg/g、西藏尖顶羊肚菌8.65 μg/g、新疆尖顶羊肚菌7.11 μg/g。3 种尖顶羊肚菌多酚物质组成较一致,但组分含量差异明显。
3 结 论
3 种不同产地尖顶羊肚菌平均总酚含量为5.958 mg GAE/g,其中游离酚含量为4.928~6.157 mg GAE/g,结合酚含量为0.188~0.250 mg GAE/g,游离酚约为结合酚的25倍;云南尖顶羊肚菌结合酚含量最高((0.250±0.018) mg GAE/g ),显著高于新疆和西藏尖顶羊肚菌(P<0.05),西藏尖顶羊肚菌结合酚含量最低((0.188±0.026) mg GAE/g );云南尖顶羊肚菌游离酚含量最高((6.157±0.192) mg GAE/g ),西藏尖顶羊肚菌游离酚含量最低(4.928±0.045 mg GAE/g )。体外抗氧化结果表明,3 种不同产地尖顶羊肚菌多酚均具有一定的抗氧化活性,其中对DPPH自由基的清除能力最强;西藏尖顶羊肚菌多酚的DPPH自由基清除能力和还原力最强,但其ABTS+·清除能力和ORAC值最低;新疆尖顶羊肚菌多酚的ABTS+·清除能力最强和ORAC值最高,而其DPPH自由基清除能力和还原力较弱。HPLC鉴定发现3 种尖顶羊肚菌多酚组成一致,但组分含量差异较大。多酚类物质抗氧化活性是其各组分综合作用的结果,不同组分对其活性的贡献并不相同[32],而本研究也发现不同产地尖顶羊肚菌多酚含量与体外抗氧化活性并不存在线性关系,而且在不同抗氧化活性评价体系中的抗氧化效果不尽相同,这与多酚各组分含量差异、粗提物中其他非酚类抗氧化化合物的存在及各化学抗氧化方法原理各异有密切关系。
因此,在后续的研究中应对多酚粗提物进行纯化,并利用液相色谱-质谱联用法深入探讨多酚组成及含量,结合体内外抗氧化活性测定方法,如细胞抗氧化活性(cellular antioxidant activity,CAA)和动物实验等,综合考虑化学抗氧化效果,进而合理评价食用菌多酚的抗氧化活性。
参考文献:
[1]卯晓岚. 中国蕈菌[M]. 北京: 科学出版社, 2009: 750-777.
[2]刘蓓, 吴素蕊, 朱萍, 等. 滇西北地区四种羊肚菌营养成分分析比较[J].食品工业科技, 2012, 33(1): 363-365.
[3]HUANG Mian, ZHANG Song, ZHANG Minglong. Effects of polysaccharides from Morchella conica on nitric[J]. Applied Microbiology and Biotechnology, 2012, 94(3): 763-771.
[4]马利, 李霞, 张松. 尖顶羊肚菌胞外多糖提取物对皮肤成纤维细胞增殖和衰老的影响[J]. 菌物学报, 2014, 33(2): 385-393.
[5]王亚辉, 梅晓灯, 张松. 尖顶羊肚菌活性提取物降血压作用的研究[J].现代食品科技, 2013, 29(9): 2147-2151.
[6]殷伟伟, 张松, 吴金凤. 尖顶羊肚菌活性提取物降血脂作用的研究[J].菌物学报, 2009, 28(6): 873-877.
[7]兰瑛, 潘志福, 张松, 等. 尖顶羊肚菌胞外多糖提取物对果蝇寿命的影响[J]. 中国食用菌, 2010, 29(4): 43-45.
[8]CHOI D Y, LEE Y J, HONG J T, et al. Antioxidant properties of natural polyphenols and their therapeutic potentials for Alzheimer’s disease[J]. Brain Research Bulletin, 2012, 87(2/3): 144-153.
[9]HERVERT-HERNÁNDEZ D, GARCÍA O P, ROSADO J L, et al. The contribution of fruits and vegetables to dietary intake of polyphenols and antioxidant capacity in a Mexican rural diet: importance of fruit and vegetable variety[J]. Food Research International, 2011, 44(5): 1182-1189.
[10]KELLNER H, RENKER C, BUSCOT F. Species diversity within the Morchella esculenta group (Ascomycota: Morchellaceae) in Germany and France[J]. Organisms Diversity & Evolution, 2005, 5(2): 101-107.
[11]DU X H, ZHAO Q, O’DONNELL K, et al. Multigene molecular phylogenetics reveals true morels (Morchella) are especially speciesrich in China[J]. Fungal Genetics and Biology, 2012, 49(6): 455-469.
[12]KANWAL H K, REDDY M S. The effect of carbon and nitrogen sources on the formation of sclerotia in Morchella spp.[J]. Annals of Microbiology, 2012, 62(1): 165-168.
[13]吕晓莲, 郭宏, 贾建会, 等. 羊肚菌发酵产物功能性研究[J]. 食品科学, 2013, 34(1): 311-314.
[14]SU Chaoan, XU Xiaoyan, LIU Deyun, et al. Isolation and characterization of exopolysaccharide with immunomodulatory activity from fermentation broth of Morchella conica[J/OL]. DARU Journal of Pharmaceutical Sciences, 2013, 21(1): 5. doi: 10.1186/2008-2231-21-5.
[15]OKARTER N, LIU C S, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257.
[16]NUUTILA A, KAMMIOVIRTA K, OKSMAN-CALDENTEY K M. Comparison of methods for the hydrolysis of flavonoids and phenolic acids from onion and spinach for HPLC analysis[J]. Food Chemistry, 2002, 76(4): 519-525.
[17]CHU Yifang, SUN Jie, WU Xianzhong, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916.
[18]CHEUNG L M, CHEUNG P C K, OOI V E C. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry, 2003, 81(2): 249-255.
[19]ARDESTANI A, YAZDANPARAST R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry, 2007, 104(1): 21-29.
[20]SOONG Y Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417.
[21]邱金东, 汤昆. DPPH和ABTS法测定核桃仁的体外抗氧化活性[J].中成药, 2008, 30(8): 1215-1217.
[22]WOLFE K L, KANG Xinmei, HE Xiangjiu, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8418-8426.
[23]LIANG Q, CUI J, LI H, et al. Florets of sunflower (Helianthus annuus L.): potential new sources of dietary fiber and phenolic acids[J]. Journal of Agricultural and Food Chemistry, 2013, 61(14): 3435-3442.
[24]CHOI Y, LEE S M, CHUN J, et al. Influence of heat treatment on the antioxidant activities and polyphenolic compounds of Shiitake (Lentinus edodes) mushroom[J]. Food Chemistry, 2006, 99: 381-387.
[25]李健, 杨昌鹏, 李群梅, 等. 香蕉果肉多酚提取工艺[J]. 食品研究与开发, 2010, 31(5): 58-61.
[26]李莉, 田士林. 苹果中多酚含量测定与比较[J]. 安徽农业科学, 2006, 34(20): 5212-5236.
[27]BLOIS M S. Antioxidants determination by the use of a stab le free radical[J]. Nature, 1958, 181: 1199-1200.
[28]OYAIZU M. Studies on product of browning reaction prepared from glucose amine[J]. Japanese Journal of Nutrition, 1986, 44(6): 307-315.
[29]RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237.
[30]OU B, HAMPSCH-WOODILL M, PRIOR R L, Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4619-4626.
[31]PALACIOS I, LOZANO M, MORO C, et al. Antioxidant properties of phenolic compounds occurring in edible mushrooms[J]. Food Chemistry, 2011, 128(3): 674-678.
[32]SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205.
Polyphenol Components and Antioxidant Activity of Morchella conica Pers. from Three Different Habitats
LU Keke1, TAN Yurong1, WU Surui2, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooporatives, Kunming 650223, China; 3. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
Abstract:This study was conducted to investigate the phenolic components and in vitro antioxidant activity of Morchella conica Pers.. Both free and bound phenols were extracted from M. conica Pers. from three different habitats. Then, the DPPH radical scavenging capacity, reducing power, ABTS+· scavenging capacity and oxygen radical absorbance capacity (ORAC) of the extracts were determined, and the phenolic components were identified by HPLC. The results revealed that the average total polyphenol content of three M. conica Pers. was approximately 5.958 mg GAE/g, the content of free phenols was approximately 25 times higher than bound phenols. The highest contents ((6.157 ± 0.192) and (0.250 ± 0.018) mg GAE/g, respectively) of both free and bound phenols were detected in M. conica Pers. from Yunnan compared to M. conica Pers. from Tibet with the lowest contents of (4.928 ± 0.045) and (0.188 ± 0.026) mg GAE/g, respectively. Phenolic acids and flavonoids were the major components of polyphenols, and their compositions were consistent among three growing areas although the contents were significantly different. Polyphenols in three different M. conica Pers., had a certain degree of antioxidant capacity, especially DPPH radical scavenging capacity. The DPPH radical scavenging capacity and reducing power of polyphenols in M. conica Pers. from Tibet were the strongest, while M. conica Pers. from Xinjiang possessed the highest ABTS+· scavenging capacity and ORAC value.
Key words:Morchella conica Pers.; polyphenols; antioxidant activity; oxygen radical absorbance capacity (ORAC); high performance liquid chromatography (HPLC)
doi:10.7506/spkx1002-6630-201507002
中图分类号:R151.2
文献标志码:A
文章编号:1002-6630(2015)07-0006-07
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com
作者简介:卢可可(1991—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:lukeke8868@163.com
基金项目:国家自然科学基金面上项目(31471576);“十二五”国家科技支撑计划项目(2013BAD16B01)
收稿日期:2014-10-16

