蛛网膜下腔出血致脑血管痉挛的相关影响因素研究
戴永建,罗俊杰,刘 岳
(湖北医药学院附属人民医院,湖北 十堰 442000)
蛛网膜下腔出血致脑血管痉挛的相关影响因素研究
戴永建,罗俊杰,刘 岳
(湖北医药学院附属人民医院,湖北 十堰 442000)
目的 分析研究蛛网膜下腔出血(SAH)后脑血管痉挛(CVS)发生与各项指标的内在关系,找出其中有明显相关关系的危险因素和保护因素,从而指导临床治疗与预防,降低SAH后因CVS所致病死率与致残率。方法 经过筛选,获得118例符合研究标准的SAH患者临床资料,利用患者入院CT资料统计SAH的出血量和位置、动脉瘤类型,并记录、分析各自入院时的性别、年龄、吸烟史、Hunt-Hess分级、发病与术后意识、是否有过钙离子拮抗剂干预、白细胞计数、血钾、血钠、血钙等相关指标,应用统计学方法对数据进行单因素及多因素Logistic回归分析。结果 患者SAH的量与位置、发病与术后意识、白细胞计数、血钙水平、尼莫地平钙离子拮抗剂使用、Hunt-Hess分级有统计学意义(P均<0.05)。结论 因SAH导致CVS发生的独立危险因素除年龄因素外,Hunt-Hess分级、白细胞计数与CVS的发生率也有明显相关性。尼莫地平之类钙离子拮抗剂的使用可在一定程度上减少因为SAH所致的CVS发生率。发病意识与SAH后CVS的发生率呈正相关 。而血钙水平则与SAH后发生CVS呈负相关关系。临床上要尽早地针对这些因素对患者进行治疗与预防。
蛛网膜下腔出血;脑血管痉挛;危险因素
蛛网膜下腔出血(SAH)是出血性脑血管病的一个类型,分原发性和继发性2种[1]。原发性蛛网膜下腔出血是由于脑表面和脑底的血管破裂出血,血液直接流入蛛网膜下腔所致,又称自发性SAH。脑实质或脑室出血、外伤性硬膜下或硬膜外出血流入蛛网膜下腔为继发性SAH。蛛网膜下腔出血是神经科最常见的急症之一,发病率占急性脑血管病的6%~10%。脑血管痉挛(CVS)是颈内动脉或椎基底动脉系统因多种物理和化学因素综合刺激而出现的一种异常血管状态,是SAH最常见、最严重的并发症之一,患者常有颅内压增高、意识障碍加重等临床症状[2]。CVS的突出意识变化为一种动态的意识变化:由清醒转为嗜睡或昏迷 ,或者由昏迷到清醒到再次昏迷[2]。CVS作为SAH血致残和致死的主要原因,在临床上必须积极进行抢救治疗。本文通过分析118例符合研究标准的SAH患者临床资料,探讨SAH致CVS的影响因素,现报道如下。
1 临床资料
1.1一般资料 收集符合SAH诊断标准的SAH患者118例,男52例,女66例,男女比例为1∶1.29;年龄15~78(48.35 ±18.35)岁。将患者根据是否发生CVS分为2组:CVS组48例,男22例,女26例;年龄15~77(46.23±15.12)岁;无CVS组70例;男30例,女40例;年龄16~78(49.26±19.46)岁。
1.2CVS诊断标准[3-4]SAH症状好转后出现新的症状或加重;意识障碍呈波动性或进行性加重,由清醒至嗜睡或昏迷;出现神经功能缺损症状、刺激症状和局灶性定位体征,如偏瘫、偏身感觉障碍和癫痫等;出现头痛、呕吐、视乳头水肿等颅内压增高症状;在排除再出血、颅内血肿、脑积水和电解质紊乱等的前提条件下,符合上述标准中1项或2项即可诊断为CVS。
1.3研究方法 对2组患者的病情和病理资料进行充分的研究,分析各因素显示的数据资料来确定与CVS发生率 的相关性。利用回归方程分析确定影响CVS发生的危险因素和保护因素。
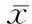
2 结 果
2.1SAH的出血量与位置 评定标准采用Fisher分级系统,当Fisher分级逐级升高时,其对应发生CVS的概率也就越高,其中尤以中度、重度CVS明显 。而Fisher分级很大程度上是来反映SAH的状况,Fisher分级越高,提示SAH出血量越大,蛛网膜下腔积血越明显,也显示CVS的程度愈发严重。在Fisher 3级中有8例重度CVS,Fisher 2级有3例重度CVS发生,经分析二者均出现了SAH同时出现积血现象,部位以环池、四叠体池、脚间池和侧裂池多见。可见SAH出血部位在很大程度上影响着CVS的发生。见表1。
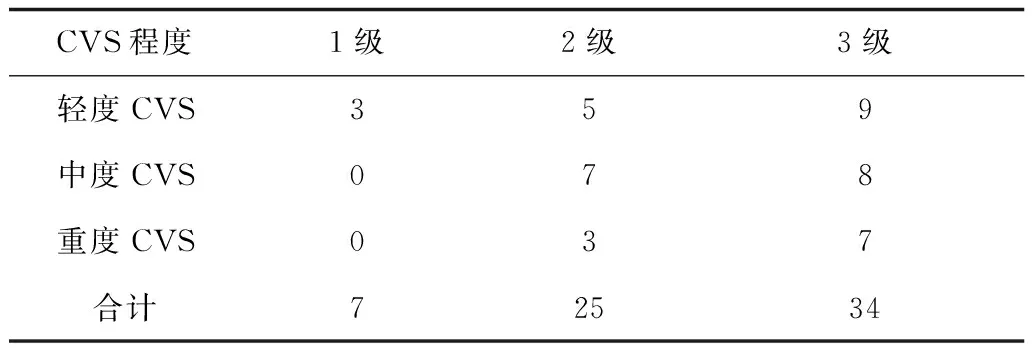
表1 SAH患者Fisher分级与CVS程度的关系 例
2.2年龄 青年组(18~39岁)患者共计32例,发生CVS 5例,发生率为16%;中年组(40~60岁)53例,发生CVS 24例,发生率为45%;老年组(60岁以上)33例,发生CVS 13例,发生率为39%。组间CVS发生率两两比较均有显著性差异,中年组的CVS发生率高于其他2组。
2.3发病意识 意识障碍程度是SAH后CVS的具体表现之一,CVS的突出意识变化为一种动态的意识变化:由清醒转为嗜睡或昏迷 ,或者由昏迷到清醒到再次昏迷。此外由于患者的中枢神经系统的不同程度的损害,因而常伴有偏瘫、偏身知觉障碍、失语等局灶性体征。意识障碍程度与CVS相关性的分析:相关系数为0.413,P=0.000,提示意识障碍程度与CVS发生率呈正相关,但多元Logistic回归分析表明发病意识非CVS发生的独立危险因素。见表2。
2.4白细胞计数 发生CVS的危险性随着白细胞计数增加而增加。利用Logistic回归分析,结果提示SAH发生后白细胞计数升高,并发CVS可能性大。见表2。
2.5Hunt-Hess分级 Hunt-Hess分级与CVS二者的相关系数为0.581,P=0.000,多元Logistic回归分析表明Hunt-Hess分级与CVS成正相关,相关程度中等,分级高者更易发生CVS。见表2。
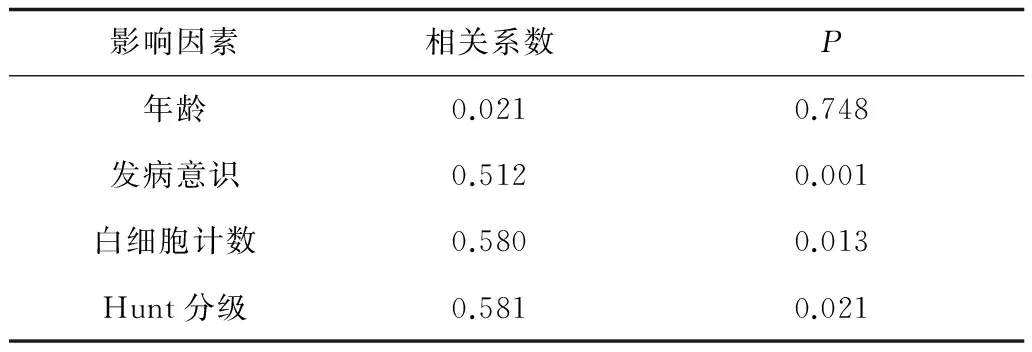
表2 各因素与CVS的相关分析
2.6钙离子拮抗剂(尼莫地平)干预 所有患者急诊经CTA与DSA证实颅内动脉瘤,尼莫地平组加用尼莫地平持续静脉微量泵滴注20 mg/d,连用7 d后改用口服30 mg。结果尼莫地平组CVS率明显低于对照组(P<0.05),表明钙离子拮抗剂使用是CVS发生的负相关因素,可以减少CVS的发生。见表3。
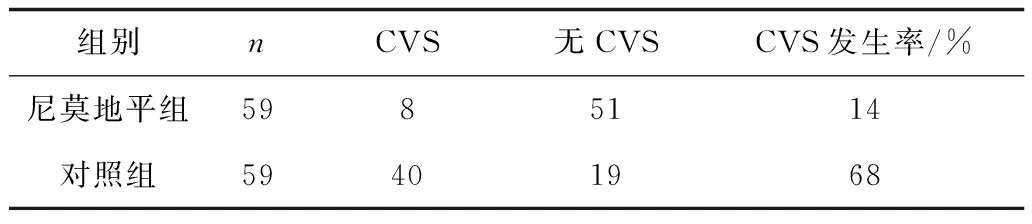
表3 尼莫地平组与对照组CVS发生情况比较 例
2.7血钙水平 血钙分组小于2.2 mmol/L组CVS发生率为58%,2.2~2.6 mmol/L组CVS发生率为15%,大于2.6 mmol/L组CVS发生率为0,小于2.2 mmol/L组与其他2组CVS发生率差异有统计学意义(P均<0.05)。
3 讨 论
近年来,临床加强了对SAH的病理机制的深入研究,CVS是颈内动脉或椎基底动脉系统因多种物理和化学因素综合刺激而出现的一种异常血管状态,是SAH最常见、最严重的并发症之一,患者常有颅内压增高、意识障碍加重等临床症状,临床研究发现,引发SAH迟发性脑血管缺血和梗死的一个主要原因就是CVS,CVS的突出意识变化为一种动态的意识变化:由清醒转为嗜睡或昏迷,或者由昏迷到清醒到再次昏迷[5]。CVS作为SAH致残和致死的主要原因,在临床上必须积极进行抢救治疗。由于患者的中枢神经系统有不同程度的损害,因而常伴有偏瘫、偏身知觉障碍、失语等局灶性体征[6]。CVS分为2期,包括急性期与慢性痉挛期,前者多见于SAH后1~3 d,后者可持续10~14 d,之后逐渐消退。急性脑血管痉挛期病死率高,此期临床表现的特征表现有颅内压增高、脑血流量降低和脑灌注压降低[6]。CVS一般发生在SAH后的3~4 d,在第2周时其程度最严重,可持续到第3或第4周。经过不断研究结果表明,CVS因常引起严重的局部脑组织缺血或迟发性缺血性脑损害,严重者甚至出现脑梗死,是SAH致死和致残的主要原因[7]。临床上,CVS特指一种有别于其他类型血管收缩的脑动脉狭窄,在特定时候症状严重,甚至具有不可逆转性,带来了较高的迟发性缺血性神经功能障碍和高病死率,若是患者出血较多,则足够引起CVS。另有研究学者认为[8],这极有可能是由于患者脑内囊状动脉瘤所引起的,由于血管痉挛导致的SAH,会使得患者病情变得更加复杂。在大量发表的文献资料中显示[9-10]:经过对SAH动物模型研究,分析其出血后动脉壁的病理变化情况,确实存在着动脉壁的病理改变,而在人体研究中,通过对组织浸泡的组织学观察研究发现,在电子显微镜下观察,能够发现早期内皮细胞层退行性变,包括内皮细胞间的紧密连接中断和空泡行成连接中断等,同时,也发现少数血管腔内微血栓和内皮层脱落的发生。通常情况下,SAH后血凝块会覆盖脑动脉壁,经过数天后,在血凝块的诱导下,血管收缩,并伴随内膜和内弹力膜的皱缩和增厚,随着血管的持续收缩,就会导致动脉壁发生功能受损和超微结构的损伤,如内侧肌坏死、内弹力膜破裂、紧密连接丧失、内皮空泡化,经过数周后,多数血管管径恢复正常,而超微结构却持续表现为异常,但是值得注意的是,在血管痉挛晚期,血管内膜的增厚属于细胞增生的结果,这对于血管狭窄影响并不大。朱海清等[11]多变量分析表明出血量与日血量清除率是因SAH导致CVS发生的危险因素,出血部位多集中在环池、四叠体池、脚间池和侧裂池。可见蛛网膜下腔出血部位在很大程度上影响着CVS的发生。
因SAH导致CVS发生的独立危险因素除年龄因素外,Hunt-Hess分级、白细胞计数与CVS的发生率也有明显相关性[12]。尼莫地平之类钙离子拮抗剂的使用可在一定程度上减少因为SAH所致的CVS发生率。发病意识与SAH后CVS的发生率呈正相关 。而血钙水平则与SAH后发生CVS为负相关关系。本研究发现中年组CVS发生率高于青年组、老年组,年龄为预示CVS发生的独立危险因素。细胞内钙离子浓度的增加与细胞膜的去极化机制影响着血管壁平滑肌的收缩,因此血钙水平可能对CVS的发生发展有影响,通过秩和检验表明血钙水平与CVS的发生率之间是负相关关系,且经近一步研究发现服用钙离子拮抗剂(尼莫地平),CVS发生率会明显降低[13]。意识障碍程度是SAH后CVS程度的具体表现之一,患者由清醒转为嗜睡或昏迷 ,或者由昏迷到清醒到再次昏迷等动态的意识变化是CVS的突出意识变化[6]。此外由于患者的中枢神经系统的不同程度的损害,因而常伴有偏瘫、偏身知觉障碍、失语等局灶性体征[14]。朱勇等[15]的研究也表明意识障碍程度与CVS发生率呈正相关但多元Logistic回归分析表明发病意识非CVS发生的独立危险因素。白细胞在SAH发生之后会出现明显增多,因白细胞计数增加,从而导致发生CVS的危险性增加。Hunt-Hess分级与CVS成正相关,相关程度中等,分级高者更易发生CVS。总之,SAH是最常见的脑血管意外之一,早期并发症以CVS为主,由于CVS常引起局部脑组织缺血或迟发性缺血性脑损害,大面积的CVS可导致脑梗死,成为SAH致死或病残的重要原因,得出其中有指导临床防治的危险因素和保护因素,明确危险因素,尽早指导临床治疗与预防,降低临床的病死率与致残率。
[1] 刘光健,陈俊,王云甫,等. 蛛网膜下腔出血患者脑血管痉挛相关危险因素回顾性研究[J]. 中国神经精神疾病杂志,2010,9(2):554-556
[2] 张良文,朱树干蛛网.膜下腔出血所致脑血管痉挛的发生机制.国外医学脑血管疾病分析,2011,9(6):356
[3] 王维治. 神经病学[M]. 5版. 北京:人民卫生出版社,2005:152
[4] 宋锦宁,刘守勋,王拓,等. 动脉瘤性蛛网膜下腔出血致延迟性缺血性神经功能障碍的临床特点及早期诊治[J]. 中国现代医学杂志,2008,18(17):2510
[5] 周少华,张琼. 尼莫地平防治蛛网膜下腔出血后脑血管痉挛的疗效观察[J]. 临床神经病学杂志,2006,19(2):89-90
[6] 廖锋,王穗暖,宣井冈,等. 动脉瘤性蛛网膜下腔出血后脑血管痉挛的治疗和临床分析[J]. 临床神经外科杂志,2009,5(1):32
[7] 徐小林,史重华,费克平,等. 原发性蛛网膜下腔出血5例误诊分析[J]. 人民军医,1999,12(2):10-12
[8] 张晓冬,吴海涛,孙晓川,等. 夹闭和栓塞治疗颅内动脉瘤对蛛网膜下腔出血脑血管痉挛的影响[J]. 第三军医大学学报,2010,19(3):2071-2074
[9] 贺维亚,赵雪艳,王朝辉,等. 蛛网膜下腔出血继发迟发性脑梗死临床相关因素分析[J]. 郑州大学学报:医学版,2003,38(5):784
[10] 朱剑勇. 蛛网膜下腔出血后脑血管痉挛的诊断和治疗[J]. 中国全科医学,2009,12(8):1510-1504
[11] 朱海清,邓国宝,马君武. 原发性蛛网膜下腔出血28例误诊分析[J]. 河南实用神经疾病杂志,2003,14(1):25-26
[12] 冯志清,叶浩祥. 头颅CT血管造影(CTA)在原发性蛛网膜下腔出血病因诊断中的价值[J]. 中国实用医药,2014,8(5):131-132
[13] 符国展. 脑脊液置换治疗原发性蛛网膜下腔出血30例疗效观察[J]. 黑龙江医学,2014,5(6):510-511
[14] 姚丽英,邢江,罗艳春,等. CT与腰穿在诊断原发性蛛网膜下腔出血中的互补作用[J]. 中国民康医学,2014,4(7):74-75
[15] 朱勇,孟祥伟,余跃,等. 创伤性蛛网膜下腔出血后脑积水发生的危险因素分析[J]. 河北医学,2014,20(4):139-141
10.3969/j.issn.1008-8849.2015.06.029
R743.35
B
1008-8849(2015)06-0646-03
2013-05-10

