直肠癌同步放化疗骨髓抑制相关因素分析
肖立国,袁晓丰
(河北省丰宁满族自治县医院,河北 丰宁 068350)
直肠癌同步放化疗骨髓抑制相关因素分析
肖立国,袁晓丰
(河北省丰宁满族自治县医院,河北 丰宁 068350)
目的 探讨直肠癌同步放化疗患者在治疗过程中出现骨髓抑制的相关因素。方法 对99例直肠癌患者年龄、肿瘤分期、同步放化疗方案、同步放化疗持续时间、是否合并内科疾病与骨髓抑制的发生情况进行相关性分析。结果 骨髓抑制的发生与患者的年龄、肿瘤分期、是否合并内科疾病无显著相关性(P均>0.05);与同步放化疗方案、同步放化疗持续时间显著相关(P均<0.05)。结论 同步放化疗方案、同步放化疗持续时间是直肠癌患者同步放化疗期间骨髓抑制的相关因素。为减轻同步放化疗患者治疗过程中的骨髓抑制,选择高效低毒的化疗方案与合适的放疗行联合治疗,从而提高患者的生存质量,是同步放化疗的理想选择。
直肠癌;同步放化疗;骨髓抑制
直肠癌是世界上仅次于肺癌和乳腺癌的第3大常见肿瘤,在发达国家与地区处于较高水平。20世纪70年代以来,直肠癌发病率及病死率呈逐步上升趋势,成为危害我国居民健康的主要恶性肿瘤之一。直肠癌局部/区域复发是直肠癌治疗失败的主要原因,同步放化疗可以提高局部控制率和长期生存期。卫生部发布的结直肠癌诊疗规范(2011年版)将同步放化疗作为局部晚期直肠癌的标准治疗模式进行推荐。本研究通过回顾性总结同步放化疗的直肠癌患者在治疗过程中的骨髓抑制情况,并与患者的年龄、肿瘤分期、是否合并内科疾病、同步放化疗方案及同步放化疗持续时间相关性进行分析,旨在为减轻或预防患者在同步放化疗中出现骨髓抑制提供理论依据。
1 临床资料
1.1一般资料 收集我院2009—2012年病例资料完整并接受同步放化疗的99例直肠癌患者资料。均经病理学检查明确诊断。患者行同步放化疗前KSP评分>60分,无放化疗禁忌,以往未接受过放疗及静脉化疗。99例患者年龄45~84岁,其中<65岁43例,≥65岁56例。TNM分期Ⅰ期1例,Ⅱa期2例,Ⅱb期40例,Ⅲa期2例,Ⅲb期54例。其中未接受手术11例,术前同步放化疗37例,术后同步放化疗51例。合并内科疾患47例,其中高血压25例,糖尿病12例,冠心病10例。
1.2治疗方法
1.2.1放射治疗 放射治疗采用BJ-6B 6 MV X直线加速器外放射治疗 。其中42例行盆腔四野三维适形CT模拟定位,剂量200 cGy,27次,每周5次。57例行盆腔四野三维适形CT模拟定位,剂量180 cGy,30次,每周5次。11例未接受手术者病灶局部加量1 000 cGy。
1.2.2同步化疗 99例患者均完成同步放化疗。化疗2个疗程者11例,完成4个疗程者58例,完成6个疗程者30例。化疗方案:5-Fu 1 000 mg/m2第1—5天,连续静脉滴注,放疗开始第1周和第5周,共36例。卡培他滨1 650 mg/m2,2次/d,从第1天开始,每周5次,直到放疗结束,共20例;或从放疗第1天开始,连服2周后休息1周,共18例。奥沙利铂130 mg/m2+5-Fu 200~225 mg/m2+CF 20 mg/m2第1—5天,连续静脉滴注,放疗开始第1周和第5周,共25例。放化疗期间每周复查血常规,必要时给予生白治疗及对症处理。
1.3观察项目 根据肿瘤治疗毒性的评分标准(2000年)对治疗期间骨髓抑制进行分级。0级:白细胞≥4.0×109L-1,血红蛋白≥110 g/L,血小板≥100×109L-1;Ⅰ级:白细胞(3.0~3.9)×109L-1,血红蛋白95~100 g/L,血小板(75~99)×109L-1;Ⅱ级:白细胞(2.0~2.9)×109L-1,血红蛋白80~94 g/L,血小板(50~74)×109L-1;Ⅲ级:白细胞(1.0~1.9)×109L-1,血红蛋白65~79 g/L,血小板(25~49)×109L-1;Ⅳ级:白细胞(0~1.0)×109L-1,血红蛋白<65 g/L,血小板<25×109L-1。
1.4统计学方法 应用SPSS 16.0软件进行数据处理,计数资料比较采用2检验,检验水准α=0.05。
2 结 果
2.1不同年龄患者骨髓抑制情况 不同年龄患者骨髓抑制情况比较差异无统计学意义(P均>0.05)。见表1。

表1 不同年龄患者骨髓抑制情况 例(%)
2.2不同并发症情况患者骨髓抑制情况 不同合并症情况患者骨髓抑制情况差异无统计学意义(P均>0.05)。见表2。
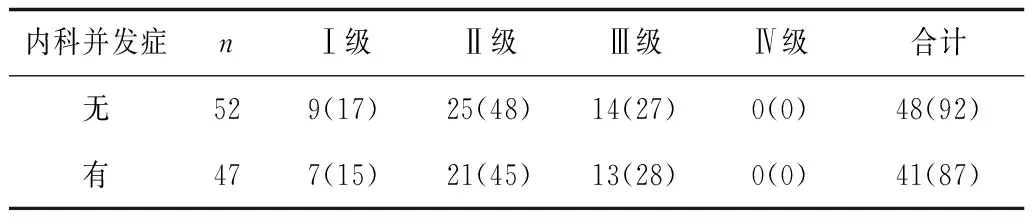
表2 不同内科并发症患者骨髓抑制发生情况 例(%)
2.3不同肿瘤临床分期患者骨髓抑制情况 不同肿瘤分期患者骨髓抑制发生情况比较差异无统计学意义(P均>0.05)。见表3。
2.4不同化疗疗程患者骨髓抑制情况 不同化疗疗程患者骨髓抑制发生情况比较差异无统计学意义(P均>0.05)。见表4。
2.5不同化疗方案患者骨髓抑制发生情况 不同化疗方案患者骨髓抑制发生情况比较差异有统计学意义(P均<0.05)。见表5。
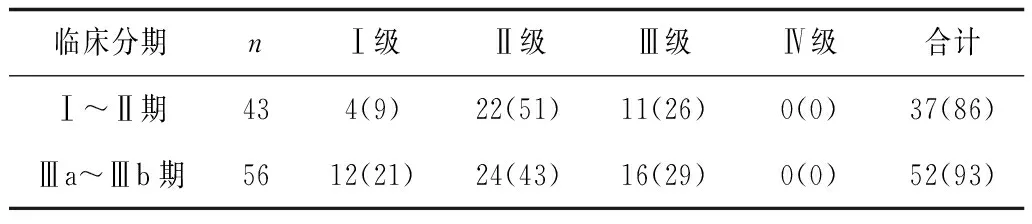
表3 不同肿瘤分期患者骨髓抑制情况 例(%)
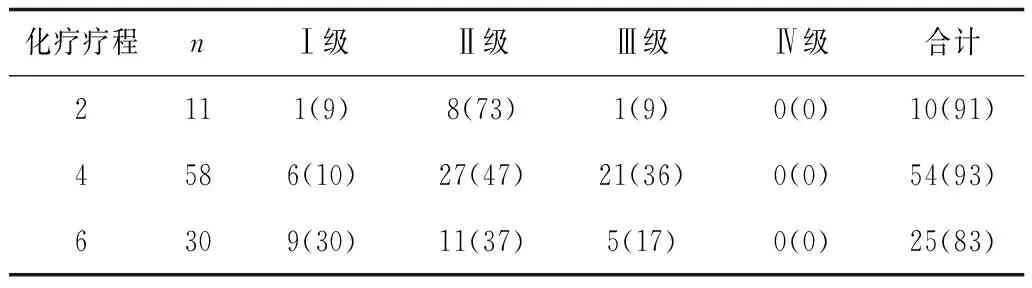
表4 不同化疗疗程患者骨髓抑制情况 例(%)
2.6不同放化疗持续时间患者骨髓抑制情况 不同放化疗持续时间患者骨髓抑制情况比较有统计学意义(P<0.05)。见表6。
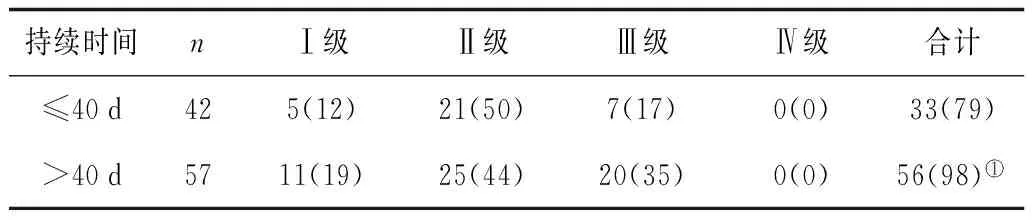
表6 不同放化疗持续时间患者骨髓抑制情况 例(%)
注:①与≤40 d比较,P<0.05。
3 讨 论
放疗和化疗同步进行即同步放化疗,又称同期放化疗,可以降低局部复发率及远地转移率,明显改善患者生存期。术前同步放化疗已成为Ⅱ~Ⅲ期可手术切除直肠癌的标准治疗原则。术前同步放化疗与术前放疗相比较,降低了局部区域复发率,提高了病理完全缓解率。术前同步放化疗与术后同步放化疗比较,进一步降低了局部区域复发率,且毒副反应更少。对于局部晚期不能手术切除直肠癌,术前同步放化疗是唯一的标准治疗模式,大部分患者在接受同步放化疗后可行根治性切除。其理论基础[2]包括:①空间协作:放射治疗控制原发病灶。化学治疗控制远地转移灶。②增敏作用:化疗药物增加放射治疗的敏感性可能的机制包括增加初始的放射损伤、抑制细胞损伤的修复、细胞周期的在分布、乏氧相关放射抗拒性的逆转及抑制肿瘤细胞的再分布。③对NDA损伤修复的影响。射线对细胞的杀伤表现为DNA的单链或双链的断裂,放射损伤的修复形式是亚致死性损伤修复和潜在致死性损伤修复。化疗药物通过抑制细胞对放射损伤的修复,从而增强射线对细胞的杀伤。④细胞动力学的协同作用。不同细胞周期的不同时相对放射线的敏感性不同,G2和/或M期细胞对放射线敏感,而不同药物对细胞周期有阻断作用。将细胞周期选择性的阻断在G2和/或M期,就会增加放射治疗的敏感性。
目前有关直肠癌同步放化疗的研究众多,而对同步放化疗的毒副反应研究有限。同步放化疗与单纯手术及化疗相比,毒副反应有所增加。故同步放化疗过程中对于毒副反应的处理显得尤为重要,以保障患者在治疗中的顺应性。放化疗的毒副反应,尤其是骨髓抑制[3]、放射性直肠炎及放射性膀胱炎,会影响患者的生存质量,以至于影响患者最终的生存获益。其中,由于放化疗的叠加作用,骨髓抑制出现的概率明显增加,严重者骨髓抑制属危重症范畴,患者免疫功能处于抑制状态,极易合并感染,严重者危及生命。应根据患者骨髓抑制的程度尽早使用集落细胞刺激因子,可预防性使用抗生素。有条件的患者应入住单人病室及百级层流病房,避免交叉感染。此外,中医药对骨髓抑制有一定的治疗作用。治疗骨髓抑制的传统方剂,多为补气、养血及滋阴类方药。如四君子汤、八珍汤、十全大补汤等[4],对骨髓抑制有一定的疗效。程丽坤等[5]用六君子汤加枸杞子、女贞子等治疗宫颈癌化疗后骨髓抑制疗效显著,表明六君子汤能升高白细胞和血小板。此外,运用的自拟方还有化疗扶正汤[6]、骨癌通泰方[7]、蓝藤益髓汤[8]等,对减轻骨髓抑制都显示了一定疗效。但也存在一些问题,如缺乏统一的疗效评定标准,对一些疗法的作用机制研究不够全面与透彻,缺乏对远期疗效的随访。Psyrri等[9]报道,鼻咽癌的同步放化疗在提高肿瘤的局控率和总生存期的同时,也显著增加了毒副反应,其急性毒副反应显著高于单纯放疗。
本研究发现,直肠癌的同步放化疗的骨髓抑制发生率为90%(89/99),其中重度骨髓抑制的发生率为27%(27/99)。骨髓抑制的发生与患者的年龄、合并内科疾病、肿瘤的临床分期、化疗疗程无相关性;与不同化疗方案、同步放化疗持续时间相关。因此,不同化疗方案、同步放化疗持续时间是直肠癌同步放化疗患者发生骨髓抑制的高危因素。为减轻同步放化疗患者治疗过程中的骨髓抑制,选择高效低毒的化疗方案与合适的放疗行联合治疗,可提高患者的生存质量,是同步放化疗的理想选择。目前同步放化疗时放疗剂量多为50.4 Gy/28次(2011 STAP-01)[10],50.4~55.8 Gy/25次(2011 NSABP R04)[11],45~50 Gy/25次(2010 ACCORD)[12], 50.4 Gy/28次(2012 CAO/ARO-04)[13]。化疗药物如奥沙利铂的应用,提高了转移性结直肠癌一线化疗或术后辅助化疗的疗效。而口服卡培他滨和静脉滴注5-Fu的疗效相同,口服卡培他滨更为方便。此外,分子靶向药物联合放疗和化疗用于直肠癌的辅助治疗也处于临床研究阶段。目前国内尚无短程大剂量分割放疗与化疗联合用于直肠癌同步放化疗的报道,可能亦是一种将来的研究方向。
本文仅对直肠癌同步放化疗期间的骨髓抑制情况做了小样本的回顾分析,尚需大样本资料进一步证明其可靠性。同时,在发挥中医药治疗优势的基础上,完善相关疗效评价体系,加强对其作用机制的研究,为中医药治疗放化疗的骨髓抑制提供科学依据。
[1] 李晔雄,金晶. 直肠癌术前同步放化疗[C]. 第三届中国肿瘤内科大会教育集暨论文集,2009:240-244
[2] 徐向英,曲亚琴. 肿瘤放射治疗学[M]. 2版. 北京:人民卫生出版社,2010:116-117
[3] 李莉,陈世梅,易珑,等. 恶性肿瘤患者放化疗后发生重度骨髓抑制的临床护理对策[J]. 肿瘤预防与治疗,2010,23(5):424-426
[4] 蒋立峰,刘延庆. 中医药治疗化疗致骨髓抑制的研究评述[J]. 中医学报,2011,26(5):526-527
[5] 程丽坤,艾志宏,刘海涛. 六君子汤防治宫颈癌化疗所致骨髓抑制、胃肠道反应的临床观察[C]. 第九届全国中西医结合肿瘤学术研讨会论文集,248:249
[6] 薛育新,杨建平. 化疗扶正汤治疗化疗所致骨髓抑制96例临床观察[J]. 光明中医,2008,23(4):487-488
[7] 黄永明,许少健,石字雄,等. 骨癌通泰方治疗骨肿瘤化疗骨髓抑制32例临床观察[J]. 新医学,2008,40(9):32-33
[8] 孙长岗,张利华. 蓝藤益髓汤对化疗后骨髓抑制的影响[J]. 山东中医杂志,2008,27(20):86-87
[9] Psyrri A,Kwong M,Distasio S,et al. Cisplatin,fluorouracil,and leucovorin induction chemotherrapy followed by concurrent cis-platin chemoradiotherapy for organ preservation and cure in pa-tients with advanced head and neek cancer :long-term follow-up[J]. J Clin Onlol,2009,22(15):3061
[10] Aschele C,Cionini L,Lonard I,et al. Primary tumor resoonse to preoperative chemoradiation with or without oxaliplation in Locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase Ⅲ trial[J]. J Clin Oncol,2011,29(20):2773-2780
[11] Roh MS,Yothers GA,O’Connell MJ,et al. The inpact of capecitabine and oxaliplation in the preoperative multimodality treatment in patients with carcinoma of the rectum:NSABP R-04[J]. J Clin Oncol,2011,29(Suppl):3503
[12] Gerard JP,Azria D,Gourgou-Bourgade S,et al. Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer:results of thephase Ⅲ trial ACCORD 12/0405-Prodjge 2[J]. J Clin Oncol,2010,28(10):1638-1644
[13] Rodel C,Liersch T,Becker H,et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluoroavacil and oxaliplatin versus fluorouracic alone in cocally advanced rectal cancer:initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial[J]. Lancet Oncol,2012,13(7):679-687
10.3969/j.issn.1008-8849.2015.06.021
R735.37
B
1008-8849(2015)06-0628-03
2014-06-05

