阿奇霉素与罗红霉素对香烟烟雾提取物诱导A549细胞IL-8,IL-10和TGF-β1的影响
姚晶晶,多力坤
(新疆医科大学第一附属医院,新疆 乌鲁木齐 830000)
阿奇霉素与罗红霉素对香烟烟雾提取物诱导A549细胞IL-8,IL-10和TGF-β1的影响
姚晶晶,多力坤
(新疆医科大学第一附属医院,新疆 乌鲁木齐 830000)

目的 探究阿奇霉素与罗红霉素对香烟烟雾提取物(CSE)诱导A549细胞白细胞介素(IL)-8,IL-10和转化生长因子-β1(TGF-β1)的影响。方法 实验分为空白对照组(无血清的DMEM)、CSE组(浓度10%CSE)、10%CSE+阿奇霉素组(0.1 mg/mL阿奇霉素预处理2 h后加入浓度10%CSE)、10%CSE+罗红霉素组(0.1 mg/mL罗红霉素预处理2 h后加入浓度10%CSE),将培养好A549细胞分别滴入上述培养皿,应用倒置显微镜观察不同时间段细胞形态变化,酶联免疫法(ELISA)检测各组IL-8,IL-10和TGF-β1水平。结果CSE组IL-8及TGF-β1水平在9 h前呈增长趋势,IL-10在3 h后逐渐降低。10%CSE+阿奇霉素组和10%CSE+罗红霉素组IL-8及TGF-β1在3 h后均降低,且10%CSE+阿奇霉素组降低更明显;在3 h后2组 IL-10水平均逐渐增高,但2组比较差异无统计学意义。空白对照组IL-8、IL-10及TGF-β1水平变化不明显。结论 从抑制炎症递质失控性释放的角度出发,推断治疗慢性肺部炎性疾病时,阿奇霉素较罗红霉素效果显著。
阿奇霉素;罗红霉素;香烟烟雾提取物;白细胞介素-8;白细胞介素-10;转化生长因子-β1
支气管哮喘(简称哮喘)是常见的慢性呼吸道疾病,近年来其患病率在全球范围内有逐年增加的趋势。临床研究和实践结果表明,规范化的诊断和治疗,特别是实施有效的管理对提高哮喘的控制水平,改善患者生命质量具有十分重要的作用[1]。本研究拟用香烟烟雾提取物(CSE)诱发哮喘模型,观察阿奇霉素、罗红霉素对体外培养的肺泡Ⅱ型上皮细胞A549分泌白细胞介素(IL)-8,IL-10和转化生长因子-β1(TGF-β1)的影响,旨在为阿奇霉素及罗红霉素在哮喘防治中的作用提供初步的实验依据。
1 实验资料
1.1材料 肺泡Ⅱ型上皮细胞A549由中国科学院上海细胞生物研究所细胞库提供。
1.2实验用试剂与仪器 仪器设备:CO2培养箱(Heal ForceHF240,香港),低速离心机(KDC-40),超净工作台(ZHJH-C11098),赛多利斯电子天平(BS2245),液氮生物容器(四川亚西牌),移液枪(全套),-20 ℃低温冰柜(青岛海尔),4 ℃冰箱(青岛海尔),电热恒温干燥箱(DHG-9071A型),超纯水仪(美国MilliQ公司),三用恒温水浴箱(DK-600S,上海精宏实验设备有限公司),系统提示显微镜,注射器,针头。实验用品:96孔培养皿(corning),3.5 cm培养皿(corning),6 cm培养皿(corning),10 cm培养皿(corning),5 mL移液管(FALCON),10 mL移液管(FALCON),15 mL塑料离心管(corning),30 mL塑料离心管(corning),50 mL塑料离心管(corning),2 mL冷冻管(corning),0.22 μm混合纤维素脂微孔滤膜(上海兴亚净化材料厂),血球计数板,直头玻璃吸管,烧杯,量杯,酒精灯,铝制饭盒,贮槽,弯盘,10 mL玻璃皿,封口膜(parafilm)。主要试剂及药品:兔抗人p65多克隆抗体,类胎牛血清(杭州四季青生物材料研究所),DMEM培养基(美国GIBCO公司),PBS磷酸盐缓冲液(北京中山生物技术有限公司),胰蛋白酶(Gibco),IL-10检测试剂盒(Shanghai Joyee Biosource 公司,上海巧伊生物科技有限公司),IL-8检测试剂盒(Shanghai Joyee Biosource公司,上海巧伊生物科技有限公司),TGF-β1检测试剂盒(Shanghai Joyee Biosource公司,上海巧伊生物科技有限公司),红河香烟(云南红河卷烟厂),阿奇霉素(沈阳第一制药厂,批号:141019),罗红霉素(湖南科伦制药有限公司,批号:1208293B)。
1.3方法
1.3.1CSE的制备 将一根香烟用25 mL无血清的DMEM培养液制成悬液,密封瓶内,摇动使其充分溶解,调pH至7.3,过滤除菌,配置成含10% CSE,于1 h内用于实验。
1.3.2分组 培养皿注药分为空白对照组(无血清的DMEM)、CSE组(浓度10%CSE)、10%CSE+阿奇霉素组(0.1 mg/mL阿奇霉素预处理2 h后加入浓度10%CSE)、10%CSE+罗红霉素组(0.1 mg/mL罗红霉素预处理2 h后加入浓度10%CSE)。
1.3.3细胞分离及培养 首先将含有肺泡Ⅱ型上皮细胞A549的冻存管从液氮中小心取出,立即轻轻投入预先准备好的37 ℃温水中,远离面部。轻轻顺时针摇动使冷冻管内容物尽快融化,直到冻存管中剩少许冰晶,将冻存管从37 ℃水浴中取出,用乙醇擦拭消毒冻存管,置于离心机,2 000 r/min离心5 min,紫外线提前20~30 min打开,于超净工作台内开启,去除上清液,用1 mL吸管吸出冷冻细胞,轻轻滴入10 cm培养皿中,均匀滴入10 mL培养液(细胞培养液为含有10%加热灭活胎牛血清、100 IU/mL青霉素、100 μL/mL链霉素的DMEM)。显微镜下观察各浓度下细胞生长状况(数量、形态、透亮度、贴壁情况);用乙醇棉对培养瓶外部进行擦拭。将培养基倒掉,加PBS磷酸盐缓冲液冲洗一下,如不需传代,加入5 mL新鲜培养基即可;传代:加1 mL PBS磷酸盐缓冲液反复冲洗一下(快速),加入1 mL左右胰蛋白酶,37 ℃ 1 min,轻敲瓶壁使大部分细胞脱落,倒置显微镜观察,细胞脱落,加入3 mL培养基(DMEM)终止消化;用吸管反复轻柔吹打,尽量让细胞均匀分散开来,置入离心管中 ,2 000 r/min离心5 min,离心后,去上清液,加入3n(n为传代瓶数)mL培养基(DMEM),各取出3 mL至新瓶中;放入CO2培养箱(培养条件5% CO2、饱和湿度、37 ℃)。
1.3.4指标检测 将培养细胞分别滴入分好组的培养皿中,应用倒置显微镜于0 h、3 h、6 h、9 h、12 h观察各组的细胞形态变化,收集细胞上清液,采用酶联免疫法(ELISA)检测IL-8,IL-10和TGF-β1的变化。按照试剂盒说明进行步骤。
1.4统计学方法 采用SPSS 13.0软件进行数据统计,计量资料采用均数±标准差表示,P<0.05为差异有统计学意义。
2 结 果
2.1各组肺泡Ⅱ型上皮细胞A549形态比较 9 h时倒置显微镜下观察:空白对照组细胞形态呈椭圆形或梭形, 细胞轮廓清楚,细胞间结构紧密,见图1;10%CSE组细胞边缘不规则,胞体和胞核结构不清,有伪足伸出,胞浆内有颗粒状物质,细胞间接触变松,见图2; 10%CSE+阿奇霉素组细胞轮廓较CSE组清楚,与空白对照组变化不明显,见图3;10%CSE+罗红霉素组细胞轮廓、胞体和胞核结构介于空白对照组和CSE组细胞之间,见图4。
2.2不同时间段IL-8水平比较 10%CSE组IL-8水平在9 h前呈增长趋势;10%CSE+阿奇霉素组和10%CSE+罗红霉素组IL-8水平在3 h后降低,10%CSE+阿奇霉素组较10%CSE+罗红霉素组降低更明显;空白对照组各时间段IL-8水平比较差异无统计学意义。见表1。

图1 空白对照组细胞形态(DAB×400)
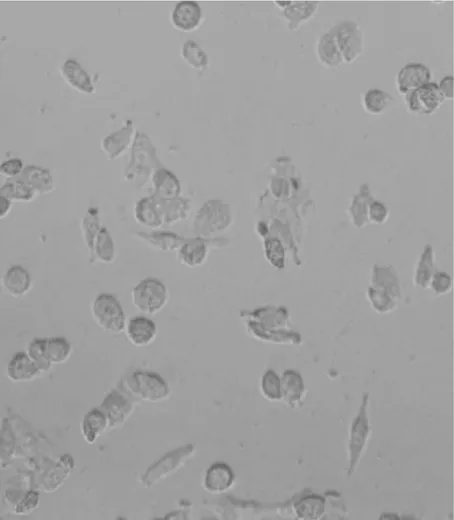
图2 10%CSE组细胞形态(DAB×400)
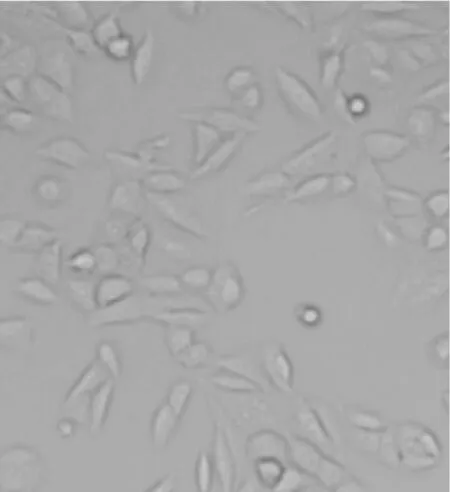
图3 10%CSE+阿奇霉素组细胞形态(DAB×400)
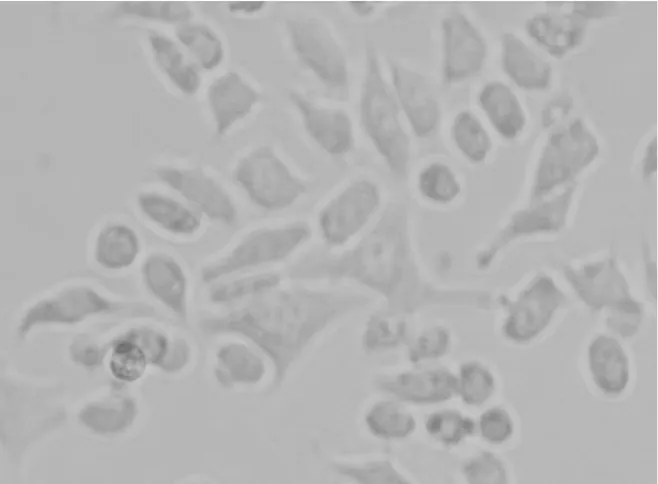
图4 10%CSE+罗红霉素组细胞形态(DAB×400)
表1 各组上清液IL-8水平比较
2.3不同时间段IL-10水平比较 10%CSE组IL-10水平在3 h后逐渐降低;10%CSE+阿奇霉素组和10%CSE+罗红霉素组IL-10水平在3 h后逐渐增加,2组比较差异无统计学意义;空白对照组各时间段IL-10水平比较差异无统计学意义。见表2。
2.4不同时间段TGF-β1水平比较 10%CSE组TGF-β1水平在9 h前呈增长趋势;10%CSE+阿奇霉素组和10%CSE+罗红霉素组TGF-β1水平在3 h后降低,且10%CSE+阿奇霉素组较10%CSE+罗红霉素组降低更明显;空白对照组各时间段TGF-β1水平比较差异无统计学意义。见表3。
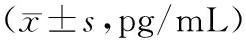
表2 各组上清液IL-10水平比较
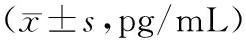
表3 各组上清液TGF-β1水平比较
3 讨 论
哮喘是由嗜酸性粒细胞、肥大细胞和T淋巴细胞等多种炎性细胞参与的气道慢性炎症,这种气道炎症使易感者对于各种激发因子具有气道反应性,并引起气道缩窄,表现为反复发作性的喘息、呼吸困难、胸闷或咳嗽等症状[2],常在夜间和/或清晨发作、加剧。目前哮喘已成为全球关注的公共卫生问题,影响不同年龄组的人群,尤其是儿童哮喘已成为儿童最常见的慢性呼吸道疾病[3],严重影响儿童的身体健康和生长发育。
哮喘的发病与多种递质有关,如血小板活化因子(PAF)、前列腺素、血栓素、白三烯、组胺、腺苷等,其中PAF对嗜酸性细胞有强烈的趋化作用,从而引起呼吸道嗜酸性粒细胞的浸润活化,相继引起气道上皮损伤[4-5]。目前研究认为,哮喘的炎症反应主要是由于Th1/Th2失衡,抗原刺激使Th0向Th1或Th2的分化所致。Th1主要合成释放IL-2和IFN-γ,促进细胞免疫,调节免疫抗感染的功能,Th2则主要生成IL-4,IL-5,IL-10,IL-13等[6-7]。一般认为IFN-γ和IL-4,IL-5分别为Th1和Th2特征性细胞因子,IFN-γ可以促进Th0向Th1分化,促进嗜酸性细胞凋亡;而IL-4则促进Th0向Th2分化,诱发哮喘症状加重。
IL-8又称嗜中性粒细胞因子,是炎症性疾病的重要递质,在抗感染、免疫反应调节以及抗肿瘤方面有重要作用[8]。IL-8对特异性和非特异性的免疫细胞具有强烈的趋化作用,其中主要是对嗜中性粒细胞的趋化和激活作用,对淋巴细胞和嗜碱性粒细胞也有趋化作用[9]。作为一种主要的炎症因子,IL-8水平在感染及某些自身免疫性疾病的情况下在炎症局部、血清和体液中均有显著增加,如肺纤维化、呼吸窘迫综合征、慢性支气管炎、支气管扩张等。
TGF-β1是一种多功能的细胞因子,是由2条分子量为11 kD有112个氨基酸构成的单链通过二硫键结合而成的分子量为25 kD的多肽[10]。它在细胞的生长、分化、免疫调节、调节细胞外基质合成及损伤后的修复方面发挥着重要的作用[11-12]。其具有抗炎和促炎双重作用,还有独特的促纤维化作用,参与哮喘气道炎症、免疫应答[13]及气道重塑,与哮喘的关系十分密切。TGF-β1对间充质起源的细胞起刺激作用,而对上皮或神经外胚层来源的细胞起抑制作用[14]。支气管哮喘是以气道高反应性和不可逆性气道重塑为特点的气道慢性炎症性疾病,而气道重塑一旦形成很难逆转,因此哮喘非常难治[15]。
本研究结果显示,CSE可导致肺泡Ⅱ型上皮细胞的形态结构变化,促使IL-8,TGF-β1分泌,抑制IL-10分泌,因而可以促进炎症反应,导致气道重塑。阿奇霉素和罗红霉素可抑制IL-8及TGF-β1分泌,增加IL-10分泌,从而减轻使肺组织炎症程度,可阻止或减轻气道重塑,且阿奇霉素作用明显优于罗红霉素。提示对于合并气道重塑呼吸道疾病如支气管哮喘、肺纤维化、呼吸窘迫综合征、慢性支气管炎、支气管扩张等的治疗,阿奇霉素疗效比罗红霉素更为显著。
[1] 韦旋,邓静敏. 支气管哮喘发病机制的基因研究进展[J]. 中华结核和呼吸杂志,2012,35(11):849-852
[2] 张琳惠,贾永良,谢强敏,等. 气道上皮在哮喘发生发展中的作用及其机制研究[J]. 世界临床药物,2011,11(4):256-257
[3] 叶英姿. 儿童支气管哮喘诊断治疗进展[J]. 中国保健营养,2014(4):2008
[4] 王茸,张淼,肖春洁,等. 支气管哮喘患儿血清中IL-8、sIL-2R水平变化及其意义[J]. 当代医学,2010,16(9):47
[5] 喻男利,郭艳丽. 细胞因子IL-10,在哮喘发病机制中的作用及其治疗效应[J]. 中国医学前沿杂志:电子版,2012,11(12):347-348
[6] 刘莉,余可斐,穆敬平,等. 地塞米松对哮喘大鼠气道重建、肥大细胞及IL-10的影响[J]. 中华肺部疾病杂志:电子版,2012,5(1):17-23
[7] 邢飞,姜玉新,刘文艳,等. IL-10基因启动子多态性与皖南地区汉族人群支气管哮喘的相关性研究[J]. 中国免疫学杂志,2012,28(7):624-626;630
[8] 王献武,单小林,唐月静,等. 支气管哮喘患儿血清IL-2、IL-8、TNF-α和SOD检测的临床意义[J]. 放射免疫学杂志,2012,25(5):511-513
[9] 汪浩,武晓兰,谭红霞,等. IL-8和Eotaxin在哮喘大鼠中的表达及地塞米松的作用[J]. 安徽医科大学学报,2012,47(3):270-273
[10] 赵荧,李玉梅,安彩霞,等. 与TGF-β1相关的干预哮喘气道重塑的方法研究进展[J]. 甘肃中医,2009,22(6):77-79
[11] 刘永生,周发春. 哮喘患者血清IL-13、TGF-β1、VEGF表达变化及与气道炎症、重塑的关系探讨[J]. 重庆医科大学学报,2012,37(10):880-883
[12] 李宏彬,徐光翠,桂立辉,等. TGF-1和ADAM33基因交互作用与儿童哮喘易感性及严重程度相关性[J]. 中国免疫学杂志,2012,28(7):640-644
[13] Mason RJ. Biology of alveolar type cells[J]. Respirology,2006,11(suppl):S12-S15
[14] Sugahara K,Tokumine J,Teruya K,et al. Alveolar epithelial cells:differentiation and lung injury[J]. Respirology,2006,11(Suppl):S28-S31
[15] 符跃强,许峰,卢仲毅. 氧化应激对肺泡Ⅱ型细胞的损伤作用及JNK信号转导机制[J]. 重庆医科大学学报,2007,32(11):1150-1154
Effects of azithromycin, erythromycin on the activity of IL-8,IL-10 and TGF-β1in A549 cells induced by cigarette smoke extraction
YAO Jingjing, DUO Likun
(The First Affiliated Hospital of Xinjiang Medical University, Urumqi 830000, Xinjiang, China)
Objective It is to study the effect of azithromycin, erythromycin on IL-10, IL-8, TGF - β1 secretion in A549 cells induced by cigarette smoke extraction(CSE). Methods The A549 cells cultivated in vitro were divided into 4 groups: blank control group without serum DMEM, CSE group given 10% CSE, 10% CSE+azithromycin group given 10%CSE in 2 h after preconditioning with 0.1 mg/mL azithromycin, 10% CSE+erythromycin group given 10%CSE in 2 h after preconditioning with 0.1 mg/mL erythromycin, then the cellular morphological changes were observed under inverted microscope, and the levels of IL-8, IL-10 and TGF-β1were determined by ELISA. Results In CSE group the levels of IL-8 and TGF- β1showed a increasing trend within 9 h, while that of IL-10 decreased gradually after 3 h. In 10% CSE+azithromycin group and 10% CSE+erythromycin group, the levels of IL-8 and TGF- β1both decreased and the level of IL-10 increased in 3 hours later, but the decrease was more significantly in CSE+azithromycin group, while the difference in increase was not significant between the two groups. The changes of IL-8, IL-10 and TGF- β1were not significant in blank control group. Conclusion From the perspective of inhibition of sexual release inflammatory mediators, concluded that for the treatment of chronic pulmonary inflammatory diseases, azithromycin erythromycin effect is more remarkable.
azithromycin; erythromycin; cigarette smoke extract; IL-10; IL-8; TGF - β1
姚晶晶,女,硕士研究生,主治医师,研究方向为呼吸系统疾病。
多力坤,E-mail:docdlk@tom.com
10.3969/j.issn.1008-8849.2015.07.008
R-33
A
1008-8849(2015)07-0706-04
2014-10-15

