不同剂量右美托咪定对大鼠全脑缺血再灌注损伤脑保护作用的研究
徐 雪,蔡劲松,戚 翔,张 山,梁 治,闫 静,李 雪
(河北医科大学第二医院,河北 石家庄 050000)
不同剂量右美托咪定对大鼠全脑缺血再灌注损伤脑保护作用的研究
徐 雪,蔡劲松,戚 翔,张 山,梁 治,闫 静,李 雪
(河北医科大学第二医院,河北 石家庄 050000)

目的 观察不同剂量右美托咪定对大鼠全脑缺血再灌注损伤的影响,探讨其神经保护作用及可能机制。方法 将健康雄性SD大鼠40只随机分为假手术组(S组),全脑缺血再灌注对照组(C组),低、中、高剂量右美托咪定组(D1组、D2组、D3组),每组8只。采用四血管阻塞法制备全脑缺血再灌注模型。缺血即刻S组和C组静脉输注生理盐水2 mL/h;D1组、D2组、D3组分别静脉输注右美托咪定0.05,0.5,5 μg/(kg·min),各组均持续输注2 h。于缺血再灌注后24 h用平衡木法和引体实验测定各组大鼠运动功能,干湿质量法测定各组大鼠脑组织含水量,ELISA法检测各组大鼠血清肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)的水平。结果 与S组比较,C组和D1组、D2组、D3组大鼠运动功能均显著下降(P均<0.05),脑水含量显著增加(P均<0.05),血清TNF-α、IL-1β水平显著升高(P均<0.05)。与C组比较,D1组、D2组、D3组血清TNF-α、IL-1β水平均明显下降(P均<0.05);D1组对IL-1β的抑制作用强于D2组和D3组(P均<0.05),D2组和D3组比较差异无统计学意义;D1组、D2组、D3组对TNF-α的抑制作用差异无统计学意义。结论 0.05 μg/(kg·min)右美托咪定对大鼠全脑缺血再灌注损伤有脑保护作用,可显著改善大鼠运动功能,其机制可能与抑制炎性因子有关。5 μg/(kg·min) 右美托咪定未显示出显著的脑保护效应。
全脑缺血再灌注;右美托咪定;运动功能;肿瘤坏死因子α;白细胞介素-1β
脑血管疾病严重威胁着人们的身体健康,其发病率、病死率及致残率有逐年上升的趋势。临床上在神经外科、心脏及大血管、老年和危重病等高风险手术中,围术期均存在潜在的脑缺血危险,因此如何预防围术期间脑血管并发症日益受到关注[1]。右美托咪定(DEX)是一种新型的高选择性高特异性的α2-肾上腺素能受体激动剂,具有剂量依赖性镇静、抗焦虑、镇痛、抑制交感活性及无呼吸抑制等药理性质[2]。美国药品与食品管理局(FDA)于1999年批准,将其应用于成人重症监护病房(ICU)短时间(24 h)的镇静与镇痛,近年来该药逐渐作为辅助镇静药物应用于临床麻醉管理和重症监测治疗中[3-4]。基础研究表明,DEX对脑损伤有显著神经保护作用[5-7],可能与其降低细胞外儿茶酚胺水平、减少兴奋性神经递质谷氨酸及调节细胞凋亡等有关[8]。本实验进一步研究了DEX是否具有剂量依赖性的脑保护作用,旨在为围术期具有发生潜在脑缺血的高危手术患者合理用药提供实验依据。
1 实验资料
1.1实验动物 健康雄性SD大鼠,周龄8~12周,体质量180~320 g,动物合格证号: 2010-0011,由河北医科大学实验动物中心提供。实验前适应环境3 d,室温23 ℃,昼夜交替。
1.2实验动物分组和模型制备 实验大鼠40只,随机分为假手术组(S组),全脑缺血再灌注对照组(C组),低、中、高剂量DEX组(D1组、D2组、D3组),每组8只。采用Pulsinelli等[5]的四血管闭塞法并加以修改建立大鼠全脑缺血模型。大鼠实验前24 h禁食不禁水,腹腔注射10%水合氯醛(350 mg/kg),麻醉成功(翻正反射消失,钳夹尾部无体动反应)后,俯卧位固定在操作台上。于枕骨后第1—2颈椎处做一切口,沿中线分开纵向的肌肉。以第1颈椎棘突为标志,分离暴露第1颈椎双侧翼状孔,直视下用电凝烧灼凝闭双侧椎动脉,造成其永久性关闭。在切口处滴注庆大霉素2滴防止感染,缝合切口,清醒后放回笼中饲养。24 h后同样方法麻醉大鼠,仰卧位固定,暴露股动脉,穿刺置管监测直接动脉压。颈部正中切口,钝性分离颈部肌肉,暴露双侧颈总动脉穿线备用。尾静脉穿刺置管,接微量泵以备输入DEX或生理盐水。采用无创动脉夹夹闭双侧颈总动脉,造成动物全脑缺血,10 min后松开动脉夹,恢复脑血流灌注,在切口处滴注庆大霉素2滴防止感染,缝合,清醒后放回笼中饲养。模型制备成功标志为血流阻断后1 min内瞳孔散大,颜色苍白,对光反射消失,呼吸加快,恢复血流灌注后,瞳孔颜色立即变为鲜红色。S组大鼠仅接受假手术,不凝闭双侧椎动脉,不阻塞双侧颈动脉,不造成全脑缺血,术中予以持续静脉泵注生理盐水2 h,输注速度2 mL/h。C组全脑缺血8 min,在缺血即刻予以持续静脉泵注生理盐水2 h,输注速度2 mL/h。D1组全脑缺血即刻予以DEX首次剂量6 μg/kg 10 min内静脉输注,剩余剂量以0.05 μg/(kg·min)持续静脉泵注2 h,输注速度2 mL/h(DEX用生理盐水稀释)。D2组全脑缺血即刻予以DEX首次剂量(60 μg/kg)10 min内静脉输注,剩余剂量以0.5 μg/(kg·min)持续静脉泵注2 h,输注速度2 mL/h(DEX用生理盐水稀释)。D3组全脑缺血即刻予以DEX首次剂量600 μg/kg 10min内静脉输注,剩余剂量以5 μg/(kg·min)持续静脉泵注2 h,输注速度2 mL/h(DEX用生理盐水稀释)。
1.3检测指标
1.3.1大鼠运动功能测定 各组大鼠在缺血再灌注24 h后,分别采用Combs等[9]的平衡试验和引体试验进行运动功能评估,每项测试进行2次,选最好的一次成绩计分,每项测试间隔2~3 min,以避免疲劳影响。大鼠运动功能评分标准:平衡测试中不能平衡计0分,维持10 s计1分,维持11~20 s计2分,维持21~30 s计3分;引体测试中坚持0~2 s计0分,坚持3~4 s计1分,坚持5 s第三肢不能搭上计2分,坚持5 s可将第三肢搭上计3分。
1.3.2脑水含量测定 各组实验动物在再灌注24 h麻醉后,立即断头取脑,取左侧大脑经电子天平精确称质量后,放入110 ℃恒温干燥箱烘烤24 h至恒重(两次称质量差别<0.2 mg)后,用同一电子天平再精确称干脑组织质量,并按照eliot干湿质量法计算脑组织含水量,以百分率表示。脑含水量(%)=(湿质量-干质量)/湿质量×100%。
1.3.3血清白细胞介素1β(IL-1β)和肿瘤坏死因子α(TNF-α)测定 各组大鼠在全脑缺血再灌注24 h后麻醉,经右心室采血3 mL,立即离心,3 000 r/min,15 min,取上清液置于-20 ℃冰箱中保存待测。分别按照相应ELISA检测试剂盒说明书进行测定。试剂盒由上海源叶生物科技有限公司,批号:41588;41721。
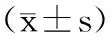
2 结 果
2.1各组大鼠运动功能比较 与S组比较,C组和D1组、D2组、D3组大鼠平衡和引体试验评分均明显下降(P均<0.05);D1组、D2组、D3组平衡试验评分与C组比较差异无统计学意义(P均>0.05),D1组引体试验评分升高(P<0.05),D2组和D3组比较差异无统计学意义(P>0.05)。见表1。
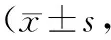
表1 各组大鼠运动功能测定评分分)
注:①与S组比较,P<0.05;②与C组比较,P<0.05。
2.2各组大鼠脑水含量比较S组(77.28±0.30)%,C组(79.56±0.82)%,D1组(78.43±0.41)%,D2组(79.15±0.71)%,D3组(79.71±0.1)%。与S组比较,C组、D1组、D2组、D3组大鼠脑组织含水量均明显升高(P均<0.05);D1组、D2组、D3组脑组织含水量与C组比较差异无统计学意义(P>0.05)。
2.3各组大鼠血清TNF-α、IL-1β水平比较 与S组比较,C组和D1组、D2组、D3组大鼠血清TNF-α、IL-1β水平明显升高(P均<0.05);与C组比较,D1组、D2组、D3组TNF-α、IL-1β水平明显下降(P均<0.05);D1组对IL-1β的抑制作用强于D2组和D3组(P均<0.05),D2组和D3组比较差异无统计学意义(P>0.05);D1组、D2组、D3组对TNF-α的抑制作用差异无统计学意义(P均>0.05)。见表2。
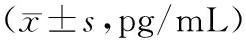
表2 各组血清TNF-α、IL-1β水平比较
注:①与S组比较,P<0.05;②与C组比较,P<0.05;③与D1组比较,P<0.05。
3 讨 论
在临床工作中,当患者发生严重低血压、休克、心搏骤停等情况时,虽然经抢救心肺功能基本恢复,甚至意识也能有不同程度的恢复,但随之有可能会再度出现意识障碍,有的甚至导致心肺功能再次衰竭,最终结果是植物人、或遗留精神及智力障碍、或因多脏器功能衰竭而死亡等,这是由于脑缺血再灌注损伤所致。因此,对脑缺血再灌注损伤的防治对于降低这类患者的伤残率及病死率具有重要的医学和社会意义。
本研究所采用的四血管闭塞法效果确切,可较好地模拟临床上因严重低血压、休克、心肺脑复苏等造成的全脑缺血性损伤过程,且操作相对简单,是公认的研究全脑缺血的适宜模型[10]。
DEX是一种新型的α2-肾上腺素能受体激动剂,对α2受体具有高选择性、高特异性:受体选择性(α2∶α1)为1 620∶1,为可乐定的8倍。其半衰期也较可乐定短,分布半衰期大约为6min,消除半衰期大约为2h,药代动力学方面的可预测性更强。2009年底我国食品药品管理局批准其用于行全身麻醉时的诱导和机械通气时的镇静。本研究进一步研究了DEX脑保护作用是否与用药不同的剂量相关。
全脑缺血可导致不同程度的神经功能缺失,运动功能是检测大鼠神经功能的重要指标。Combs评分系统通过特定的运动功能评分工具及评分标准对大鼠进行统一评分,得出相应数据,通过所得分数的高低客观反映神经功能情况,可避免主观偏倚的发生。本研究结果表明,DEX可一定程度改善全脑缺血大鼠的运动功能,且以低剂量组明显。
脑缺血再灌注损伤是由多种因素参与的复杂病理生理过程,主要包括自由基损伤、兴奋性氨基酸毒性、膜脂质过氧化、炎性反应、钙超载等[11]。炎性反应是机体对抗外界损伤、维持内环境的自我保护机制,然而其又是导致机体组织损伤的重要原因。大量研究已经证实,脑缺血后强烈的炎性反应是造成脑组织继发性损伤的主要因素之一,在此炎性反应过程中,多种因素互相作用,共同引起再灌注损伤[12]。肿瘤坏死因子是目前已知的主要炎性细胞因子之一,可分为TNF-α和TNF-β2种,其中TNF-α是具有广泛生物学特性的多肽类细胞因子,主要由活化的单核-巨噬细胞产生,脑组织中小胶质细胞、星形细胞及神经元亦可分泌,主要参与机体炎性反应及免疫应答。正常情况下,它具有抗感染、抗肿瘤和促进组织修复等作用,对机体有利。若病理状态下持续释放,则会引起组织损伤。TNF-α可通过上调白细胞和血管内皮细胞上的黏附因子(如ICAM-1)的表达,加速炎性细胞进入神经组织,加剧脑内炎性反应;可促进一氧化氮合酶(NOS)表达,产生过量NO,并诱导其他自由基生成,加剧氧化损伤[13];刺激兴奋性氨基酸释放,激活脑缺血后NMDA和非NMDA受体及Ca2+超载损伤的级联反应;还可直接破坏血脑屏障,使其通透性增加,造成血管源性脑水肿,从而引起脑细胞特别是星形胶质细胞肿胀和变性。
IL-1β是目前研究最多的IL-1的亚类,是触发炎症和免疫反应的主要递质,可通过促进白细胞和内皮细胞黏附而激发炎性反应。IL-1β作为一种炎性细胞的强烈趋化因子和免疫源性细胞因子,不仅能协同其他细胞因子促进B、T细胞活化,还能诱导其他炎性递质的产生及黏附分子的表达,进而增加白细胞浸润,促进NOS产生,使NO合成增加,诱导自由基和兴奋性氨基酸生成,启动多种细胞因子级联反应,最终引起神经元损伤。缺血性脑损伤后TNF-α和IL-1β表达明显增高,它们的表达水平可作为衡量脑损伤后继发性炎性反应程度的重要指标[14]。
本实验结果显示,大鼠全脑缺血再灌注后血清中TNF-α、IL-1β水平较假手术组明显升高,经DEX处理后可以显著降低二者水平,且以小剂量组最明显。由此提示,DEX可以通过降低炎性递质的水平,抑制炎性反应对脑缺血再灌注损伤起保护作用。其中0.05μg/(kg·min)DEX对大鼠全脑缺血再灌注损伤有一定保护作用,可明显改善运动功能,其保护机制可能与抑制炎性反应有关,高剂量组未显示处显著的脑保护作用。
[1]HeadBP,PatelP.Anestheticsandbrainprotection[J].CurrOpinAnaesthesiol,2007,20(5):395-399
[2]PenttilaJ,HelminenA,AnttilaM,etal.Cardiovascularandparasympathsticeffectsofdexmedetomidineinhealthysubjects[J].CanadianJPhysiologyandPharmacology,2004,82:359-362
[3] 徐雪,戚翔,梁治,等. 阻塞性睡眠呼吸暂停综合征患者表麻下右美托咪啶或舒芬太尼辅助纤支镜引导气管插管效果的比较[J]. 中华麻醉学杂志,2011,31(12):1426-1429
[4] 朱睿瑶,冯丽芝,张迪,等. 丙泊酚与右美托咪啶用于ICU中颅脑外伤患者镇静效果观察[J]. 现代中西医结合杂志,2014,23(14):1563-1565
[5]PulsinelliW,BrierleyJ.Anewmodelofbilateralhemisphericischemiaintheunanesthetizedrat[J].Stroke,1979,10:267-272
[6] SezerA,MemisD,UstaU,etal.Theeffectofde-xmedetomidineonliverhistopathologyinaratsepsismodel:anexperimentalpilotstudy[J].UlusTravmaAcilCerrahiDerg,2010,16(2):108-112
[7] 张晓青,徐雪. 右美托咪定减轻大鼠全脑缺血再灌注损伤[J]. 基础医学与临床,2013,33(1):117-118
[8] 张晓青,贾建丽,冯明静,等. 右美托咪啶器官保护作用的研究进展[J]. 基础医学与临床,2012,32(7):844-846
[9] Combs D,D’Alecy L. Motor performance in rats exposed to severe global cerebral ischemia:Effect of fasting and 1,3-butanediol[J]. Stroke,1987,18(2):503-511
[10] Diler A,Ziylan Y,Uzum G,et al. Passage of spermidine across the blood-brain barrier in short recirculation periods following global cerebral ischemia: effects of mild hyperthermia[J]. Neurosci Res,2002,43(4):335-342
[11] Taoufik E,Probert L. Ischemic neuronal damage[J]. Curr Pharm Des,2008,14(33):3565-3573
[12] Chen B,Liao W,Xu N,et al. Adiponcctin protects against cerebral ischemia-reperfusion injury through anti-inflammatory action[J]. Brain Res,2009,1273(4):129
[13] Toulmond S,Parnet P,Linthorst A. When cytokines get on your nerve:cytokine networks and CNS pathologies[J]. Trends Neurosci,1996,19(10):409
[14] Hang C,Shi J,Li J,et al. Expressions of intestinal NF-kappaB,TNF-alpha and IL-6 following traumatic brain injury in rats[J]. J Surg Res,2005,123(2):188-193
Study on the cerebral protection effects of different dosage of Dexmedetomidine on global cerebral ischemic-reperfusion injury in rats
XU Xue, CAI Jinsong, QI Xiang, ZHANG Shan, LIANG Zhi, YAN Jing, LI Xue
(The Second Hospital of Hebei Medical University, Shijiazhuang 050000, Heibei,China)
Objective It is to observe the effects of different doses of Dexmedetomidine on global cerebral ischemic-reperfusion injury in rats, and to investigate its neuroprotective effect and possible mechanism. Methods 40 male SD rats were randomly divided into 5 groups(n=8 each): sham operation group(group S),ischemic-reperfusion control group(group C),low,median and high doses of Dexmedetomidine groups(group D1-3). Global cerebral ischemic-reperfusion was induced by four-vessel occlusion.In group D1-3,immediately after ischemic, Dexmedetomidine 0.05,0.5 and 5 μg/(kg·min) were infused over 2 h respectively,while normal saline 2 mL/h were given instead of Dexmedetomidine in group S and C. The motor activity tests(beam-walking test and pull-up test) were carried out 24 h after reperfusion. The brain water content was detected by wet and dry weight method. Then blood samples were taken for measurement of plasma concentration of TNF-α and IL-1β by ELISA. Results Compared with group S,the motor activitives were significantly decreased(P<0.05), brain water content were significantly increased, levels of inflammatory factors TNF-α, IL-1β were all significantly rised in group C and D1-3(P<0.05). Compared with group C, the motor activity was significantly improved in group D1(P<0.05). The levels of inflammatory factors TNF-α, IL-1βwere significantly descented in group D1-3,especially in group D1(P<0.05). Conclusion The low dose of Dexmedetomidine 0.05 μg/(kg·min) shows an neuroprotective effect against ischemic-reperfusion brain injury,the mechanism of protection may be related to inhibiting the injury of free radicals and maintaining the integrity of glial cells.
global cerebral ischemic-reperfusion; Dexmedetomidine; motor activity; TNF-α; IL-1β
徐雪,女,副主任医师,硕士研究生导师,研究方向为围术期器官保护和应激反应。
河北省高层次人才资助项目(B20140051)
10.3969/j.issn.1008-8849.2015.07.002
R-332
A
1008-8849(2015)07-0688-04
2014-09-03

