凯时对急性脑梗死患者血清丙二醛、超氧化物歧化酶、过氧化氢酶水平的影响
颜玮茹,廖春梅
(广西桂林市人民医院,广西 桂林 541002)
凯时对急性脑梗死患者血清丙二醛、超氧化物歧化酶、过氧化氢酶水平的影响
颜玮茹,廖春梅
(广西桂林市人民医院,广西 桂林 541002)

目的 观察前列地尔注射液对急性脑梗死患者血清过氧化氢酶(CAT)、丙二醛(MDA)、超氧化物歧化酶(SOD)的影响,探讨其神经保护作用机制。方法 将120例急性脑梗死患者随机分为实验组和对照组,每组60例,同时选取健康体检者60例作为健康组。实验组给予前列地尔注射液静滴,对照组给予丹参注射液静滴,均1次/d,连用10 d。在治疗前及治疗3,7,14 d测定血清中MDA、SOD和CAT水平,并对患者进行欧洲卒中评分(ESS)及日常生活能力Barthel指数(BI)疗效评定。结果 实验组和对照组治疗前MDA水平高于健康组(P<0.01),SOD、CAT水平低于健康组(P均<0.01)。对照组治疗后MDA水平无明显变化(P>0.05),实验组MDA治疗后明显低于治疗前(P<0.05)。实验组治疗后血清SOD、CAT活力逐渐上升,均明显高于对照组(P均<0.05)。实验组治疗后第7天、第14天ESS和BI评分均优于对照组(P均<0.05)。结论 前列地尔注射液通过降低血清MDA含量,提高CAT和SOD活性,从而改善神经细胞功能。
前列地尔注射液;急性脑梗死;丙二醛;超氧化物歧化酶;过氧化氢酶
脑梗死是神经内科的常见病,患者一般在发病48 h内出现神经功能缺损症状 ,并逐渐加重,其发病率、致残率、复发率和病死率高[1]。脑梗死的发病机制复杂,而其中氧化应激学说越来越受到重视。该学说认为脑梗死在缺血性损伤发生时就有氧化应激存在,而其本质是大量氧自由基在缺血再灌注时期产生,引起神经元细胞凋亡[2],在氧自由基的产生与清除过程中,丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)起着很重要的作用[3-4],它们对卒中发展进程及预后都有着很重要的影响。本研究观察了前列地尔注射液对急性脑梗死患者血清MDA、SOD、CAT水平的影响,旨在探讨脑梗死后脑神经组织的保护方法。
1 临床资料
1.1一般资料 选取2005年1月—2014年6月在桂林市人民医院住院的120例急性脑梗死患者,均符合第四届脑血管病会议修订的诊断标准,均为首次发生脑梗死,脑梗死发生时间≤24 h,并经脑CT或MRI证实,患者家属签署知情同意书。排除脑梗死溶栓者,短暂性脑缺血发作者,合并严重心、肝、肾及血液系统疾病者,严重难治性高血压[收缩压>200 mmHg(1 mmHg=0.133 kPa),舒张压>110 mmHg]者,CT示脑出血或血小板<60×109L-1者,在发病时或近期经临床或实验室证明伴有炎症性或感染性疾病并正应用抗炎药物治疗者。随机分为2组:实验组60例,男30例,女30例;年龄(60.32±8.87)岁。对照组60例,男29例,女31例;年龄(60.01±9.00)岁。另选本院同期健康体检者60例作为健康组,男32例,女28例;年龄(59.91±9.52)岁。3组年龄和性别比较差异无统计学意义(P均>0.05)。
1.2治疗方案 2组均予以常规治疗,如阿司匹林100 mg/d抗血小板聚集,营养神经,脑保护,控制血压及康复治疗等。在此基础上,实验组给予前列地尔注射液(商品名:凯时,北京泰德制药有限公司出产,2 mL:10 μg/支,国药准字H10980024号)20 μg/d加入生理盐水250 mL中静脉滴注,1次/d,应用10 d。对照组给予丹参注射液(10 mL/支,正大青春宝药业有限公司生产,国药准字Z3302001号)20 mL/d加入生理盐水250 mL中静脉滴注,1次/d,连用10 d。
1.3观察指标
1.3.1实验室检查 实验组和对照组于治疗前(发病后12~24 h)及治疗后3,7,14 d分别检测血清MDA、SOD、CAT水平。所有研究对象均在晨醒5 min内抽肘静脉血5 mL,在4 ℃条件下,3 000 r/min离心15 min,收集上层血清3 mL,放置于-40 ℃冰箱低温保存,标本收集完成后由专人一次性检测。血清SOD测定采用黄嘌呤氧化酶法,MDA测定采用硫代巴比妥酸法,CAT测定采用可见光分度法测定,试剂盒均购自南京建成生物工程研究所,严格按照试剂盒说明书进行操作。
1.3.2神经功能缺损评分 实验组和对照组分别在治疗前及治疗后第7,14天采用欧洲卒中评分(ESS)及日常生活能力Barthel 指数(BI)进行评分。
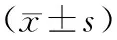
2 结 果
2.13组MDA、SOD、CAT水平比较 对照组和实验组治疗前MDA水平明显高于健康组(P均<0.01),SOD、CAT水平均明显低于健康组(P均<0.01),对照组和实验组间MDA、SOD、CAT水平比较差异无统计学意义(P均>0.05)。治疗后3,7,14 d,对照组MDA与治疗前比较均无明显变化,实验组MDA水平呈逐渐降低趋势,差异有统计学意义(P<0.05)。对照组治疗后3 d SOD、CAT水平无明显变化,治疗后7,14 d均高于治疗前(P均<0.05);实验组治疗后3,7,14 d SOD、CAT水平与治疗前和对照组比较均明显升高(P均<0.05)。见表1。
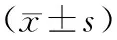
表1 3组MDA、SOD、CAT水平比较
注:①与健康组比较,P<0.01;②与对照组比较,P<0.05;③与组内治疗前比较,P<0.05;④与本组治疗后3 d比较,P<0.05;⑤与本组治疗后7 d比较,P<0.05。
2.2实验组和对照组治疗前后ESS和BI评分比较 治疗前2组ESS和BI评分比较差异无统计学意义(P均>0.05)。治疗后7,14 d,2组ESS和BI评分均明显改善(P<0.01或P<0.05),且实验组改善情况明显优于对照组(P均<0.05)。见表2。
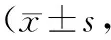
表2 2组治疗前后ESS和BI评分比较分)
注:①与治疗前比较,P<0.01;②与治疗前比较,P<0.05;③与对照组比较,P<0.05。
2.3不良反应 实验组有1例出现注射部位疼痛、发红,经对症处理后好转,无一例发生明显毒副作用。
3 讨 论
急性脑梗死关键问题是脑缺血后引起的神经元损伤,故改善血流和促进神经细胞功能的恢复是其主要治疗目标。而氧自由基尤其是超氧阴离子是脑缺血损伤的主要致病因素,自由基可以破坏脂质、蛋白质和DNA等,所以微血管系统、神经细胞膜和细胞器膜是自由基在脑组织的主要攻击目标[5],故由此推论脑梗死患者可以通过控制氧自由基,而改善病情和预后。
在氧自由基引发下,生物膜不饱和脂肪酸发生过氧化反应产生MDA,MDA的变化可反映氧自由基水平和脂质过氧化反应的强弱,常被作为反映组织过氧化损伤程度的客观指标,并间接反映细胞的损伤程度[6],常与反映机体清除自由基能力的SOD配伍检测[7]。
SOD是体内产生的一种自由基清除酶,通过歧化反应清除超氧阴离子自由基,减轻缺血导致的神经元损伤,在一定程度上其活力体现了内源性氧自由基的清除活力[8]。有研究表明脑缺血后机体中SOD活性明显下降,MDA含量增加,自由基产生增多,且对自由基的清除能力下降,从而损害神经组织[9]。CAT是细胞内活性氧清除系统的重要组成成分,能将H2O分解成无毒的水及分子氧,并保护SOD不被自由基灭活,对维持细胞活性氧代谢起着重要作用[4,10]。当血脑屏障完整性遭到破坏时,CAT能够进入中枢神经系统,从而使中枢神经系统免受活性氧簇诱导损伤,降低脑神经组织氧化损伤[11]。本研究中2组脑梗死患者与正常健康人相比MDA浓度明显升高,SOD和CAT浓度明显降低,这提示在缺氧缺血时,自由基损伤过程启动,这与Aygul等[12]研究一致。
凯时具有靶向性,可靶向扩张颅内痉挛血管,并增加侧支循环,改善梗死区半暗带血流量,从而恢复部分受损神经细胞功能,抑制血小板聚集,并刺激血管内皮细胞产生t-PA,减少自由基的生成,阻止自由基引发的脂质过氧化反应。该药由有机阴离子运输多肽介导通过血脑屏障。本研究结果发现,治疗3 d后,实验组血清MDA水平显著低于对照组,SOD、CAT水平明显高于对照组,而在治疗后7,14 d ESS和BI评分则明显高于对照组,表明凯时可通过降低脑梗死患者的MDA水平及升高SOD、CAT水平,减轻脑缺血引起的损害。
综上所述,脑梗死后患者血清MDA水平升高,SOD和CAT水平降低,且与病情的严重程度有关;凯时可通过降低患者的MDA水平和升高SOD、CAT水平而起到神经保护作用,并在整个治疗过程中未发现明显毒副作用,可成为改善患者预后的新途径。本研究因为样本量较小的原因造成分析结果与一些研究不符,尚待进一步增加样本量进行分析。
[1] 邓丽,刘晓冬,张拥波,等. 急性脑梗死的治疗进展[J]. 中国全科医学,2013,14(8):825-829
[2] Switzer JA,Sikora A,Ergul A,et al. Minocycline prevents IL-6 increase after acute ischemic stroke[J]. Transl Stroke Res,2012,3(3):363-368
[3] Dhar SK,St Clair DK. Manganese superoxide dismutase regulation and cancer[J]. Free Radic Biol Med,2012,52(11/12):2209-2222
[4] Klingelhoeffer C,Kämmerer U,Koospal M,et al. Natural resistance to ascorbic acid induced oxidative stress is mainly mediated by catalase activity in human cancer cells and catalase-silencing sensitizes to oxidative stress[J]. BMC Complement Altern Med,2012,12:61-83
[5] Sulkowski G,Struzynska L,Lenkiewicz A,et al. Changes of cytoskeletal proteins in ischaemic brain under cardiac arrest and reperfusion conditions[J]. Folia Neuropathol,2006,44(2):133-139
[6] Kwiecien S,Konturek PC,Sliwowski Z,et al. Interaction between selective cyclooxygenase inhibitors and capsaicin-sensitive afferent sensory nerves in pathogenesis of stress-induced gastric lesions. Role of oxidative stress[J]. J Physiol Pharmacol,2012,63(2):143-151
[7] Higashi Y. Epdaravone for the treatment of acute cerebral infarction:role of endothelium-derived nitric oxide and oxidative stress[J]. Expert Opin Pharmacother,2009,10(2):323-331
[8] Fukui M,Zhu BT. Mitochondrial superoxide dismutase SOD2,but not cytosolic SOD1,plays acritical role in protection against glutamate-induced oxidase stress and cell death in HT22 neuronalcells[J]. Free Radic Biol Med,2010,48(6):821-830
[9] 郑晓影,赵淑敏,陈萌. 局灶性脑缺血再灌注模型大鼠脑SOD和MDA的变化[J]. 承德医学院学报,2009,26(1):12-14
[10] 简嘉,李平华,等. 过氧化氢酶与甲基强的松龙对实验性脱髓鞘性视神经炎的抑制作用[J]. 重庆医科大学学报,2009,34(12):1685-1688
[11] Sharma SS,Gupta S. Neuroprotective effect of MnTMPyP, a superoxide dismutase/catalase mimetic in global cerebral ischemia is mediated through reduction of oxidative stress and DNA fragmentation[J]. Eur J Pharmacol,2007,561(1/3):72-79
[12] Aygul R,Kotan D,Demirbas F,et al. Plasma oxidants and antioxidants in acute ischaemic stroke[J]. J Int Med Res,2006,34(4):413-418
Effect of Alprostadil injection on serum MDA, SOD and CAT in patients with acute cerebral infarction
YAN Weiru, LIAO Chunmei
(Guilin People’s Hospital, Guilin 541002, Guangxi, China)
Objective It is to observe the effect of Alprostadil injection on serum malondialdehyde(MDA),superoxide dismutase(SOD) and catalase(CAT) in patients with acute cerebral infarction, and discuss the nerve protection mechanism. Methods 120 cases with acute cerebral infarction were randomly divided into experimental group and control group, 60 cases in each group, and 60 cases of healthy persons were selected as healthy group. The experimental group was given Alprostadil intravenous drip infusion and the control group was given Danshen injection by intravenous drip infusion once per day, and both groups were treated for 10 days. The serum levels of MDA, SOD and CAT were measured before treatment and after treatment for 3 days, 7 days and 14 days.Therapeutic efficacy was evaluated by the European Stroke Scale(ESS) and Barthel Index(BI). Results The serum level of MDA in experimental group and control group was higher while the serum level of SOD and CAT were lower than that in healthy group(P<0.01). The serum level of MDA in the control group had no significant difference before and after treatment(P>0.05).The serum level of MDA in the experimental group was significantly much lower than that before treatment(P<0.05). The serum level of SOD and CAT in the experimental group were gradually increased and obviously higher than the serum levels in the control group(P<0.05). ESS and BI of the experimental group at 7 days and 14 days after treatment were obviously higher than the control group(P<0.05). Conclusion Alprostadil injection can protect neurocytes through reducing the serum level of MDA and improving the serum level of SOD and CAT.
Alprostadil injection; acute cerebral infarction; malondialdehyde; superoxide dismutase; catalase
颜玮茹,女,副主任医师,研究方向为神经内科。
廖春梅,E-mail:wjjk1998@sina.com
桂林市科学研究与技术开发计划(20040212)
10.3969/j.issn.1008-8849.2015.07.005
R743.3
A
1008-8849(2015)07-0696-03
2014-10-10

