系统护理结合个体化干预在内镜黏膜下剥离术治疗早期胃癌中的应用
系统护理结合个体化干预在内镜黏膜下剥离术治疗早期胃癌中的应用
高波, 王丽
(南京医科大学附属南京医院 消化内科, 江苏 南京, 210006)
关键词:早期胃癌; 内镜黏膜下剥离术; 系统化护理; 个体化护理
早期胃癌(EGC)是指病变局限于胃壁黏膜或黏膜下层,但对于是否包含淋巴结转移目前尚存在争论[1-2]。近年来,随着内镜技术的创新、发展和人们对癌症预防意识的提高,越来越多的早期消化道癌症被发现并接受内镜下治疗。作为一项微创治疗技术,内镜黏膜下剥离术(ESD)能一次性切除直径>2 cm、形态不规则或合并溃疡瘢痕的癌变组织,并为后续治疗方案提供完整的组织病理学依据[3]。此外,其还可降低传统手术相关风险,但良好的术前术后护理对改善患者预后仍具有积极意义。本研究针对EGC患者开展系统护理结合个体化干预措施,效果满意,现报告如下。
1资料与方法
1.1一般资料
选取2013年6月—2014年12月在南京医科大学附属南京医院经内镜下检查及病理检查确诊的EGC患者68例,所有患者均接受ESD 治疗,其中男39例,女29例;年龄38~79岁,平均(57.2±7.1)岁;病变部位:胃窦部33例,胃底部16例,胃体小弯10例,胃大弯侧9例。入组标准: ① 病变部位局限于黏膜层EGC,癌前病变为炎性息肉或腺瘤; ② EGC分型Ⅰ~Ⅲ型[4],但溃烂不超过黏膜下层,排除淋巴结及脏器转移者。将患者随机分为2组,每组34例。研究组男19例,女15例;年龄38~78岁,平均(57.1±6.9)岁;胃癌分型:Ⅰ型5例,Ⅱa型7例,Ⅱb型10例,Ⅱc型8例,Ⅲ型4例。对照组男20例,女14例;年龄40~79岁,平均(57.2±9.5)岁;胃癌分型:Ⅰ型4例,Ⅱa型6例,Ⅱb型13例,Ⅱc型7例,Ⅲ型4例。2组患者性别、年龄等一般资料比较差异无统计学意义(P>0.05)。具有可比性。
1.2方法
1.2.1手术方法:2组均行常规胃镜检查,进镜后再行靛胭脂或卢戈液染色及NBI放大内镜检查以明确病变部位和范围。于病灶边缘约0.5 cm处,采用APC进行电凝标记,给予黏膜下注射,应用Dual刀沿标记点切开黏膜,并于病灶下方剥离黏膜下层,始终保持剥离层次位于黏膜下层,完整切除病灶。对于创面可见的小血管,采用热活检钳钳夹电凝处理,局部喷洒止血和抗感染药物。
1.2.2护理方法:对照组给予常规护理,包括入院后信息的录入和管理,常规宣教和风险评估、术后严密监测生命体征、积极预防并发症以及出院指导。研究组在对照组基础上开展系统护理结合个体化干预措施。
术前准备和个体化评估: ① 术前准备:术前检查血常规、肝肾功能、心电图等,完善患者临床资料的录入、知情同意书的说明和填写。术前患者禁食6 h以上,对于体质较弱或高龄患者可给予静脉营养支持。口服驱泡剂,常规注射解痉剂以减少术中腺体分泌,减轻平滑肌痉挛。此外,手术室护士完善相关手术器械检查,调式多功能心电监测仪等辅助设备; ② 个体化评估:护理人员结合文献报道或以往经验,从疾病、生理功能和心理认知3个方面对患者进行评估,并制定个体化护理清单,具体包括: 针对性健康宣教和心理护理:加强与患者沟通,开展EGC和ESD相关知识教育和心理辅导,消除患者对EGC和ESD的焦虑情绪; 合并症风险评估和管理:患者因年龄等因素存在多种合并症或长期服药等情况,尤其是高血压,冠心病、糖尿病或凝血功能障碍患者,护士应着重相关指标监测,并指导患者服药[5]。
术中配合:手术护理人员熟知手术流程,链接内镜,调整吸引器、电切压力、测试圈套器、电刀等备用。协助患者取左侧卧位,双腿屈膝,选择部位咬合垫并妥善固定。全麻时患者吸氧(3 L/min)并实时心电监测。医师进镜后,除配合医师要求迅速传递手术器械、注射药液等,切除病变组织时能配合医师完成圈套器的使用,手术护士还应监测患者反应和生命体征变化、及时清除口腔分泌物,保持呼吸道通畅,观察有无腹胀或皮下气肿,必要时调整患者体位。配备好去甲肾上腺素冰盐水,保持注射器内靛胭脂液注满状态,根据创面出血准备止血钛夹。
术后护理和出院指导:患者术毕待清醒后送回病房,病房护士继续检测患者心电监测,观察患者有无呕吐、反流现象。患者绝对卧床休息2~3 d,术中出血较为严重或穿孔者应延长卧床时间,减少活动对手术创面的牵拉。术后常规禁食1~2 d,若无并发症则按流质、半流质、软食顺序过渡,若禁食超过2 d则按医嘱静脉营养支持。做好患者口腔清洁和生活护理,忌刺激性、粗糙过硬的食物,以防胃黏膜损伤出血。观察患者有无腹胀、腹痛、胸骨后疼痛或皮下气肿,胃肠减压引流管液颜色变化,优先给予抑酸、预防出血和胃黏膜保护剂,再根据患者个体情况给予抗菌药物、补液支持。对于出现呕血、黑便患者应立即通知医师行止血治疗。此外,处常规出院宣教外,根据患者受教育程度和经济水平,针对性指导患者改变不良饮食习惯,适当加强锻炼,避免情绪波动过大。术后定期胃镜复查,观察创面愈合情况。
1.3观察指标
入院时及术后12 h, 依据疾病不确定感量表(MUIS)评价疾病相关认知,包括模糊性、复杂性、缺乏信息和不可预测性4个公共因子,共34个条目,总分34~170分,分值越高说明疾病不确定感水平越高。术前、术后12 h和24 h,采用视觉模拟评分法(VAS)对疼痛症状进行评估,采用焦虑自评量表(SAS)评价焦虑状态;护理满意度评价采用自制量表,包含健康指导、护理技术、服务及时有效和医疗设施与环境4个方面,共12个条目,每个条目分为1~4分,分值越高说明患者对护理的满意度越高。
1.4统计学方法
2结果
2.1手术相关情况
所有患者均顺利完成ESD手术,其中术中急性少量出血2例(3.1%),术后上腹痛45例(66.2%)。术后随访,内镜下创面恢复良好,未见病灶残留或局部复发。
2.22组疾病相关认知比较
入院时,研究组MUIS评分为(90.6±7.9)分,对照组为(91.2±7.7)分,2组比较差异无统计学意义(P>0.05); 术后12 h,研究组为(72.3±6.7)分,对照组为(78.4±7.1)分,2组均较入院时明显下降(P<0.01), 且研究组下降幅度大于对照组(P<0.01)。
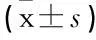
表1 2组VAS和SAS评分比较 分
与术前相比,**P<0.01; 与术后12 h相比,##P<0.01;
与对照组相比, △△P<0.01。
2.32组术后疼痛和焦虑症状比较
术前2组VAS和SAS评分比较差异无统计学意义(P>0.05)。术后12 h,2组VAS和SAS评分较治疗前显著上升,差异有统计学意义(P<0.01),研究组上升幅度小于对照组(P<0.01); 术后24 h, 2组VAS及SAS评分均较术后12 h显著下降(P<0.01),且研究组显著低于对照组(P<0.01)。见表1。
2.42组护理满意度比较
研究组在健康指导、护理技术及总分方面的评分均高于对照组,差异有统计学意义(P<0.01)。见表2。
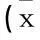
表2 2组护理满意度比较±s)
与对照组相比, **P<0.01。
3讨论
ESD具有一次性完整切除率高,同一患者可以接受多次治疗、创伤小、预后良好等优势,但对医师操作技能和内镜治疗经验要求也相对较高。由于患者对癌症本身的恐惧感和对ESD技术的不确定感,在一定程度上影响了患者的预后和治疗依从性[6-8]。本研究中,2组术后12 h MUIS评分较入院时明显下降,且研究组改善优于对照组,提示系统护理结合个体化干预措施能有效改善患者对于疾病自身以及即将接受治疗措施的不确定感,提高治疗依从性;术后24 h,2组VAS及SAS评分均较术后12 h显著下降,且研究组显著低于对照组,说明系统护理结合个体化干预措施能有效缓解患者疼痛症状,改善焦虑情绪。
ESD主要并发症包括腹痛、出血、穿孔等,其中以出血最常见,发生率约为7%[9-10],迟发性出血常发生在ESD术后24 h,患者以呕血、黑便,甚至休克为主要表现。因此术前评估和术后病情观察以及对出血诱因的预防性控制至关重要。本研究中,个体化干预措施通过术前建立个体化护理清单,术后优化用药流程,预防性给予保护药物,合理饮食顺序,从而降低了患者的出血风险。个体化护理方案依据患者自身状况开展护理,能有效提升护理满意度和治疗依从性[11-12]。本研究结果显示,研究组在健康指导、护理技术及总分方面的评分均高于对照组。
参考文献
[1]Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition[J]. Gastric cancer, 2011, 14(2): 101.
[2]Waddell T, Verheij M, Allum W, et al. Gastric cancer: ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013, 24(suppl 6): 57.
[3]弭希峰, 丁士刚. 内镜下黏膜下层剥离术治疗胃肠道病变进展[J]. 中国微创外科杂志, 2011, 11(9): 849.
[4]Yada T, Yokoi C, Uemura N. The current state of diagnosis and treatment for early gastric cancer[J]. Diagn Ther Endosc, 2013, 2013: 241320.
[5]陈新华, 李姗姗, 于虹, 等. 早期胃癌内镜黏膜下剥离术个体化综合护理模式探讨[J]. 武警医学, 2015, 26(4): 360.
[6]Kim M, Jeon S W, Cho K B, et al. Predictive risk factors of perforation in gastric endoscopic submucosal dissection for early gastric cancer: a large, multicenter study[J]. Surg Endosc, 2013, 27(4): 1372.
[7]Toyokawa T, Inaba T, Omote S, et al. Risk factors for perforation and delayed bleeding associated with endoscopic submucosal dissection for early gastric neoplasms: analysis of 1123 lesions[J]. J Gastroenterol Hepatol, 2012, 27(5): 907.
[8]常云丽. 癌症患者知情程度对治疗依从性的影响[J]. 中国医药导报, 2012, 9(6): 127.
[9]姚礼庆, 钟芸诗, 时强. 早期胃癌行内镜黏膜下剥离术指征及评价[J]. 中国实用外科杂志, 2011, 31(8): 656.
[10]Okada K, Yamamoto Y, Kasuga A, et al. Risk factors for delayed bleeding after endoscopic submucosal dissection for gastric neoplasm[J]. Surg Endosc, 2011, 25(1): 98.
[11]吴建中, 张爱萍, 李静. 全程个体化心理干预对脾切除术患者围术期焦虑抑郁影响的研究[J]. 实用临床医药杂志, 2013, 17(2): 92.
[12]谢玲利. 护理干预对癌症病人化疗依从性及生活质量的影响[J]. 全科护理, 2012, 10(2): 529.
基金项目:中国高校医学期刊临床专项资金(11523184)
收稿日期:2015-03-27
中图分类号:R 473.73
文献标志码:A
文章编号:1672-2353(2015)20-125-03
DOI:10.7619/jcmp.201520042

