超声心动图血流参数预测早产儿动脉导管早期自然关闭的价值*
容 跃,杨正春,冉素真,黄泽君
(1.重庆市妇幼保健院超声科 400013;2.重庆市肿瘤研究所超声科 400030)
动脉导管未闭(patent ductus arteriosus,PDA)是新生儿期最常见的先天性心脏病之一,早产儿PDA发病率尤高。小于30周的早产儿PDA发病率约33.3%,小于28周的早产儿PDA发病率高达60%[1]。具有血流动力学影响的PDA(hemodynamic significant patent ductus arteriosus,hsPDA)易致早产儿发生肺出血、呼吸窘迫综合征、颅内出血、肾功能不全等并发症[2-4],严重地影响早产儿后遗症发生率及存活率[5-6]。研究发现,生后7d以内药物干预效果更佳,且随着早产儿PDA日龄增加,药物的疗效也降低[7-8],因此,早产儿PDA一旦明确,应尽早对其进行药物干预。但早期药物干预也有一定的不良反应和风险。因此,如有指标能预测早产儿PDA早期是否能自然关闭,那么对临床上如何处理早产儿PDA有重要的指导价值。目前,对预测早产儿PDA早期能否自然关闭尚无明确的诊断标准。超声心动图具有无辐射、无创伤性、安全快捷等优点,其二维及彩色多普勒已广泛应用于诊断PDA,但利用其血流参数预测早产儿PDA早期能否自然关闭尚无明确报道。本研究旨在探讨是否可以通过超声心动图频谱多普勒测量PDA相关血流参数,评估早产儿出生后7d内动脉导管是否能自然关闭。
1 资料与方法
1.1 一般资料 将2013年10月至2014年12月在重庆市妇幼保健院新生儿科住院的早产儿(孕周小于37周),生后24h内对其进行首次超声检查存在PDA的早产儿纳入研究对象,除外合并其他先天性心脏病者(不包括卵圆孔未闭、瓣膜生理性反流外)、7d内因临床治疗需要服用药物或手术关闭的PDA早产儿及7d内死亡者,共计130例。分为PDA组(出生后7d内动脉导管仍开放者)及对照组(7d内动脉导管自然关闭者)。PDA组28例,其中,男13例,女15例,出生孕周为29+6~36+6周,平均出生孕周为(33.5±1.5)周,体质量(2 232.9±323.5)g;对照组102例,其中,男50例,女性52例,出生孕周为30+1~36+6周,平均出生孕周为(33±1.3)周,体质量(2 248.6±307.6)g。
1.2 仪器与方法
1.2.1 仪器 GE Vividi(美国GE公司)彩色多普勒超声诊断仪,心脏探头(型号:6S;频率:3.0~7.0MHz)。
1.2.2 方法 首次超声心动图检查于早产儿出生后24h内完成,24h内首次测量数据包括:大动脉短轴切面观察未闭合动脉导管分流的方向,频谱多普勒测量降主动脉与肺动脉的压差(△Ps)(文中所测时相均为收缩期);再使用公式:肺动脉收缩压(PASP)=主动脉压(AOSP)-△Ps,在无左室流出道狭窄时,AOSP与肱动脉收缩压(BASP)相近,可替代AOSP,从而计算出PASP。剑突下两房心切面用频谱多普勒测量卵圆孔分流速。分别于72h、7d行超声心动图检查,观察动脉导管是否闭合。如72h动脉导管已闭合者则不再行超声心动图检查。各超声血流参数均测3个心动周期,取其平均值。以上图像采集及数据测量均由同一名经验丰富的超声科医生使用同一台超声诊断仪器完成。
1.3 统计学处理 采用SPSS11.5统计软件对数据分析处理,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 早产儿动脉导管72h及7d内关闭率 130例早产儿出生后72h及7d内动脉导管自然关闭率分别为70.0%(91/130)及78.5%(102/130);未关闭率分别为30.0%(39/130)及21.5%(28/130)。
2.2 两组早产儿首次超声测量血流参数比较 PDA组降主动脉与肺动脉的压差小于对照组(P<0.001),见图1。PDA组的肺动脉收缩压高于对照组(P<0.001);PDA组卵圆孔的分流速小于对照组(P<0.05),见图2、表1。
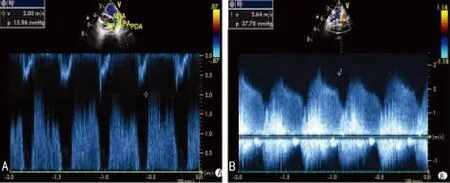
图1 降主动脉与肺动脉压差
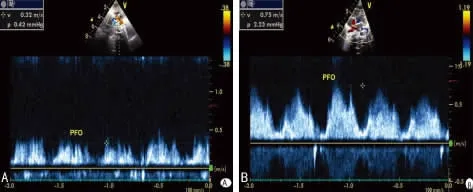
图2 卵圆孔分流速度

表1 出生后24h两组患儿超声心动图血流参数比较(x±s)
2.3 出生后24h超声心动图血流参数预测 PDA早期自然关闭的最佳临界点、灵敏度、特异度、阳性似然比[灵敏度/(1-特异度)]、阴性似然比[(1-灵敏度)/特异度],见表2。
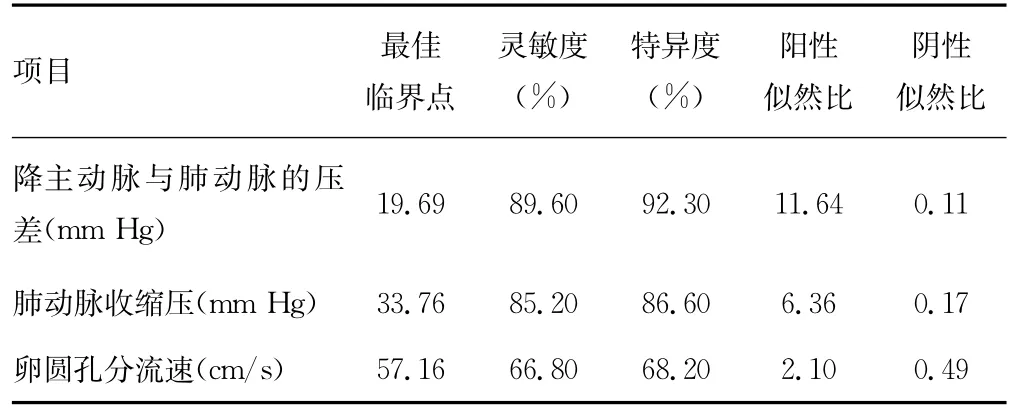
表2 出生后24h两组患儿超声心动图血流参数ROC曲线结果比较
通过绘制ROC曲线得出PDA早期自然关闭△Ps、PASP及卵圆孔分流速的最佳临界点分别为:19.69mm Hg、33.76 mm Hg及57.16cm/s。临界点预测早产儿PDA早期自然关闭的灵敏度、特异度、阳性似然比、阴性似然比见表2。降主动脉与肺动脉压差的阳性似然比及阴性似然比分别为11.64、0.11,即当△Ps<19.69mm Hg时,该早产儿来自PDA组患儿的可能性是来自对照组患儿的11.64倍;当△Ps>19.69 mm Hg时,该早产儿来自PDA组患儿的可能性是来自对照组患儿的约0.11倍。PASP的阳性似然比及阴性似然比分别为6.36、0.17,即当 PASP>33.76mm Hg时,该早产儿来自PDA组患儿的可能性是来自对照组患儿的6.36倍;当PASP<33.76mm Hg时,该早产儿来自PDA组患儿的可能性是来自对照组患儿的约0.17倍。卵圆孔分流速度的阳性似然比及阴性似然比分别为2.10、0.49,即当卵圆孔分流速<57.16 cm/s时,该早产儿来自PDA组患儿的可能性是来自对照组患儿的2.10倍;当卵圆孔分流速大于57.16cm/s时,该早产儿来自PDA组患儿的可能性是来自对照组患儿的0.49倍。
3 讨 论
动脉导管(ductus arteriosus)在胎儿时期是肺动脉和降主动脉之间的正常通道。由于胎儿期几乎无肺循环,肺处于不张状态,肺血管网关闭,因此,肺循环阻力高,肺动脉压力高于主动脉压力,右心室血流从肺动脉经过开放的动脉导管进入主动脉。胎儿出生后开始呼吸,肺开始扩张,从而使肺循环阻力下降,肺动脉压降低,由于肺动脉压力降低,主动脉压力升高,流经动脉导管的血流量逐渐减少,动脉导管早期形成功能性关闭。但在某些因素影响下,动脉导管可延迟关闭或不关闭[9]。早产儿动脉导管发育不成熟,管壁薄,且动脉导管对血管活性物质的反应敏感性下降,因此,PDA发病率较足月儿高。本研究发现早产儿7d内动脉导管未关闭率为21.5%。
国内外部分学者利用超声心动图二维及彩色多普勒预测PDA的预后及监测药物疗效[10-11],但尚未有文献报道利用超声心动图血流参数预测早产儿动脉导管早期能否自然闭合。本研究发现,PDA组的肺动脉收缩压高于对照组,这是由于受PDA的血流动力学改变影响。PDA在一般情况下,因肺动脉压力在整个心动周期中小于主动脉压,故整个心动周期,血流均自主动脉通过动脉导管向肺动脉分流。这样肺动脉不仅要接受来自右心室的血液,同时还接受从主动脉分流来的血液,从而使肺循环血流量明显增加,导致回流到左心房的血流量也增加,加重了左心室前负荷;同时,主动脉向肺动脉分流使体循环血流量减少,为保持体循环的正常供给,从而导致左心室肥厚和扩大,进一步使得主动脉向肺动脉分流量增加,加重肺动脉和右心室负荷,从而引起肺动脉高压和右心室肥厚。如果持续发展,未能阻断左-右分流,最终导致右-左分流,即艾森曼格综合征[12-13]。故PDA组肺动脉压力高于对照组。在本研究中无1例动脉导管分流束方向从肺动脉到降主动脉的病例,因为当肺动脉压过高后,临床将会用药控制,均不能纳入研究对象。本研究发现PDA组肺动脉与降主动脉压差低于对照组,这是由于当存在PDA时,△Ps=AOSP-PASP。当肺动脉收缩压增高时,压差就会降低。本研究PDA组肺动脉压高于对照组,因此,肺动脉与降主动脉压差低于对照组。本研究还发现PDA组卵圆孔分流速度低于对照组,分析可能原因为大部分新生儿7d内卵圆孔是未闭合的,一般情况下,主要表现为左心房向右心房分流,分流量的多少及速度决定于左右心房压力差。当肺动脉压增高时,右心室后负荷增加,右心房压力也增加;另一方面,PDA时肺循环阻力增加,回流到左心房压力增加;因此,左右心房的压力均有增加,本研究得出PDA时卵圆孔流速减慢,分析可能是由于虽然左右心房压力增加,但压差减小。本研究通过绘制ROC曲线得出肺动脉压、肺动脉与降主动脉压差及卵圆孔分流速度的最佳临界点分别为:19.69 mm Hg、33.76mm Hg及57.16cm/s。并得出相应的灵敏度、特异度,并测算出阳性似然比、阴性似然比。其中,肺动脉压及降主动脉与肺动脉压差的实验指标最为理想,对临床具有重要的指导意义。
本研究利用超声血流参数预测早产儿动脉导管早期能否自然关闭有极其重要的临床指导价值及意义。但仅利用血流参数预测也存在一定的局限性。倘若能将频谱多普勒与二维及彩色多普勒有效结合起来,共同预测早产儿PDA早期是否能自然关闭,有望使超声心动图相关参数成为预测早产儿动脉导管早期能否自然关闭的标准。
[1]Van Overmeire B,Chemtob S.The pharmacologic closure of the patent ductus arteriosus[J].Seminars in Fetal and Neonatal Medicine,2005,10(2):177-184.
[2]Mezu-Ndubuisi OJ,Agarwal G,Raghavan A,et al.Patent ductus arteriosus in premature neonates[J].Drugs,2012,72(7):907-916.
[3]Saldeño YP,Favareto V,Mirpuri J.Prolonged persistent patent ductus arteriosus:potential perdurable anomalies in premature infants[J].J Perinatol,2012,32(12):953-958.
[4]Clyman RI.Mechanisms regulating the ductus arteriosus[J].Biol Neonate,2006,89(4):330-335.
[5]Noori S,Mccoy M,Friedlich P,et al.Failure of ductus arteriosus closure is associated with increased mortality in preterm infants[J].Pediatrics,2009,123(1):e138-e144.
[6]Agarwal R,Deorari AK,Paul VK.Patent ductus arteriousus in preterm Neonates[J].Indian J Pediatr,2008,75:277-280.
[7]Sekar KC.Protective strategies to prevent patent ductus arteriosus[J].Chin Med J(Engl),2010,123(20):2914-2918.
[8]姜毅,高翔羽,谷成锁,等.口服消炎痛治疗新生儿动脉导管未闭临床观察[J].新生儿科杂志,2003,18(1):12-14,47.
[9]Gournay V.The ductus arteriosus:Physiology,regulation,and functional and congenital anomalies[J].Arch Cardiovasc Dis,2011,104(11):578-585.
[10]Nadir E,Kassem E,Foldi S,et al.Paracetamol treatment of patent ductus arteriosus in preterm infants[J].J Perinatol,2014,34(10):748-749.
[11]Sehgal A,Doctor T,Menahem S.Cyclooxygenase inhibitors in preterm infants with patent ductus arteriosus:effects on cardiac and vascular indices[J].Pediatr Cardiol,2014,35(8):1429-1436.
[12]Moceri P,Kempny A,Liodakis E,et al.Physiological differences between various types of Eisenmenger syndrome and relation to outcome[J].Int J Cardiol,2015,179:455-460.
[13]Schneider DJ.The patent ductus arteriosus in term infants,children,and adults[J].Semin Perinatol,2012,36(2):146-153.

