2015年WHO肺、胸膜、胸腺及心脏肿瘤分类(胸腺)解读
方三高,李晟磊,陈 岗
(1.第三军医大学大坪医院野战外科研究所病理科,重庆400042;2.郑州大学第一附属医院病理科,郑州450052;3.上海中山医院病理科,上海200032)

方三高
2015年3月,由来自29个国家或地区的157位专家共同编纂、国际癌症研究机构(international agency for research on cancer,IARC)发行的第4版《WHO肺、胸膜、胸腺和心脏肿瘤分类》[1](以下简称新版)正式出版,位列IARC发行的人类肿瘤组织学和基因分型系列的第7卷。新版以严格疾病导向的方式对诊断标准、病理特征和相关的遗传学改变进行了描述。作为权威而简明的参考书,为肿瘤学家和病理学家提供了国际标准,是研究和设计治疗反应监测及临床结果不可或缺的指南。全书412页,包含超过800幅彩色图像和表格,参考文献多达3 000条。与2004第3版分类[2](以下简称旧版)相比,增加了一些新内容,调整和简化了一些肿瘤的分类、名称及变异型,收录了12年来该研究领域尤其国际胸腺肿瘤协作组(international thymic malignancy interest group,ITMIG)的最新研究成果[3-5]。在胸腺肿瘤章节,最大的变化是将胸腺瘤一些主要类型重新定义为恶性。本文通过学习和解读,姑且算作同行评议(peer review),重点介绍新增内容。
1 胸腺肿瘤分类目录及新的结构调整
WHO胸腺肿瘤分类见表1。新版将原先肿瘤学国际疾病分类(ICD-O)编码为1的常见类型胸腺瘤,全部改为3。其实早在旧版第146页《WHO胸腺肿瘤组织学分类表》注2中就指出,“对于胸腺瘤而言,设定为恶性,其生物学编码为1~3”。新版取消了命名括号内的注解,如A型胸腺瘤(梭形细胞型;髓质型),转而以同义词形式出现;增加了非典型变异型。将微小胸腺瘤(显微镜下胸腺瘤)的ICD-O编码由1改为0,表明生物学行为良性。将神经内分泌肿瘤从胸腺癌中独立出来,另设一章。删除了非乳头状腺癌,将原先归于腺癌部分的腺鳞癌、腺样囊性癌及胸腺癌,非特殊类型归于“其他罕见类型的癌”。将伴t(15;19)易位的癌更名为NUT癌。删除了肉瘤样癌后面括号内的癌肉瘤,并将旧版位于其后的透明细胞癌提前。删除了混合型胸腺瘤,同时指出,一种以上胸腺瘤亚型成分的肿瘤应列出主要成分,次要成分以10%为增量予以记录,<5%将予以忽略。将“胸腺脂肪瘤(thymolipma)”中的“胸腺”二字取消。将脂肪肉瘤中的高分化、去分化、黏液样及多形性4个亚型一一列举,并分别标示其各自的ICD-O编码,与之情况类似的还有滑膜肉瘤。新增“其他罕见类型胸腺瘤(other rare thymoma)”下设微小胸腺瘤(microscopic thymoma)、硬化性胸腺瘤(sclerosing thymoma)及脂肪纤维腺瘤(lipofibroadenoma)3种。

表1 WHO胸腺肿瘤分类△,▽

续表1 WHO胸腺肿瘤分类△,▽

续表1 WHO胸腺肿瘤分类△,▽
2 胸腺肿瘤的临床病理分型
恶性胸腺上皮性肿瘤的TNM分期及胸腺生殖细胞肿瘤的TNM分期见表2~3。除少数具有显著多形性或异质性者可诊断直接为恶性外,大多数病例在细胞学上不能分辨出良性或恶性,目前,仍使用以包膜是否浸润及有无转移而制订的Masaoka分期,作为胸腺瘤的临床分期。研究表明Makaoka分期[6]及其修订版[7-8],可作为影响胸腺瘤的独立预后因素,在一定程度上反映胸腺瘤的临床病理特征和生物学行为,对治疗有指导意义。

表2 恶性胸腺上皮性肿瘤TNM分类

表3 胸腺生殖细胞肿瘤的TNM分类

续表3 胸腺生殖细胞肿瘤的TNM分类
3 胸腺瘤的流行病学、病因学及并发症
新版没有单独设立胸腺瘤总论或概述,而是置于A型胸腺瘤段首,穿插式说明。与旧版相比,新版承上启下,更多表述建立在循证医学与统计学基础之上。总体上,胸腺瘤是罕见的恶性肿瘤,却是成人最常见的纵膈肿瘤。据报道[1]胸腺瘤的年发病率为每百万人2.2~2.6例,而胸腺癌年发病率每百万人为0.3~0.6例。从图1纵膈肿瘤频率分布图可以看出,成人胸腺上皮性肿瘤占10%(左),而儿童约占46%(右)。
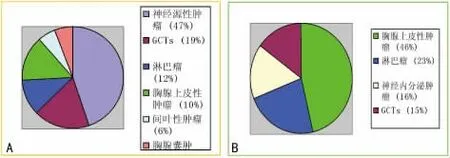
图1 纵膈肿瘤频率分布图
胸腺瘤病因不明,可能与胸腺皮髓分化成熟停滞(maturation arrest)有关[13]。环境、病毒或营养因素并非在胸腺瘤的发生中扮演了流行病学角色。据报道,一些胸腺瘤恰巧发生于放疗后、实性脏器移植及HPV感染之后。遗传学危险因子及家族背景也可能与发病有关。表5以数据列表形式说明了各型胸腺瘤的流行病学、临床病理学特点及比例关系。胸腺瘤可以引起许多自身免疫性疾病(autoimmune disorders)或伴发副肿瘤综合征(paraneoplastic disorders),见表6。基于 HE染色,免疫组织化学法检查有助于鉴别诊断,由于敏感性或特异性差异,可出现交叉免疫反应,最好选用两种或以上抗体(表7)联合应用(A panel of antibody),提高诊断准确性[14]。

表4 Masaoka-Koga分期系统结合组织学标准及相应(实验性)TNM分期[12]

表5 各型胸腺瘤的流行病学、临床病理学特点及比例关系

表6 与胸腺瘤相关的自体免疫性疾病和副肿瘤综合征选编

表7 有助于胸腺瘤各亚型间、胸腺瘤与胸腺癌之间及胸腺癌与其他癌之间鉴别诊断的常规免疫组织化学法标记物(应用区别特异性靶抗体检测,可将正常胸腺皮质和髓质上皮细胞及胸腺瘤各亚型区分开来)

续表7 有助于胸腺瘤各亚型间、胸腺瘤与胸腺癌之间及胸腺癌与其他癌之间鉴别诊断的常规免疫组织化学法标记物(应用区别特异性靶抗体检测,可将正常胸腺皮质和髓质上皮细胞及胸腺瘤各亚型区分开来)
4 新增病种
4.1 A型胸腺瘤包括非典型变异型(type A thymomas including atypical variant) 旧版认为A型胸腺瘤“组织学上既没有明显的小叶,也没用其他类型胸腺瘤所见的纤维分割带”。但新版委婉地应用了“也许(may)”一词,指出也许存在粗大分叶结构伴厚的纤维分割带。事实上不同类型的胸腺瘤或多或少地呈现分叶状结构,由于肿瘤分化的异质性,同一个肿瘤内显示不同的形态很常见。为此,新版建议废弃使用旧版所称的复合型胸腺瘤,而应根据其所示的主要成分诊断,列举出所有呈现的组织学类型,其最少成分至少应满足10%的比例。一般A型胸腺瘤缺乏或少见不成熟性淋巴细胞,若出现TdT阳性细胞且比例大于10%,应归为AB型。通常A型胸腺瘤的分叶状结构不明显,肿瘤细胞呈梭形或纺锤形,形成模糊的实性片状或表皮样结构,组织多形性可明显,但细胞异型性相对较小,形态温和,核仁不显著,核分裂较少,通常小于4个/2 mm2。上皮内淋巴细胞稀少,缺乏胸腺小体(hassall corpuscles)。非典型A型胸腺瘤变异型(atypical type A thymoma varient)[15]为新增内容,肿瘤组织呈现程度不同的非典型,如富于细胞、核分裂增加(>4个/2mm2)及局灶性坏死(真性肿瘤性凝固性坏死而非梗死或活检诱导的坏死)。其他标准如非典型区域的范围,核增大、核仁增大、Ki-67指数增高等[16-17]特点的意义,仍然有待确定。
4.2 AB型胸腺瘤(type AB thymoma)新版定义 一种胸腺上皮性肿瘤,由淋巴细胞较少的梭形细胞A型(type A)成分及丰富的B型样(type B-like)淋巴细胞成分组成,伴显著的未成熟性T细胞,2种成分比例相对变化较大。顾名思义,镜下兼有A型和B型两种形态,形成不连续的分隔结节或二者相互混合。梭形上皮成分与A型胸腺瘤的相似,而富于淋巴细胞
区域,由小圆形、卵圆形或梭形核的所谓小多边形上皮细胞构成,染色质分散,核仁不明显。不出现胸腺小体和髓样分化。新版不推荐使用其同义词“混合型胸腺瘤”。ITMIG[3-4]建议根据TdT+细胞的数量,协助其鉴别诊断。TdT+细胞计数标准划分为3级,1级:没有或仅见少量的TdT+细胞(计数容易),可诊断为A型胸腺瘤;2级:送检物中可见中等量的TdT+细胞(如果必须计数,可以数得清),当所占成分少于全部活检标本的10%时,仍诊断为A型胸腺瘤;3级:任意大于10%范围存在中等量的TdT+细胞或任意范围内含有大量(不可计数)TdT+细胞,倾向于诊断为AB型胸腺瘤。研究表明[16],A型及AB型胸腺瘤若出现坏死,其分期应相应提高。AB型3个显著的形态学特征有别于其他类型的胸腺瘤:(1)梭形细胞为主型与淋巴细胞较少型成分及富于淋巴细胞型成分混合;(2)形态温和的梭形、卵圆形细胞与局灶性多角形胸腺上皮细胞混合;(3)伴有局灶性或大量弥漫性未成熟性T细胞。
4.3 B1型胸腺瘤(type B1thymoma) 不管是定义还是形态特征,新旧版表述变化不大。同义词“富于淋巴细胞性胸腺瘤”、“淋巴细胞型胸腺瘤”、“器官样胸腺瘤”、“皮质为主型胸腺瘤(不推荐)”,提示其组织学特点。镜下少量肿瘤型胸腺上皮散在分布于许多未成熟的淋巴细胞中,细胞呈卵圆形,小至中等大小,核圆形,可见小核仁。拼图样(Jigsaw puzzle)结构多见,部分区域可有明确的髓质分化和形成生发中心,表现为皮质扩大,可见以未分化T细胞(TdT、CD1a、CD99阳性)为主的深染区(暗区),灶性分布于以成熟性T细胞(CD3、CD5呈阳性)组成的淡染区(亮区)中。B1型为低危型胸腺瘤(low-risk thymoma),与其他类型的区别点在于:(1)与正常或非退化性胸腺皮质非常相似;(2)恒定出现髓质岛。小叶状排列方式及胸腺小体明显,易与正常胸腺混淆,但小叶比正常胸腺的大,被细胞稀少而胶原化的纤维所分割。另外,B1型的小叶也比胸腺增生(hyperplastic thymus)的要大,纤维囊更厚,呈现纤维性间隔,皮质为主区可见髓质岛,上皮细胞表达AIRE。
4.4 B2型胸腺瘤(Type B2thymoma) 与B1型相比,B2型的细胞更大更丰富,缺乏髓质分化区[18],而常见明显的血管外间隙(perivascular spaces,PVS,皮髓交界区血管与组成胸腺小叶上皮细胞之间的间隙,本质上由胸腺上皮细胞围绕毛细血管形成的血液-胸腺屏障)。大量未成熟的淋巴细胞背景中,散布较多肥硕的肿瘤性胸腺上皮,为其主要成分。细胞异型较明显,胞质丰富,核大,可见大泡状核,核仁明显。核分裂多,但髓质部分较不突出或缺如,无或罕见胸腺小体。有别于其他类型的胸腺瘤的显著特征:(1)多边形而非梭形肿瘤性上皮细胞常成簇出现,数量比正常或B1型胸腺瘤中的更多;(2)更大程度上混合未成熟性T细胞。罕见的B2型胸腺瘤伴间变(B2type thymoma with anaplasia)保留了非典型胸腺瘤的特征:T细胞表达TdT、形成血管外皮瘤样间隙、分叶状生长方式及CD5/CD117的失表达。
4.5 B3型胸腺瘤(Type B3thymoma) 是一种上皮为主的胸腺上皮性肿瘤,由轻到中度非典型多边形肿瘤细胞组成,呈现片层状、实性生长方式。大部分病例混杂非肿瘤性未成熟性T细胞。B3型胸腺瘤大体呈浸润性生长,缺乏完整的包膜。同义词有:非典型胸腺瘤,上皮性胸腺瘤,鳞状上皮样胸腺瘤,高分化胸腺癌[不推荐]。与其他类型不同之处在于:(1)以多边形上皮细胞为主,排列成实性片层状,致HE染色低倍镜下呈粉红色外观;(2)其间混杂少量未成熟性T细胞。与A型胸腺瘤相比,B3型可见核沟及更多的核分裂像,存在醒目的CK19或AE1/3阳性的上皮细胞网(epithelian network)、更明显的或大量更开放(more open)的血管周围空隙,以及更高的Ki-67增殖指数(>13.5%)[17]。根据“经验法则(rule of thumb)”,形态诊断的至高境界是注重胞质的染色差异,B2型胸腺瘤由于含有大量的淋巴细胞,肿瘤HE染色为典型的蓝色,而B3型胸腺瘤由于缺乏淋巴细胞,存在大量的上皮细胞,胞质嗜酸或透明,HE染色为粉色,但前提是染色良好。B2型EMA阴性,而B3型至少局灶阳性,有助于二者鉴别。胸腺癌可存在成熟性淋巴细胞,但缺乏未成熟性淋巴细胞,而与B3型胸腺瘤不同[4,19]。
4.6 微结节性胸腺瘤伴淋巴样间质(Micronodular thymoma with lymphoid stroma) 一种以小而多发的肿瘤岛组成为特征的胸腺上皮性肿瘤,形态温和,由梭形或卵圆形细胞构成,周围由无上皮细胞的淋巴样间质围绕,可含有淋巴滤泡。又称为微结节性胸腺瘤伴淋巴样B细胞增生(micronodular thymoma with lymphoid B cell hyperplasia)。旧版在组织学分类表中为“微小结节胸腺瘤”,用的简称,而在分叙中又用其全称,显得不够严谨,新版不仅名称前后统一,而且延续了ICD-O编码为1的情况,表明生物学行为不确定、交界性或未定。本型较罕见,约占所有病例的1.0%~1.4%。病因不明。有关淋巴样间质被认为是肿瘤细胞所表达的趋化因子所募集,如朗格汉斯细胞(Langerhans cells,LCs)提呈肿瘤抗原并迁移至基质,经T淋巴细胞激活,在那里成熟形式抗原决定簇,导致淋巴滤泡形成[20]。推测胸腺上皮性肿瘤的前驱病变起源于此。临床通常无症状,偶然发现。病变局限,62%的有包膜,属于Ⅰ期,36%的具有微小浸润,为Ⅱ期。在ITMIG数据库中,96%的病例为Ⅰ期或Ⅱ期。肿瘤质软,直径3~15cm,大体上边界清楚有包膜,切面均一、灰白色,偶尔可见大小不等的囊性间隙。微结节性胸腺瘤伴淋巴样间质的上皮巢更大,范围更广泛,而与微小胸腺瘤(microscopic thymoma)不同,后者肉眼检查无明确肿瘤,仅镜下可见肿瘤性胸腺上皮增生,呈多灶性,直径常小于1 mm。微小胸腺瘤是新版中唯一不升反降的特例,其ICD-O编码由原来的1变为0,表明其生物学行为呈良性。
4.7 化生型胸腺瘤(Mataplastic thymoma) 又称为胸腺瘤伴假肉瘤样间质;低级别化生性胸腺瘤;双向型胸腺瘤;混合性多角形及梭形细胞型胸腺瘤。上述同义词提示肿瘤主要由上皮细胞及梭形细胞两种成分构成,前者表达CK及CK19,但不表达CK20;后者表达CD34、SMA及calponin,但不表达desmin。化生性胸腺瘤与其他类型不同的明显特征是:(1)由上皮细胞岛及形态温和的梭形细胞双向构成;(2)整个肿瘤缺乏或仅见少量淋巴细胞。重点与肉瘤样癌鉴别,后者侵袭性更大,总显示高级别梭形细胞成分伴显著的非典型,核分裂多见,常见明显的凝固性坏死,Ki-67一般大于10%。
4.8 肉瘤样癌(Sarcomatoid carcinoma) 新版同义词为梭性细胞癌或化生性癌,而旧版为癌肉瘤、梭性细胞胸腺癌。大部分梭性细胞癌由普通型A型胸腺瘤区域与细胞学恶性的梭性细胞区域混合,也有全部由恶性梭性细胞构成者,2种成分转变可呈渐近式,也可很突然。如果出现CD5或其他胸腺癌标记物呈阳性,强烈支持原发性而非转移。
4.9 腺癌(Adnocarcinoma) 是一组具有异质性的恶性胸腺上皮性肿瘤,显示腺样和(或)黏液分化。除了乳头状腺癌外,新增2个亚型:伴腺样囊性癌样特征的胸腺癌(thymic carcinoma with adenoid cystic carcinoma-like features)及黏液性腺癌(mucinous adenocarcinoma)。前者在组织病理学叙述中又称为腺样囊性癌样肿瘤(adenoid cystic carcinoma-like tumour),其组织学特点非常类似唾液腺的同名肿瘤,需与转移癌鉴别。黏液性腺癌常与胸腺囊肿有关,若出现从良性囊肿内衬上皮到腺癌的移行区,支持原发性而非转移性。新版将形态学不能满足上述任何亚型,试验性(tentatively)地归于“腺癌,非特殊类型(adenocarcinoma,NOS)”中,包括伴乳头状结构的高级别腺癌、管状腺癌及乳头状管状腺癌。组织学上不同程度混合了内衬柱状细胞的单纯性管状、复杂性管状及乳头状管状结构,腺腔内碎片及凝固性坏死很常见。应用CD5或CD117有助于与转移性腺癌鉴别,但阴性不能完全排除诊断,阳性也不全具有特异性,尚需结合器官特异性标记物如TTF-1、GCDFP-15、TG等来协助诊断。由于肠型腺癌[21]可表达 CDX-2、Villin及MUC-2,易与胃肠道转移性癌混淆,故详细查体显得非常重要。
4.10 NUT癌(NUT carcinoma) 是一种低分化癌,遗传学定义为出现NUT基因重排。旧版称之为“伴t(15;19)易位的癌”。镜下典型者呈片层状或巢状排列,细胞小到中等大小,由单形性未分化细胞组成。核大小均匀,轮廓不规则,具有小核仁,染色质轻微粗大。偶尔可见大细胞,胞质变化较大,从苍白嗜酸性到嗜碱性不等,也可呈颗粒样外观。核分裂丰富,坏死常见。常见并且特征性的表现为“突然灶性角化(abrupt foci of keratinization)”现象。尽管一些病例仅呈现少量慢性炎,但活跃的急性炎细胞常与肿瘤细胞混合存在。明显的腺管样及间质分化不常见。组织学特点并非特异,需与未分化癌、低分化鳞状细胞癌及未分化小圆蓝色细胞恶性肿瘤等鉴别[22-23]。免疫组织化学法检查持续性表达睾丸核蛋白(nuclear protein of the testis,NUT/askNUTM1)。70%的 NUT癌以 NUT基因染色体易位及融合到 BRD4形成t(15;19)(q13;p13.1),约6%与 BRD3融合形成t(15;19)(15q14;9q34.2)为特征。NUT癌为侵袭性极强的肿瘤,中位存活期仅6.7个月[1]。
4.11 腺鳞癌(adenosquamous carcinoma) 新版隶属“其他罕见类型的癌”,而旧版部分归于“非乳头状腺癌”名下,部分属于业已删除的“混合性生殖细胞肿瘤”。很显然,由鳞状细胞癌(p63、p40及 CK5/6呈阳性)与腺癌(表达 CK7、CK20,有时CDX2呈阳性)混合或碰撞而形成,表明肿瘤分化的异质性,二者所占比例至少10%,诊断时最好说明各自所占的比例。注意不要与腺棘皮癌,即腺癌中的鳞化混淆。
4.12 肝样癌(hepatoid carcinoma) 旧版归属于非乳头状腺癌中,以一位78岁女性直径约10cm的肿块为例,缺乏卵黄囊成分,肿瘤及血清AFP不高,当时就指出,诊断为胸腺肝样癌比纵膈卵黄囊瘤的“单向性”亚型更合适。果然新版成为独立病种。形态特征及免疫表型均与发生于胃肠道等处的肝样腺癌(hepatoid adenocarcinoma)相似,凡呈肝细胞癌样分化,不论其是否产生AFP,均可诊断肝样癌,但AFP阳性有助于增加了诊断准确率。形态学必须除外纵膈转移及肝样卵黄囊瘤(hepatoid yolk sac tumor),详尽了解临床病史及仔细查体有助于鉴别。镜下肿瘤结节由大的类似肝细胞的多边形细胞构成,但缺乏肝窦、门静脉结构或肿瘤间质[24],大的多角形细胞具有丰富的嗜酸性胞质,肿瘤细胞间或内可呈现PAS染色阳性小球(具有α-1抗胰蛋白酶免疫活性)。
4.13 胸腺神经内分泌肿瘤(thymic neuroendocrine tumours)命名原则及诊断依据与肺及胃肠道同类肿瘤类似,见表8。低级别和中级别的胸腺神经内分泌肿瘤的形态学变异型可分为梭形细胞型、色素型、伴淀粉样、嗜酸型、黏液型、血管瘤样型及以上各变异型的复合型。胸腺癌复合大细胞神经内分泌癌(thymic carcinoma combined large cell neuroendocrine carcino-ma)及胸腺癌复合小细胞癌(thymic carcinoma combined small cell carcinoma)中较少成分所占比例,应至少10%。
4.14 复合性胸腺癌(combined thymic carcinoma) 由于分化异质性,包含B1、B2和B3型成分的胸腺瘤很常见,新版采纳ITMIG的建议,删除了复合性胸腺瘤,而保留了复合性胸腺癌。其定义为“至少由一种类型的胸腺癌和另一种类型的胸腺上皮性肿瘤共同组成,后者可为任何类型的胸腺瘤或胸腺癌,但那些伴小细胞或大细胞神经内分泌癌成分者,应被排除在外,而应分别诊断为复合性小细胞神经内分泌癌及大细胞神经内分泌癌”。同义词为:混合性胸腺瘤-胸腺癌;复合性胸腺上皮性肿瘤。最常见的类型为鳞状细胞癌合并B3型胸腺瘤及乳头状腺癌或肉瘤样癌伴A型胸腺瘤。不同类型的成分均应在HE染色上显而易见,两种成分可逐渐移行,也可徒然分界。同一复合型胸腺癌中出现2种不同胸腺癌的成分罕见。报告时要具体到每种癌的百分比、组织学类型、伴随的胸腺瘤的成分及相对百分比。占据主要者列举在先,较少肿瘤的成分附后,报告其所占比例至少10%。如“由鳞状细胞癌与淋巴上皮瘤样癌构成的复合性胸腺癌,其比例分别为70%及30%”。胸腺癌上皮细胞可表达一些淋巴样抗体(包括CD5、CD70、CD74),据此可与胸腺外来源的癌相鉴别。请注意复合性(combined thymic carcinoma)与混合性胸腺癌(mexed thymic carcinoma)的差别,后者并非独立病种,而是合并除胸腺上皮性肿瘤及神经内分泌肿瘤之外其他类型的恶性肿瘤,如胸腺癌混合了淋巴瘤[25]。
4.15 混合性生殖细胞肿瘤(mixed germ cell tumours) 一种由两种或更多类型的生殖细胞肿瘤构成的新生物。诊断时同样应列举其各自成分及其大致比例。精原细胞瘤与非精原细胞瘤的预后明显不同,必须鉴别,参见表9。传统抗体如AFP结合新的免疫组织化学法标记物如SALL4等,相互补充,联合应用,有助于鉴别诊断,详见表10。

表8 胸腺神经内分泌肿瘤分类

表9 纵膈生殖细胞肿瘤与精原细胞瘤的一般特征对照

续表9 纵膈生殖细胞肿瘤与精原细胞瘤的一般特征对照
5 一些容易混淆的诊断问题
5.1 胸腺增生(thymic hyperplasia)与胸腺瘤 胸腺增生虽未被新版WHO分类收录,但并非罕见,约占重症肌无力(MG)的80%,临床上常因发现前上纵膈包块,误认为胸腺肿瘤而就诊[26]。可能与某些胸腺瘤的发生有关。增生的胸腺保持原形,切面无明显结节或肿块,质软,被膜较薄。有2种类型:真性胸腺增生(true thymic hyperplasia)[27]和胸腺淋巴样滤泡增生(thymic lymphoid follicular hyperplasia)[26-28]。真性 胸腺增生指大小超过同一年龄段正常胸腺上限,等比例均匀性增大。常继发于放化疗、皮质激素治疗及烧伤等应激事件,因免疫反应一过性(transient)增大,一旦应激事件停止,就会逐渐缩小甚至达到正常大小,故又称为反应性增生,临床上一般无MG症状。镜下与正常胸腺结构相似,保留原有小叶结构,皮髓质分界清楚。而淋巴样滤泡增生,形成活化的原始生发中心,皮质正常或变薄,髓质扩张,淋巴细胞增生明显,伴有典型胸腺小体,也称为自体免疫性胸腺炎,约65%患者合并MG。请注意:任何一个胸腺的占位性病变,只要有上皮细胞呈巢,哪怕只有2、3个,也是胸腺肿瘤,而不是胸腺增生。
5.2 胸腺瘤与胸腺癌 旧版认为绝大多数胸腺瘤具有良性生物学行为,建议在诊断中避免使用恶性胸腺瘤这一术语,但新版全部归为恶性,故二者需重点鉴别。新版并没有对胸腺癌做具体定义,而是作为一种排他性诊断,首先,需要确定“是什么?”:癌浸润性生长,细胞分化差,异型性明显,呈巢团状排列;其次,还要排除“不是什么?”:癌缺乏胸腺瘤那种特征性的结构如分叶状排列、血管周间隙形成、髓质分化及聚集不成熟的T细胞,除了CD5、CD117外,还可表达GLUT1及 MUC1,后者并不陌生,它的一个别称就叫上皮膜抗原-EMA;第三,尚需明确“具体是哪个类型或亚型?”这样一种诊断三部曲。在临床实践中区分胸腺瘤与胸腺癌,既要杜绝医生治疗过度(overtherapy)或不足(undertherapy);又要防止患者恐癌(cancerphobia),拿捏适度非常关键。因此,应如同对待胃肠间质瘤那样[29-30],根据组织学分类、临床分期、局部侵袭(包膜侵犯、邻近脂肪组织或周围器官侵犯)、手术切除范围、复发率、5年或10年生存率以及分子生物学指标等[5,31-33],并列使用危险度。ITMIG 就为此做了有益的尝试,如2014年胸腺上皮性肿瘤分类共识[4]中指出诊断应遵循类似Gleason评分的方式:(1)用表格形式取代单纯描述风格,每个独立病种(entity)包含主要(不可或缺的)和次要(典型的)诊断标准;(2)补充“图例库”来描述难于分类的“边缘性”病例(borderland case)的肿瘤。建议列出所有亚型的主要成分,大于10%的次要成分应予以记录。从新版来看并没有被采纳,相关内容在“组织病理学”项下仍然以平铺叙述或归纳式为主。请注意:(1)不论哪种类型,胸腺瘤总是伴有一定量的淋巴细胞;(2)不论淋巴细胞数量多少,总与上皮细胞有密切镶嵌关系;(3)如果出现淋巴结转移,不论形态属于哪一类型,均归于高级别胸腺瘤或胸腺癌;(4)无论大小或(和)百分比,含有胸腺癌成分的异质性胸腺瘤都应诊断为胸腺癌,不仅需具体说明百分比和组织学类型,还需列出附属的胸腺瘤成分。

表10 生殖细胞肿瘤变异型的免疫组化特征

表11 胸腺瘤分类演变
5.3 胸腺瘤与胸腺淋巴瘤 胸腺是免疫中枢,迁徙及演化过程中,淋巴细胞的任何分化成熟阻滞及归巢异常(pathologic lymphocyte homing),都会为以后此类肿瘤的发生提供可能。曾认为胸腺瘤是胸腺上皮的肿瘤,肿瘤内的淋巴细胞不论其数量多少以及是否成熟,均为反应性成分,但胸腺原发性结外边缘区黏膜相关淋巴瘤(MALToma)[34]等独特的发病机制,质疑这种观点。应用免疫组织化学法和分子生物学技术,有助于鉴别,需仔细观察抗体表达的部位及范围,出现网状分布的肿瘤性上皮细胞,表达CK、EMA,应诊断为胸腺瘤,而胸腺淋巴瘤通常表达淋巴细胞特异性抗体,除渐变性大细胞淋巴瘤可表达EMA外,均不表达上皮性标记物,其内的一些上皮,很可能是残存的。
5.4 原发瘤与继发瘤 胸腺临近肺、胸膜及心血管及食道等,发生肿瘤容易相互蔓延、累及或转移,需借助仔细而全面的查体、结合影像学及病理检查包括大体所见、免疫表型甚至分子生物学等手段,确定原发灶。
6 胸腺肿瘤分类历史演变与现实问题
胸腺瘤的预后因素主要与组织学分型、肿瘤分期和手术切除是否彻底有关。从表11可以看出,不同分类互有重叠,如Mǜller-Hermelink分类[35]中将髓质型和混合型归为良性,皮质型和分化良好胸腺癌型划分为恶性;第2版WHO分类[36]认为,A型和AB型为良性,B1型为低度恶性,B2型为中度恶性,B3型和C型为高度恶性;Suster等[18]将胸腺上皮性肿瘤分为胸腺瘤(分级:高分化“Grading:high differentiated”)、非典型胸腺瘤(分级:中分化“Grading:moderately differentiated”)及胸腺癌(分级:低分化“Grading:poorly differentiated”)。正是基于可重复性(reproducibility)、一致性(consistency)、简洁性(simplicity)及临床相关性(clinical relevance)原则[37-39],胸腺上皮性肿瘤的分类及临床病理分级(thymoma clinicpathological grading)才越来越趋于实用与合理。尽管如此,胸腺瘤的医学系统化命名WHO分类连续3版均为英文字母,以形态学为主的综合性命名问题依然搁置。
7 胸腺大体取材及报告模式
精准医学(precision medicine)通俗点讲就是根据疾病基因个体化差异量身裁衣从而制定靶向治疗方案。对于胸腺瘤而言,也需要精准,不妨引入这个词汇[43-44]。一方面,在全面掌握临床病史及影像学检查[45]的基础上,进行程序化或标准化的大体取材,详细而准确的镜下描述,联合常规免疫组织化学法检查,出具一份完整而全面的报告,包括预后判断的伴随诊断(companion diagnosis);另一方面,检测各类型胸腺瘤的分子生物学或遗传学特性,为分子靶向治疗做准备[32,46-47]。为此,ITMIG[3-4,48-49]及付浩等[50-51]在增刊或连续刊 文 形式系统 论 述了各自研究的最新成果。建议外科医生手术当中最好边切边对关注区域标记切缘(inked margins),或留置缝线,或用银夹,或用10%硝酸银(silver nitrate)/碳素墨水(carbon ink)涂边(sign out the outer surface),以便切除后辨认,为术后可能扩大手术和(或)放疗精确定位。大体取材首先将标本正确摆放,尽可能显示病变与周围组织或器官的解剖关系,绘图或照相能使复杂的解剖结构简单明了,特别是手术切缘。对胸腺肿瘤应间隔2~3作连续的书页状或面包状切开(section serially bread-loaf at 2~3intervals),注意不要切断,保持标本的完整性。肉眼所见可疑浸润区域应重点标记,取材采取垂直切缘(sections perpendicular to the margin),而不是“剃须状”边缘切除(shave sections of the margin),以便而获得真实的切缘情况。一般肿瘤细胞进入墨汁涂饰的边界才能定义为切缘阳性,若肿瘤暴露在纵膈胸膜和心包表面,但与正常体腔有分界(无粘连表现),不能归为切缘阳性[50]。但如果肿瘤临近切缘(close to the margin),应报告肿瘤组织到最外边界的距离,单位用毫米()。对包膜侵犯,可借用甲状腺滤泡癌的标准来判定(图2),肿瘤必须完全穿出包膜(thanscapsular invasion)方可,如图示中的1、7、8及9,后者较为特别,为包膜外孤立性的肿瘤性胸腺上皮巢,异型性更明显或分化更差,这种包膜外侵袭可视为卫星灶或包膜外播散(extracapsular spread),与被肿瘤挤压的残存胸腺小叶不同;可疑包膜侵犯(suspicious capsular involvement)指那些浸润包膜的肿瘤组织,不论是圆钝还是尖刺状,均超过包膜厚度的1/2,冲断纤维与包膜垂直而非平行,或呈蘑菇状生长而外侧又有新包膜,浸润处间质呈现促结缔组织增生、水肿或有纤维素样坏死,如图2中的2、4、6、11,遇到这种尚未突破(not yet breakthrough)的情况,最好做连续切片或补充取材,进一步观察明确;而侵犯未达包膜厚度1/2者,如图示中的3、5及10,根据“疑证从无”原则,可不予理会(should be disregarded),视为包膜无侵犯(negative)。病理报告尽可能为临床提供全面而精炼的资料,必要时可附加相关精准医学内容,如(前上纵膈)A型胸腺瘤。MasaokaⅠ期。肿瘤最大径5,包膜完整。未见淋巴管、血管浸润及周围器官累及。基因检测显示GTF21错义突变(present of GTF21missense mutation)[1]。

图2 胸腺瘤包膜侵犯示意图(仿Chan JKC)[52]
8 WHO、ITMIG及美国病理人协会(CAP)相关背景知识及相互衔接问题
术业有专攻,WHO许多内容来自ITMIG的最新研究。在2010年ITMIG成立之初,只是兴趣小组,作为私人资助、美国政府牵头的非盈利性学术机构,其使命是促进胸腺恶性肿瘤的临床和基础研究。中日也于2012年分别成立了相应的专业化研究团体“中国胸腺肿瘤协作组(Chinese Association for Research on the Thymus,ChART)”及“日本胸腺肿瘤协作组(Japanese Association for Research on the Thymus,JART)”,一同加入ITMIG。ChART由上海市肺科医院的方文涛、陈克能等教授于2012年6月组织发起。方教授不仅是ChART的现任领导,而且为ITMIG现任主席。2015年ITMIG年会即第六届世界胸腺肿瘤学术大会于10月24~25日在上海召开,全球有志于胸腺恶性肿瘤相关领域研究者,就最新科学及临床研究进展进行了集中讨论并建章立制。原上海市肺科医院的陈岗教授[53]成为继李维华教授参加2004年旧版修订研讨会之后,2015年WHO新版编委之一,为国内病理界争得了荣誉。美国病理人协会(CAP)2013年发表的《胸腺恶性肿瘤标本检查指南》[54]较为实用,附录见表12。但务请标注其文献来源,以示其版权所有。指南与新版TNM分期相辅相成,前者侧重临床,后者突出病理,由于先后发表,内容存在一定差异,应相互补充。

表12 胸腺瘤及胸腺癌患者标本检查指南(适用于位于纵膈任何区域的胸腺上皮性肿瘤)

续表12 胸腺瘤及胸腺癌患者标本检查指南(适用于位于纵膈任何区域的胸腺上皮性肿瘤)
9 小 结
新版与1994年第2版[2]及2004年第3版[32]一脉相承而又与时俱进,作为第三章的胸腺肿瘤变化最为显著,必须尽快学习,取其精华,加强学术交流,早日用于临床实践。
[1]Travis WD,Brambilla E,Burke,et al.WHO classification of tumours of the lung,pleura,thymus and heart[M].lyon:iarc press,2015:183-299.
[2]Travis WD,Brambilla E,Muller-Hermelink HK,et al.WHO classification of pathology and genetics of tumours of the lung,pleura,thymus and heart[M].lyon:iarc press,2004:146-196.
[3]Detterbeck FC,Stratton K,Giroux DA,et al.The IASLC/ITMIG thymic epithelial tumors staging project:proposal for an Evidence-Based stage classification system for the forthcoming(8th)edition of the TNM classification of malignant tumors[J].J Thorac Oncol,2014,9(9):S65-S72.
[4]Marx A,Ströbel P,Badve SS,et al.ITMIG consensus statement on the use of the WHO histological classification of thymoma and thymic carcinoma:refined definitions,histological criteria,and reporting[J].J Thorac Oncol,2014,9(5):596-611.
[5]Roden AC,Yi ES,Jenkins SM,et al.Reproducibility of 3 histologic classifications and 3staging systems for thymic epithelial neoplasms and its effect on prognosis[J].Am J Surg Pathol,2015,39(4):427-441.
[6]Masaoka A,Monden Y,Nakahara K,et al.Follow-up study of thymomas with special reference to their clinical stages[J].Cancer,1981,48(11):2485-2492.
[7]Koga K,Matsuno Y,Noguchi M,et al.A review of 79 thymomas:modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma[J].Pathol Int,1994,44(5):359-367.
[8]Roden AC,Yi ES,Jenkins SM,et al.Modified masaoka stage and size are Independent prognostic predictors in thymoma and modified masaoka stage is superior to histopathologic classifications[J].J Thorac Oncol,2015,10(4):691-700.
[9]Wittekind CH.TNM Supplement:A commentary on uniform use[M].4thed.Wiley-Blackwell,2012:1-2.
[10]Weissferdt A,Moran CA.Staging of thymic epithelial neoplasms:thymoma and thymic carcinoma[J].Pathol Res Pract,2015,211(1):2-11.
[11]Billmire D,Vinocur C,Rescorla F,et al.Malignant retroperitoneal and abdominal germ cell tumors:An intergroup study[J].J Pediatr Surg,2003,38(3):315-318.
[12]Detterbeck FC,Nicholson AG,Kondo K,et al.The Masaoka-Koga stage classification for thymic malignancies:clarification and definition of terms[J].J Thorac Oncol,2011,6(7Suppl 3):S1710-S1716.
[13]Ströbel P,Hartmann E,Rosenwald A,et al.Corticomedullary differentiation and maturational arrest in thymomas[J].Histopathology,2014,64(4):557-566.
[14]Alexiev BA,Drachenberg CB,Burke AP.Thymomas:a cytological and immunohistochemical study,with emphasis on lymphoid and neuroendocrine markers[J].Diagn Pathol,2007,2:13.
[15]Vladislav IT,Gökmen-Polar Y,Kesler KA,et al.The role of histology in predicting recurrence of type A thymomas:a clinicopathologic correlation of 23cases[J].Mod Pathol,2013,26(8):1059-1064.
[16]Green AC,Marx A,Ströbel P,et al.Type a and AB thymomas:histological features associated with increased stage[J].Histopathology,2015,66(6):884-891.
[17]Roden AC,Yi ES,Jenkins SM,et al.Diagnostic significance of cell kinetic parameters in World Health Organization type A and B3thymomas and thymic carcinomas[J].Hum Pathol,2015,46(1):17-25.
[18]Suster S.Diagnosis of thymoma[J].J Clin Pathol,2006,59(12):1238-1244.
[19]Moran CA,Walsh G,Suster S,et al.Thymomas II:a clinicopathologic correlation of 250cases with a proposed staging system with emphasis on pathologic assessment[J].Am J Clin Pathol,2012,137(3):451-461.
[20]Ishikawa Y,Tateyama H,Yoshida M,et al.Micronodular thymoma with lymphoid stroma:an immunohistochemical study of the distribution of Langerhans cells and mature dendritic cells in six patients[J].Histopathology,2015,66(2):300-307.
[21]Moser B,Schiefer AI,Janik S,et al.Adenocarcinoma of the thymus,enteric type:report of 2cases,and proposal for a novel subtype of thymic carcinoma[J].Am J Surg Pathol,2015,39(4):541-548.
[22]Evans AG,French CA,Cameron MJ,et al.Pathologic characteristics of NUT midline carcinoma arising in the mediastinum[J].Am J Surg Pathol,2012,36(8):1222-1227.
[23]Nakamura H,Tsuta K,Tsuda H,et al.NUT midline carcinoma of the mediastinum showing two types of poorly differentiated tumor cells:a case report and a literature review[J].Pathol Res Pract,2015,211(1):92-98.
[24]Franke A,Ströbel P,Fackeldey V,et al.Hepatoid thymic carcinoma:report of a case[J].Am J Surg Pathol,2004,28(2):250-256.
[25]Ito J,Yoshida A,Maeshima AM,et al.Concurrent thymoma,thymic carcinoma,and T lymphoblastic leukemia/lymphoma in an anterior mediastinal mass[J].Pathol Res Pract,2015,211(9):693-696.
[26]Ackman JB,Verzosa S,Kovach AE,et al.High rate of unnecessary thymectomy and its cause.Can computed tomography distinguish thymoma,lymphoma,thymic hyperplasia,and thymic cysts?[J].Eur J Radiol,2015,84(3):524-533.
[27]Judd R,Bueso-Ramos C.Combined true thymic hyperplasia and lymphoid hyperplasia in Graves′disease[J].Pediatr Pathol,1990,10(5):829-836.
[28]Nishino M,Araki T,Sholl LM.Reply to"usefulness of CT in differentiating lymphoid thymic hyperplasia from true thymic hyperplasia:added value of thymic measurements and CT attenuation"[J].AJR Am J Roentgenol,2015,204(1):W115.
[29]刘亚岚,徐晨,侯英勇,等.交界性胃肠道间质瘤279例临床病理学分析[J].临床与实验病理学杂志,2011,27(6):574-579.
[30]侯英勇,朱雄增.判断胃肠道间质瘤良恶性的方法[J].临床与实验病理学杂志,2013,29(12):1275-1278.
[31]方文涛,陈文虎,陈岗,等.胸腺上皮肿瘤的外科治疗--204例临床病理分析[J].肿瘤,2005,25(4):377-380.
[32]Wang Y,Xu HT,Ueda Y,et al.Activation ratio of MMP-2and expression of MT1-MMP are correlated in thymic epithelial tumours[J].Pathology,2007,39(5):486-490.
[33]Ruffini E,Detterbeck F,Van Raemdonck D,et al.Tumours of the thymus:a cohort study of prognostic factors from the European Society of Thoracic Surgeons database[J].Eur J Cardiothorac Surg,2014,46(3):361-368.
[34]Weissferdt A,Moran CA.Primary MALT-type lymphoma of the thymus:a clinicopathological and immunohistochemical study of six cases[J].Lung,2011,189(6):461-466.
[35]Müller-Hermelink HK,Marx A.Pathological aspects of malignant and benign thymic disorders[J].Ann Med,1999,31(Suppl 2):5-14.
[36]Rosai J,Sobin L.Histological Typing of Tumors of the Thymus.In:World Health Organization International Histological Classification of Tumors[M].2nd ed.Berlin Heidelberg:Springer-Verlag,1999:1-16.
[37]Harris NL,Müller-Hermelink HK.Thymoma classification.A siren′s song of simplicity[J].Am J Clin Pathol,1999,112(3):299-303.
[38]Marchevsky AM,Gupta R,Mckenna RJ,et al.Evidencebased pathology and the pathologic evaluation of thymomas:the World Health Organization classification can be simplified into only 3categories other than thymic carcinoma[J].Cancer,2008,112(12):2780-2788.
[39]Filosso PL,Ruffini E,Lausi PO,et al.Historical perspectives:The evolution of the thymic epithelial tumors staging system[J].Lung Cancer,2014,83(2):126-132.
[40]Bernatz PE,Harrison EG,Clagett OT.Thymoma:a clinicopathologic study[J].J Thorac Cardiovasc Surg,1961,42:424-444.
[41]Levine GD,Rosai J.Thymic hyperplasia and neoplasia:a review of current concepts[J].Hum Pathol,1978,9(5):495-515.
[42]Marino M,Müller-Hermelink HK.Thymoma and thymic carcinoma.Relation of thymoma epithelial cells to the cortical and medullary differentiation of thymus[J].Virchows Arch A Pathol Anat Histopathol,1985,407(2):119-149.
[43]Walk EE.The role of pathologists in the era of personalized medicine[J].Arch Pathol Lab Med,2009,133(4):605-610.
[44]Simonds NI,Khoury MJ,Schully SD,et al.Comparative effectiveness research in cancer genomics and precision medicine:current landscape and future prospects[J].J Natl Cancer Inst,2013,105(13):929-936.
[45]Treglia G,Sadeghi R,Giovanella L,et al.Is (18)F-FDG PET useful in predicting the WHO grade of malignancy in thymic epithelial tumors?A meta-analysis[J].Lung Cancer,2014,86(1):5-13.
[46]Yoh K,Nishiwaki Y,Ishii G,et al.Mutational status of EGFR and KIT in thymoma and thymic carcinoma[J].Lung Cancer,2008,62(3):316-320.
[47]Lattanzio R,La Sorda R,Facciolo F,et al.Thymic epithelial tumors Express vascular endothelial growth factors and their receptors as potential targets of antiangiogenic therapy:a tissue micro array-based multicenter study[J].Lung Cancer,2014,85(2):191-196.
[48]Nicholson AG,Detterbeck FC,Marino M,et al.The IASLC/ITMIG thymic epithelial tumors staging project:proposals for the T component for the forthcoming(8th)edition of the TNM classification of malignant tumors[J].J Thorac Oncol,2014,9(9Suppl 2):S73-S80.
[49]Kondo K,Van Schil P,Detterbeck FC,et al.The IASLC/ITMIG thymic epithelial tumors staging project:proposals for the N and M components for the forthcoming(8th)edition of the TNM classification of malignant tumors[J].J Thorac Oncol,2014,9(9Suppl 2):S81-S87.
[50]付浩,方文涛,谷志涛,等.外科医生和病理医生对胸腺恶性肿瘤切除标本的处理方法和程序[J].中国肺癌杂志,2014,17(2):95-103.
[51]付浩,中国胸腺瘤协作组全体成员.胸腺恶性肿瘤预后的标准评估方法[J].中国肺癌杂志,2014,17(2):122-129.
[52]Chan JKC.Tumors of the thyroid and parathyroid gland.In:Fletcher CDM,editor.Diagnostic Histopathology of tumors[M].3rded.London,England:Churchill Livingston,2007:997-1078.
[53]Chen G,Marx A,Chen WH,et al.New WHO histologic classification predicts prognosis of thymic epithelial tumors:a clinicopathologic study of 200thymoma cases from China[J].Cancer,2002,95(2):420-429.
[54]Butnor KL,Beasley MB,Kong FM,et al.Protocol for the examination of specimens from patients with thymoma and thymic carcinoma[D].College of American Pathologists(CAP),2013:1-9.

