DHA对IFN-γ诱导的3T3L1脂肪细胞MHCⅡ及炎症分子表达的影响
喻日成,罗建华,范元硕,刘 波
(贵州省人民医院内分泌科,贵阳550000)
肥胖已成为流行的健康问题,与代谢性疾病,例如胰岛素抵抗、2型糖尿病、高血压、非酒精性脂肪肝以及多囊卵巢综合征紧密相关[1]。肥胖相关的胰岛素抵抗的分子机制目前还不清楚,但是,最近的研究已经表明,低度慢性炎症是发病的重要因素[2-3]。脂肪细胞产生的脂肪细胞因子启动氧化应激和脂肪组织炎症反应,分泌促炎性细胞因子,包括肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、单核细胞趋化因子(MCP-1),导致胰岛素抵抗。MHCⅡ相关基因在脂肪细胞的炎症反应中起重要作用。有研究表明在高脂喂养2周的小鼠脂肪细胞中MHCⅡ相关基因的表达上调,并且与脂肪细胞中的T细胞促炎因子增加及抗炎因子减少相平行[4]。二十二碳六烯酸(docosahexaenoic acid,DHA)有抗炎作用,但目前其作用机制不清楚,有研究表明DHA可以通过抑制TLR2/3/4和TNF-α而产生抗炎作用[5]。本研究主要是探讨DHA对IFN-γ诱导的3T3L1脂肪细胞MHCⅡ及炎症分子 MCP-1、IL-6、iNOS表达的影响,进而从某方面阐明 DHA的抗炎机制。
1 材料与方法
1.1 主要试剂 3T3L1脂肪细胞(ATCC);低糖DMEM培养基:Giboco;胎牛血清:Giboco;RNA提取试剂盒:QIAGEN;逆转录 试 剂 盒:Applied Biosystems;LightCycler®TaqMan®Master:Roche;MCP-1、IL-6、β-actin一抗:BD Biosciences;辣根过氧化物酶(HRP)标记的二抗:Santa Cruz。
1.2 3T3L1脂肪细胞分化 10%小牛血清的DMEM高糖培养液37℃、5%CO2培养3T3L1脂肪细胞,待细胞生长至70%左右,胰蛋白酶消化,分别种植在6孔板及24孔板,2d后细胞生长至100%,去除培养液,加入含10%FBS,1μM地塞米松,0.5mM的IBMX,10μg/mL胰岛素的高糖DMEM培养基中分化2d。2d后换成含10%FBS、10μg/L胰岛素的DMEM继续分化。6d后倒置相差显微镜下观察发现细胞含有较多脂滴,油红染色证实细胞分化成熟。
1.3 分化成熟的3T3L1脂肪细胞处理 分化成熟的3T3L1脂肪细胞加入2ng/mL的IFN-γ,1h后加入200μM 的DHA,24孔板细胞4h后吸干培养液,加入RLT及β巯基乙醇裂解细胞,-80℃冻存以备提取RNA。6孔板细胞加入200μM DHA培养过夜,吸干培养液,用冰PBS液洗3次,加入细胞裂解液,提取总蛋白。
1.4 real time-PCR检测MHCⅡ的相关基因及炎症分子mRNA表达
1.4.1 总RNA制备 按QIAGEN试剂盒说明书介绍的方法提取总RNA,采用Nanodrop ND1000测量RNA的浓度。
1.4.2 cDNA合成 按逆转录试剂盒(Biosystems)说明合成cDNA,总反应体系20μL,反应条件:25℃10min,37℃120 min,85℃5min,4℃后取出样品-20℃保存。
1.4.3 PCR扩增 PCR总反应体系为10μL,含cDNA模板2μL,TaqMan®Master 5μL,ddH2O 2.5μL,引物0.5μL。PCR反应条件:50℃2min,95℃10min(1个循环);95℃5s,65℃ 1min,72 ℃ 20s(45个循环);72 ℃ 5min(1个循环)。每个real-time PCR重复3次,以36B4为管家基因,目的基因的相对表达量通过公式2-ΔΔCt计算。
1.5 Western blot测量 MCP-1、IL-6、iNOS蛋白的表达水平(1)收集处理的细胞,用冰PBS液洗3次,加入细胞裂解液,提取总蛋白,通过BCA方法测量蛋白浓度。(2)将30μg的蛋白样品加入10%SDS-PAGE点样孔,100v电压电泳1h。(3)电泳完的凝胶转PVDF膜,5%的脱脂牛奶封闭,加 MCP-1、IL-6、iNOS及β-actin一抗4℃过夜,TBST洗3次,加辣根过氧化物酶酶标记的二抗常温下30min,TBST洗3次。(4)化学发光法显影、定影,将胶片进行扫描拍照,用凝胶图像处理系统分析目标带的相对分子质量和净光密度值。
1.6 统计学处理 采用SPSS 11.0统计软件进行分析处理,数据以x±s表示,组间均数的比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 DHA对IFN-γ诱导的3T3L1脂肪细胞炎症因子表达的影响 3T3L1脂肪细胞加IFN-γ诱导后IL-6、iNOS、MCP-1表达均明显升高(P<0.05),表明IFN-γ可诱导脂肪细胞的炎症反应。IFN-γ诱导后加入200μM 的DHA后,IL-6、iNOS表达出现明显的下降(P<0.05),有而 MCP-1表达虽然有下降,但差异无统计学意义(P>0.05),见图1~2。这些结果表明DHA对IFN-γ诱导的炎症反应有抑制作用。

图1 DHA对IFN-γ诱导的3T3L1脂肪细胞炎症因子IL-6、iNOS、MCP-1mRNA相对表达量的影响

图2 DHA对IFN-γ诱导的3T3L1脂肪细胞炎症因子IL-6、iNOS、MCP-1蛋白相对表达量的影响
2.2 DHA对IFN-γ诱导的3T3L1脂肪细胞MHCⅡ相关基因表达的影响 3T3L1脂肪细胞加IFN-γ诱导后MHCⅡ相关基因Ciita、H2Ab1表达明显升高(P<0.01),加入200μM的DHA后,Ciita、H2Ab1的基因表达明显下降(P<0.05),见图3。IFN-γ可诱导脂肪细胞 MHCⅡ相关基因的表达,而DHA对这种诱导有抑制作用。
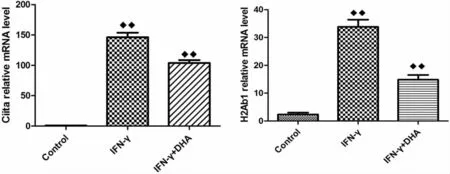
图3 DHA对3T3L1脂肪细胞IFN-γ诱导后MHCⅡ相关基因Ciita、H2Ab1表达影响
3 讨 论
脂肪组织不仅是一种储能器官,而且还可以作为一种内分泌器官分泌多种生物活性物质[6-7]。由脂肪组织分泌的细胞因子有促炎和抗炎作用,促炎性因子分泌增加可导致胰岛素抵抗及多种代谢性疾病如糖尿病、冠心病、高血压。Visser等[8]研究表明肥胖患者血液中的炎症标记物CRP明显升高。研究结果表明,分化成熟的3T3L1细胞加入IFN-γ诱导后,炎症分子IL-6、iNOS、MCP-1明显升高。IL-6在脂肪组织中高表达,与肥胖及胰岛素抵抗密切相关,IL-6可通过增加肝细胞SOCS3的表达介导胰岛素抵抗[9]。MCP-1(CCL2)在脂肪炎症及胰岛素抵抗中的作用尚不清楚,Kanda等[10]研究发现在肥胖状态MCP-1与巨噬细胞浸润入脂肪组织,胰岛素抵抗及非酒精性肝硬化有关。MCP-1诱导蛋白导致3T3L1细胞活性氧/氮自由基(ROS/RNS)、内质网应激(ER)及iNOS的增加。
DHA具有抗炎的作用,但其作用机制不清楚。DHA通过抑制多不饱和脂肪酸代谢限速酶基因FADS1,减少非酒精性脂肪肝的炎症、纤维化及氧化应激[11-12]。Oh等[5]研究证实DHA可以通过抑制巨噬细胞的G蛋白耦联受体-120减小炎症及胰岛素抵抗。本研究发现DHA可以抑制IFN-γ诱导的脂肪细胞炎症因子IL-6、iNOS的表达,脂肪细胞炎症因子表达的减少有利于改善外周的胰岛素抵抗。本研究中DHA对脂肪细胞MCP-1的表达无明显影响。亦有研究表明 MCP-1基因缺陷的小鼠中脂肪细胞的炎症反应无明显改变[13]。
IFN-γ诱导脂肪细胞MHCⅡ表达上调,脂肪细胞可作为一种抗原提呈细胞活化T细胞,T细胞活化后可促使巨噬细胞M1化,分泌多种促炎因子,导致胰岛素抵抗[14]。CIITA作为转录激活因子调控 MHCⅡ的表达。Gyllenberg等[14]研究发现与年龄相关的CIITA等位基因频率变化与1型糖尿病相关。本研究表明DHA能降低IFN-γ诱导的MHCⅡ相关基因Ciita、H2Ab1的表达。MHCⅡ相关基因表达的下调可以减少脂肪炎症反应,因此,作者推测DHA是否通过抑制IFN-γ诱导脂肪细胞MHCⅡ表达的下调从而减少脂肪细胞的炎症反应。
DHA具有明显的抗氧化及抗炎作用,它对脂肪细胞的炎症及MHCⅡ相关基因的表达有明显的作用,通过减少脂肪细胞的炎症从而改善胰岛素抵抗,在与肥胖相关的代谢性疾病中有积极的作用,但未来需进一步阐明其作用机制。
[1]Kahn BB,Flier JS.Obesity and insulin resistance[J].J Clin Invest,2000,106(4):473-481.
[2]Finkelstein EA,Khavjou OA,Thompson H,et al.Obesity and severe obesity forecasts through 2030[J].Am J Prev Med,2012,42(6):563-570.
[3]Ouchi N,Parker JL,Lugus JJ,et al.Adipokines in inflammation and metabolic disease[J].Nat Rev Immunol,2011,11(2):85-97.
[4]Deng T,Lyon CJ,Minze LJ,et al.ClassⅡ major histocompatibility complex plays an essential role in obesity-induced adipose inflammation[J].Cell Metab,2013,17(3):411-422.
[5]Oh DY,Talukdar S,Bae EJ,et al.GPR120is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizingeffects[J].Cell,2010,142(5):687-698.
[6]Ouchi N,Kihara S,Funahashi T,et al.Obesity,adiponectin and vascular inflammatory disease[J].Curr Opin Lipidol,2003,14(6):561-566.
[7]Berg AH,Scherer PE.Adipose tissue,inflammation,and cardiovascular disease[J].Circ Res,2005,96(9):939-949.
[8]Visser M,Bouter LM,McQuillan GM,et al.Elevated C-reactive protein levels in overweight and obese adults[J].JAMA,2009,282(22):2131-2135.
[9]Senn JJ,Klover PJ,Nowak IA,et al.Suppressor of cytokine signaling-3 (SOCS-3),apotential mediator of interleukin-6-dependent insulin resistance in hepatocytes[J].J Biol Chem,2003,278(16):13740-13746.
[10]Kanda H,Tateya S,Tamori Y,et al.MCP-1contributes to macrophage infiltration into adipose tissue,insulin resistance,and hepatic steatosis in obesity[J].J Clin Invest,2006,116(6):1494-1505.
[11]Younce C,Kolattukudy P.MCP-1induced protein promotes adipogenesis via oxidative stress,endoplasmic reticulum stress and autophagy[J].Cell Physiol Biochem,2012,30(2):307-320.
[12]Depner CM,Philbrick KA,Jump DB.Docosahexaenoic acid attenuates hepatic inflammation,oxidative stress,and fibrosis without decreasing hepatosteatosis in a Ldlr(-/-)mouse model of western diet-induced nonalcoholic steatohepatitis[J].J Nutr,2013,143(3):315-323.
[13]Kirk EA,Sagawa ZK,McDonald TO,et al.Monocyte chemoattractant protein deficiency fails to restrain macrophage infiltration into adipose tissue[J].Diabetes,2008,57(5):1254-1261.
[14]Gyllenberg A,Asad S,Piehl F,et al.Age-dependent variation of genotypes in MHCⅡtransactivator gene(CⅡTA)in controls and association totype 1diabetes[J].Genes Immun,2012,13(8):632-640.

