糖基因ST8SIA4在人慢性粒细胞白血病多药耐药中的作用研究
张兆海,张瑞红
(1.辽宁省本溪市金山医院检验科 117000;2.辽宁省本溪钢铁集团总医院手术室 117000)
人慢性粒细胞白血病(chronic myeloid leukemia,CML)是一种骨髓异常增生的恶性肿瘤,由于供体来源少、移植死亡率高、失败率高,移植治疗的应用受到了限制,故在临床上化疗成为了CML治疗的首选方法[1]。然而临床数据显示,大多的CML患者对化疗药物都有一定的耐药性,阻碍了对CML的治疗[2]。现在已有资料显示,肿瘤耐药细胞表面糖链结构及表达都存在差异,而糖基化广泛存在于各种生理过程中[3],N-糖基化修饰、糖基因(glycogene)的改变均与白血病多药耐药具有相关性[4]。唾液酸又名N-乙酰基神经氨酸,唾液酸作为机体内重要的信息传递分子,可参与细胞表面糖蛋白和糖脂的唾液酸化修饰,在细胞黏附、抗原识别和信号传导等过程中发挥着重要的作用。有研究报道,ST8SIA1在儿童急性淋巴细胞白血病中呈低表达[5]。人急性髓性白血病(AML)多药耐药与ST8SIA4的特征性改变具有相关性[6]。另外,唾液酸在细胞膜上的表达还与肿瘤的浸润和转移有密切的联系[7-8]。因此,本实验旨在探讨ST8SIA家族与CML多药耐药的相关性及其可能的机制,从而为诊断CML多药耐药提供新的检测标志物,为逆转CML多药耐药提供新策略。
1 材料与方法
1.1 主要材料及试剂 CML细胞株KCL22,购自凯基公司(中国南京)。裸鼠(雄性,4周龄,体质量17~23g,清洁级),胎牛血清、RPMI-1640培养基、青霉素、链霉素(均由GIBCO公司提供),胰酶(Sigma公司)、Trizol(Invitrogen公司)、RT-PCR试剂盒、PCR试剂盒(TaKaRa公司)、PCR引物(大连宝生物公司)、ECL试剂盒(Amersham Biosciences公司)、PVDF膜(Pall公司)、兔抗小鼠多克隆抗体、辣根酶标记羊抗兔抗体(均由Santa公司提供)、其他试剂国产分析纯化。
1.2 方法
1.2.1 细胞培养 KCL22细胞在含灭活的10%胎牛血清,1%双抗(青霉素100μg/mL,链霉素100μg/mL)的 RPMI-1640培养基中,于37℃,含5%CO2的孵箱中培养。采用体外低浓度梯度递增联合大剂量间断冲击方法诱导KCL22细胞对阿霉素(ADR)的耐药。实验前1周,KCL22/ADR细胞应在无ADR的培养基中培养,且使细胞的活力大于90%。所有实验均在细胞处于对数生长期进行。
1.2.2 患者标本 收集2012年7月至2014年6月来自本溪市金山医院和本溪钢铁集团总医院就诊的28例CML患者,其中,男17例,女9例,年龄19~68岁,中位年龄45岁。经入院检测,其中,11例为CML非耐药(P-gp检测为阴性,CML/-)患者,17例为 CML耐药(P-gp检测为阳性,CML/+)患者。所有的患者外周血标本应在未接受任何治疗前采集,并用人淋巴细胞分离液,分离外周血单个核细胞,分离出的细胞保存于-80℃备用。
1.2.3 RNA提取和RT-PCR 常规Trizol法提取各标本的总RNA,紫外分光光度计测定吸光度(A)260和A280,以检测RNA含量和纯度,并置于-70℃保存。取相同质量的RNA作为模板,以20μL反转录体系,按照反转录试剂盒提供的说明书进行操作。将反转录得到的cDNA按照TaKaRa RTPCR试剂盒说明构建25μL反应体系,置于荧光定量PCR仪中40个循环,同时扩增管家基因GAPDH作为对照。根据比较Ct值 法 公 式 2-ΔΔCt,其 中,ΔΔCt= 实 验 组 (Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因),获得不同组间相关基因表达比值。所用到的引物见表1。

表1 RT-PCR扩增6种目的基因及GAPDH的引物序列
1.2.4 Western blot分析 用2×电泳缓冲液裂解细胞,离心取上清,蛋白浓度由BCA法检测。煮沸变性的蛋白以每孔40μg的含量点样,经浓缩胶为6%、分离胶为10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。通过电转仪将凝胶上的蛋白样品移至PVDF膜上,37℃5%脱脂奶粉封闭2h。分别与1∶200兔抗小鼠ST8SIA家族抗体、GAPDH多克隆抗体4℃孵育过夜。以TTBS洗膜3次,每次10min。然后加HRP标记的羊抗兔IgG(1∶3 000稀释)37℃孵育1 h,随后以TTBS洗膜3次,每次10min。ECL发光试剂盒检测结果。
1.2.5 RNA干扰分析 取1mL(约1×104个)对数期生长的KCL22或KCL22/ADR细胞悬液于24孔板中,在37℃,含5%CO2孵箱中培养1~2d使细胞达到60%~80%的汇合度。取100μL无血清的RPMI-1640培养液与1μg带shRNA的质粒混匀,再加入2μL TurboFect转染试剂混匀,最后取100μL该混合液加入孔板中,轻轻混匀,置于37℃孵箱中培养24~48h。待转染完成之后,收集细胞,RT-PCR、Western blot分析检测干扰效果。
1.2.6 体外药敏实验 采用MTT法检测白血病细胞对抗肿瘤药物的敏感性。取对数生长期细胞(1×104个)接种于96孔培养板中,置于37℃、5%CO2培养箱中培养24h。分别加入不同浓度梯度的抗肿瘤药物阿霉素、长春新碱和紫杉醇继续培养72h。各孔再加入5mg/mL的 MTT 20μL,37℃、5%CO2培养箱中培养4h。各孔再加入100μL三联裂解液终止培养,过夜。应用酶标仪于570nm波长处测定各孔光密度(OD)值。计算IC50值,即抗肿瘤药物的半数抑制浓度。实验中设阴性对照孔(不加抗肿瘤药物)和调零孔(只加细胞培养液和抗肿瘤药物,不加细胞)。
1.2.7 体内药敏实验 细胞培养后分为6组:KCL22、KCL22/ADR、KCL22-control shRNA、KCL22/ADR-control shRNA、KCL22/ADR-ST8SIA4shRNA、KCL22-ST8SIA6 shRNA组,然后从腋窝下注射癌细胞培养液(细胞数约1×107),待瘤块直径达5mm×5mm时开始给予ADR抗肿瘤治疗。空白对照组每隔3d腹腔注射生理盐水,ADR治疗组每隔3d腹腔注射ADR(4mg/kg)。观察3周,杀鼠取瘤体量体积。
1.2.8 免疫组织化学实验 采用SP法进行免疫组织化学法染色,经过不同处理的小鼠处死后瘤体固定于10%多聚甲醛24h以上,随后浸蜡、包埋和切片。固定好的瘤体经二甲苯和不同梯度乙醇脱蜡水化,用柠檬酸缓冲液进行高压抗原修复,3%过氧化氢阻断过氧化物酶,PBS洗3次,滴加封闭液进行封闭。一抗按1∶50~1∶100比例稀释,孵育2h。将生物素化鼠抗兔IgG二抗滴加于组织切片上,37℃孵育1h,PBS洗3次,DAB显色,随后苏木精复染核,梯度乙醇常规脱水,二甲苯透明,中性树胶封片。显微镜下观察细胞核或细胞质出现棕黄色染色颗粒即为阳性结果。在400倍视野下计数3个视野的阳性细胞数,取其平均值。
1.3 统计学处理 所采用SPSS13.0软件进行统计分析。每一项实验至少有3次结果。数值用x±s表示,采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 ST8SIA4在CML中的差异表达 RT-PCR结果显示,在KCL22/ADR细胞中,ST8SIA4的表达量较KCL22细胞显著增加,约为5.2倍(图1A)。Western blot分析进一步验证了蛋白表达水平同样的趋势(图1B)。
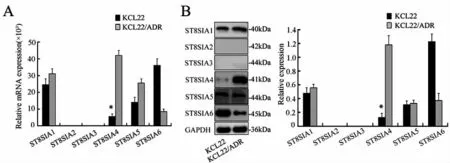
图1 ST8SIA4在KCL22和KCL22/ADR细胞中的差异表达
通过对28例临床患者PBMC分析,ST8SIA2、ST8SIA3几乎不表达;ST8SIA1和ST8SIA5有较高的表达量,但耐药与非耐药患者间比较差异无统计学意义(P>0.05);而ST8SIA4的表达在耐药与非耐药标本间比较差异有统计学意义(P<0.05),见表2。
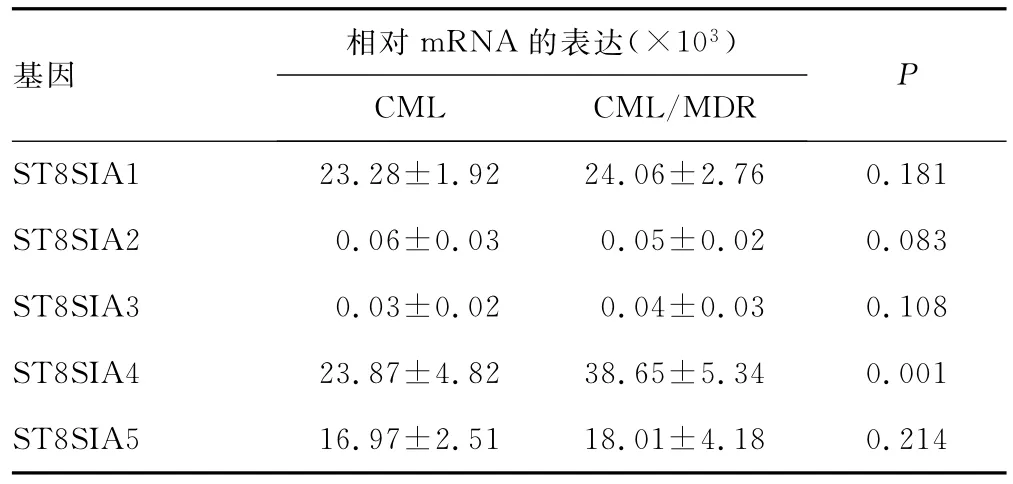
表2 ST8SIA4在CML患者标本中的表达水平比较(x±s)
2.2 特异性下调ST8SIA4表达对KCL22/ADR细胞耐药性的影响 与 KCL22/ADR 细胞及 KCL22/ADR-control shRNA细胞相比,干扰ST8SIA4后的KCL22/ADR细胞株在mRNA和蛋白水平上表达均显著降低,见图2。
进一步验证下调ST8SIA4对KCL22/ADR细胞抗肿瘤药物化学敏感性的影响,体外药敏实验结果显示(图3A),作用于KCL22/ADR-ST8SIA4shRNA1细胞的抗肿瘤药物的IC50值明显低于KCL22/ADR-control shRNA细胞的IC50值。体内药敏实验显示(图3B),干扰ST8SIA4后,KCL22/ADR细胞平均瘤体积减小。免疫组织化学结果显示,干扰后的KCL22/ADR细胞的ST8SIA4的阳性表达率明显下降(图3C)。
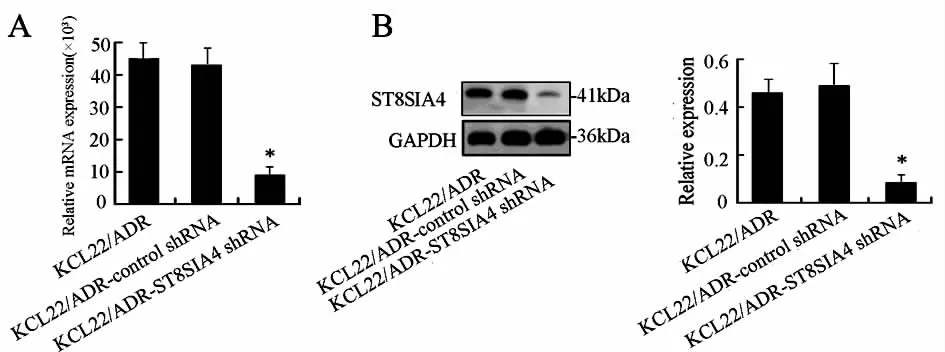
图2 特异性下调ST8SIA4在KCL22/ADR细胞中的表达
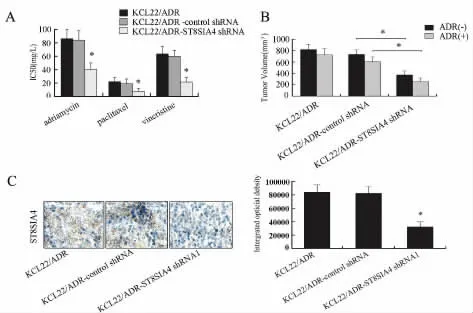
图3 特异性下调ST8SIA4表达对KCL22/ADR细胞耐药性的影响
3 讨 论
白血病是一类常见的严重危害人类健康的造血系统恶性肿瘤[9]。化疗是白血病治疗必不可少的手段之一,白血病细胞对化疗药物的敏感性是决定化疗的关键,寻找新的治疗白血病耐药细胞株的靶点,对白血病的治疗具有重要意义[10]。白血病细胞常对临床上传统使用的多种化疗药物呈现出其内源性或获得性的药物耐受性,即多药耐药性(multidrug resistance,MDR),也是目前白血病治疗中最大的难题[11]。本研究糖基因ST8SIA4在CML耐药与非耐药患者标本间,以及CML细胞株KCL22与KCL22/ADR间mRNA和蛋白的表达差异,探讨糖基因ST8SIA4介导白血病多药耐药的可能机制。结果表明糖基因ST8SIA4在耐药患者中mRNA表达水平明显高于非耐药患者;下调糖基因ST8SIA4表达水平增加了KCL22/ADR细胞体内、体外对肿瘤药物的敏感性,减小平均肿瘤体积。糖基因是一组编码糖基转移酶、糖苷酶等糖类相关的基因[12]。唾液酸转移酶是糖基转移酶中的一类,唾液酸作为识别位点,参与细胞识别及信息传递,其表达调控还与肿瘤细胞的多药耐药性密切相关[13]。在各类型肿瘤的治疗过程中,异常表达的唾液酸化的糖复合物通常作为潜在的治疗靶点,肿瘤细胞膜上唾液酸化的糖复合物的异常表达通常导致恶性肿瘤细胞特性的改变[14]。而唾液酸糖基转移酶是催化唾液酸化的糖复合物合成必不可少的因素之一。在近期的报道中,ST8SIA4蛋白的高表达在肿瘤的发生、发展过程中也有很大的作用,在急性粒细胞白血病细胞株及其耐ADR细胞株中,ST8SIA4的表达量具有显著差异[15]。尽管临床上对CML患者的化疗已有明显的改善和提高,但肿瘤细胞的多药耐药仍然是一个重大挑战。本研究进一步证实ST8SIA4在CML及其耐药患者PBMC中的差异表达。因此,差异表达的ST8SIA4基因可成为潜在的CML耐药标志物,从而为寻求逆转药物提供新策略和靶点。
[1]Liu J,Gao L,Zhang X,et al.Clinical efficiency of allogenic hematopoietic stem cell transplantation combined with imatinibin treatment of Philadelphia positive acute lymphoblastic leukemia[J].J Third Mil Med Univ,2012,34(24):2453-2455.
[2]房丽君,涂怀军,李剑.MSC通CXCL12/CXCR4轴介导CML细胞对TKI耐药的研究进展[J].中国实验血液学杂志2015,23(4):1221-1224.
[3]邴振,卢愿,孙立荣,等.异常糖链糖蛋白在肿瘤发生发展中的作用及检测进展[J].齐鲁医学杂志,2015,30(2):245-252.
[4]苗小艳,马红叶,张旭,等.N-糖基化修饰在髓性白血病耐药中的作用[J].中国微生态学杂志,2014,26(5):506-510.
[5]Mondal S,Chandra S,Mandal C.Elevated mRNA level of hST6Gal I and hST3Gal V positively correlates with the high risk of pediatric acute leukemia[J].Leuk Res,2010,34(4):463-470.
[6]苗小艳,魏巍,杨光,等.唾液酸糖基转移酶ST8SIA4对NB4/ADR细胞耐药性的影响[J].中国微生态学杂志,2015,27(7):761-765.
[7]Schultz MJ,Swindall AF,Bellis SL.Regulation of the metastatic cell phenotype by sialylated glycans[J].Cancer Metastasis Rev,2012,31(3-4):501-518.
[8]Miyagi T,Wada T,Yamaguchi K,et al.Sialidase and malignancy:a minireview[J].Glycoconj J,2004,20(3):189-198.
[9]Deschler B,Luebbert M.Acute myeloid leukemia:Epidemiology and etiology[J].Cancer,2006,107(9):2099-2107.
[10]莫建华,吴士良,陈克平,等.不同白血病细胞N-乙酰氨基半乳糖转移酶Ⅰ-ⅦmRNA的表达[J].中国血液流变学杂志,2004,14(2):173-174,177.
[11]Druker BJ,Guilhot F,O′brien SG,et al.Five-year followup of patients receiving imatinib for chronic myeloid leukemia[J].N Engl J Med,2006,355(23):2408-2417.
[12]Narimatsu H.Construction of a human glycogene library and comprehensive functional analysis[J].Glycoconj J,2004,21(1/2):17-24.
[13]Schauer R.Sialic acids:fascinating sugars in higher animals and man[J].Zoology(Jena),2004,107(1):49-64.
[14]Zhu Y,Srivatana U,Ullah A,et al.Suppression of a sialyltransferase by antisense DNA reduces invasiveness of human colon cancer cells in vitro[J].Biochim Biophys Acta,2001,1536(2/3):148-160.
[15]Ma H,Zhou H,Song X,et al.Modification of sialylation is associated with multidrug resistance in human acute myeloid leukemia[J].Oncogene,2015,34(6):726-740.

