高脂高果糖饮食与维生素D缺乏对小鼠牙龈菌群影响的实验研究*
杨 宓,柏 雪
(四川省成都市第四人民医院口腔科 610036)
牙周病是一种微生物感染性疾病,致病性微生物是引发牙周病必不可少的始动因素,人群发病率高达90%以上[1]。饮食偏好会导致其牙周菌群的改变,进而影响宿主的牙周健康,如大量临床调查或动物实验数据表明高脂高糖饮食导致牙周疾病的发生[2-4]。有研究表明,维生素D缺乏可能是牙周疾病产生的重要促进因素[5]。中国约50%的人群缺少维生素D,对牙周健康具有较大的潜在风险。既往研究多着眼于高脂高糖饮食与维生素D缺乏分别独立作用下的牙周病变;而关于在二者即双因素共同作用下牙周炎罹患情况的相关研究则未见报道。本实验采用维生素D受体缺失的小鼠,通过建立高脂高果糖饮食动物实验模型,运用PCR-变形梯度凝胶电泳技术(PCR-DGGE)对龈沟液中的菌群进行多样性分析,探究两种因素对牙周炎致病菌群的影响,并进一步探讨牙周病致病相关因素。
1 材料与方法
1.1 主要材料 雄性4周龄C57BL/6J野生型小鼠20只,雄性4周龄维生素D受体基因敲出C57BL/6J野生型小鼠20只,由四川大学实验动物中心提供。分别将正常型和基因敲出型小鼠各自随机分为两组(每组10只),给予不同饮食喂养。实验分成如下4组:正常型正常饮食组(N组)、正常型高脂高果糖饮食组(H组)、维生素D受体缺失的正常饮食组(DN组)、维生素D受体缺失的高脂高果糖饮食组(DH组)。PCR扩增仪、凝胶成像仪(Bio-RAD公司,美国),DYY-6C型电泳仪(北京六一仪器厂),PCR缓冲体系(由上海生工生物工程有限公司提供)。
1.2 牙龈沟液采集方法 按照分组的饮食条件喂养10周[6]。采样前饥饿12h,0.1%戊巴比妥钠(50mg/kg,国药集团化学试剂有限公司)麻醉后,用whatman 1号滤纸提取小鼠下颌第2磨牙龈沟液。定量后用生理盐水溶解,-80℃保存。
1.3 DNA提取 样本室温解冻,加入0.5mL裂解缓冲液(50mmol/L Tris,20mmol/L EDTA,50mmol/L NaCl溶液,pH 8.0),加入溶菌酶至浓度10mg/mL。37℃水浴10min,然后加入十二烷基硫酸钠(SDS)至1%(质量/体积),加入蛋白酶K至0.1mg/mL,37℃水浴30min。利用酚∶氯仿∶异戊醇(25∶24∶1)提取,然后用2倍体积无水乙醇沉淀DNA,最后用不含DNase的RNase去除RNA,DNA样品用于PCR扩增。
1.4 PCR扩增 PCR引物:细菌微生物属种的变化使用16 Sr RNA V3作为扩增引物:5′-ATT ACC GCG GCT GCT GG-3′;下游引物:5′-GC clamp*-TAC GGG AGG CAG CAG-3′[7](上海生工生物工程有限公司合成)。PCR反应体系:DNA模板0.005mL,上下游引物(0.01mmol/L)各0.000 5mL,10×缓冲液(不含 MgCl2)0.002 5mL,MgCl2(2.5mmol/L)0.002 mL,10mmol/L脱氧核糖核苷三磷酸0.000 5mL,1UL 的TaqDNA聚合酶(上海生工生物工程有限公司),无菌三蒸水补足总体积至0.025mL。PCR反应条件:预变性95℃5 min,变性94℃30s,退火55℃60s,延伸72℃90s,共30个循环,循环结束后,72℃延伸10min,4℃保存。
1.5 DGGE分析 采用80g/L的聚丙烯酰胺凝胶,20%~70%的变性梯度(100%变性梯度包含体积分数40%的甲酰胺和7mol尿素)。在220V电压预电泳10min,接着85V电压电泳16h,之后用硝酸银染色[8]。采用Quantity One软件对凝胶做相似性分析,计算条带光密度值,然后对H组和DH组中有明显优势的条带,回收、克隆纯化、测序,用GenBank中的Blast分析优势菌群。
1.6 统计学处理 采用SPSS19.0统计软件分析采集的数据。所有数据以x±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 牙周临床指标 N组、DN组小鼠牙龈偶见红肿现象。H组小鼠大部分牙龈增厚发红。DH组小鼠牙龈则呈现暗红色,冠周出现组织坏死且探诊出血。H组、DH组小鼠牙龈指数、牙周袋深度方面与N组比较差异均有统计学意义(P<0.05),且有不同程度松动,见表1。

表1 喂养10周后4组小鼠牙周临床指标比较(x±s)
2.2 PCR-DGGE牙周菌群多样性分析 同组中小鼠的条带数量和分布有较好的一致性,而不同组小鼠之间的条带数量和分布差异性明显,尤其是维生素D缺乏的2个小组(图1)。通过UMPGA相似聚类分析表明,各组内相似性很高,但各组之间相似性较小(图2)。DGGE图谱显示,维生素D缺乏的DH组、DN组与维生素D不缺乏的N组、H组在丰富度和多样性指数方面比较,差异有统计学意义(P<0.05),见表2。

图1 DGGE图谱

图2 UMPGA相似聚类分析
横坐标为相似百分比,纵坐标为条带序列号。
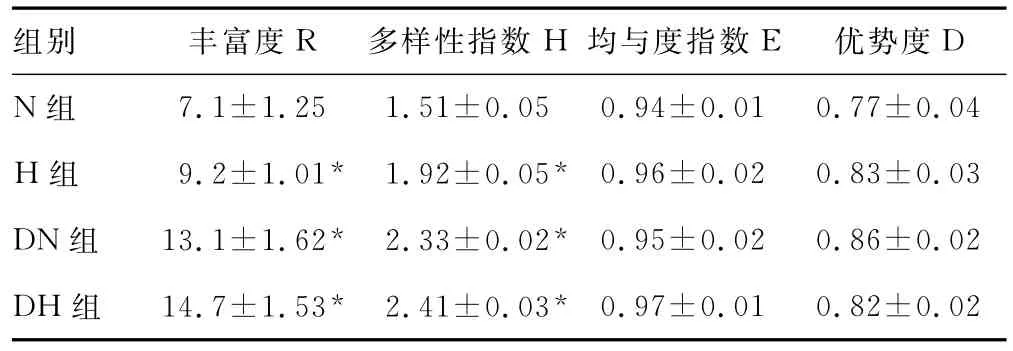
表2 DGGE图谱多样性分析(x±s)

表3 优势菌序列分析结果
2.3 测序结果 选择有肉眼可见病变的H组和DH组开展优势菌分析。条带如图1中的箭头标示。经过BLAST测序分析,结果见表3,H组中条带1与福赛斯坦纳菌属有99%的同源性;条带2与牙卟啉单胞菌属有99%的同源性;条带3与中间普雷沃菌属有99%的同源性。DH组中条带4与放线共生放线杆菌属具有99%的同源性;条带5与牙卟啉单胞菌属有99%的同源性;条带6与脆弱拟杆菌属有99%的同源性;条带7中间普雷沃菌属具有99%的同源性。
3 讨 论
研究表明高脂高糖饮食诱导的代谢紊乱可导致个体牙周疾病发生[2,9],而维生素D的缺乏是否也是牙周炎发生的促进因素尚存争议[5]。现有文献均着重于二者作为独立因素作用的结果,为进一步研究维生素D缺乏及二者共力与牙周疾病的关系[2],本实验建立了高脂高果糖饮食以及缺乏维生素D受体的动物实验模型,检测了小鼠的牙周组织临床指标、龈沟液菌群的差异性等。实验结果表明,牙周临床指标的数据显示正常饮食的N组和DN组小鼠偶见牙龈红肿的现象,高脂高果糖饮食的H组与DH组小鼠牙龈有明显炎症,且牙龈指数、牙周袋深度均显著高于正常饮食组。表明高脂高糖饮食可以促进牙周病的发生,与 Blasco-Baque等[2]和 Amano等[5]研究结果一致;DH组小鼠牙龈指数、牙周袋深度及活动度均显著高于其他组,提示在高脂高果糖饮食和缺少维生素D的双重作用下,可能更易罹患牙周病。本实验结果显示DN组小鼠无明显炎性反应,提示在维生素D缺乏的单一条件下,正常饮食喂养不一定会引起牙周病。
DGGE多样性分析显示,H组、DN组、DH组小鼠的丰富度和多样性指数显著高于N组小鼠,说明其他3组小鼠龈下菌群有明显增加。与之相一致的是,H组和DH组小鼠有肉眼可见的明显炎症,提示高脂高糖的饮食无论作为独立因素还是合并维生素D缺乏因素,都可能致使口腔菌群变化,并促使了炎症形成[10-11]。在DN组,虽测及龈下菌群的增加,却没有发生相应的临床炎性表现。而以往有文献称长时间持续维生素D缺乏可促使牙周病产生[5],但本研究仅进行10周,有可能致病菌致病力不够或刺激时间尚短,因此未能在菌群增加的情况下致炎。
UMPGA聚类分析显示各组间有显著差异,这说明在高脂高糖饮食和维生素D缺乏无论作为独立还是合并刺激因素,都可导致龈下菌群种类和数量的变化[10];但组内相似性较高,说明外环境因素(如温度、湿度等饲养条件)对实验结果基本无影响。测序结果显示H组和DH组均检测出优势中间普雷沃菌和牙卟啉单胞菌,提示高脂高糖饮食可能为这两种菌生长提供有利内环境,从而促进了牙周炎的形成;但二者是共同还是独立致病需进一步验证。此外,在DH组查及放线共生放线杆菌、脆弱拟杆菌等牙周可疑致病菌[12-14],其中放线共生放线杆菌致病能力较强,协调前两种菌的共同作用也可部分解释DH组临床症状更为严重的原因。因此,本实验通过研究龈沟液中细菌种群和数量的变化,认为维生素D缺乏对高脂高糖所致牙周炎的发展有正协同作用,进而提示在牙周病的临床防治过程中,除要求患者少食高脂高糖食物外,还可适量补充维生素D[15]。
[1]Hajishengallis G.Periodontitis:from microbial immune subversion to systemic inflammation[J].Nat Rev Immunol,2015,15(1):30-44.
[2]Blasco-Baque V,Serino M,Vergnes JN,et al.High-fat diet induces periodontitis in mice through lipopolysaccharides(LPS)receptor signaling:protective action of estrogens[J].PLoS One,2012,7(11):e48220.
[3]Amar S,Zhou Q,Shaik-Dasthagirisaheb Y,et al.Diet-induced obesity in mice causes changes in immune responses and bone loss manifested by bacterial challenge[J].Proc Natl Acad Sci USA,2007,104(51):20466-20471.
[4]Fentoglu O,Bozkurt FY.The Bi-birectional relationship between periodontal disease and hyperlipidemia[J].Eur J Dent,2008,2(2):142-146.
[5]Amano Y,Komiyama K,Makishima M.Vitamin D and periodontal disease[J].J Oral Sci,2009,51(1):11-20.
[6]Oz HS,Puleo DA.Animal models for periodontal disease[J].J Biomed Biotechnol,2011:754857.
[7]Muyzer G,De Waal EC,Uitterlinden AG.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16SrRNA[J].Appl Environ Microbiol,1993,59(3):695-700.
[8]Xiao X,Li Y,Zhang G,et al.Detection of bacterial diversity in rat′s periodontitis model under imitational altitude hypoxia environment[J].Arch Oral Biol,2012,57(1):23-29.
[9]Pihlstrom BL,Michalowicz BS,Johnson NW.Periodontal diseases[J].Lancet,2005,366(9499):1809-1820.
[10]Walker AW,Ince J,Duncan SH,et al.Dominant and dietresponsive groups of bacteria within the human colonic microbiota[J].ISME J,2011,5(2):220-230.
[11]Wang Q,Li H,Xie H,et al.25-Hydroxyvitamin D3attenuates experimental periodontitis through down regulation of TLR4and JAK1/STAT3signaling in diabetic mice[J].J Steroid Biochem Mol Biol,2013,135:43-50.
[12]Goodson JM,Groppo D,Halem S,et al.Is obesity an oral bacterial disease?[J].J Dent Res,2009,88(6):519-523.
[13]Kumar PS,Griffen AL,Moeschberger ML,et al.Identification of candidate periodontal pathogens and beneficial species by quantitative 16Sclonal analysis[J].J Clin Microbiol,2005,43(8):3944-3955.
[14]Socransky SS,Haffajee AD,Cugini MA,et al.Microbial complexes in subgingival plaque[J].J Clin Periodontol,1998,25(2):134-144.
[15]Iacopino AM.Periodontitis and diabetes interrelationships:role of inflammation[J].Ann Periodontol,2001,6(1):125-137.

