缺氧对人牙周膜细胞OPG和RANKL基因表达的影响*
任嫒姝,付 钢 ,邱 雨,何 科
(重庆医科大学附属口腔医院:1.正畸科;2.口腔疾病与生物医学重庆市重点实验室;3.VIP中心 400015)
正畸力作用下牙周组织的改建是正畸治疗的生物学基础。牙周组织如何将机械刺激转化为组织的生化反应,何种控制因子在机械应力促发细胞反应的过程中发挥了关键的作用,目前的研究还没有完全明了。在正畸力作用下压力侧牙周膜发生血管受压、管壁断裂等血管反应,导致血供减少,形成了缺氧的微环境。有学者推测,氧分压的改变可能是牙周组织改建中潜在的扳机点。牙周膜细胞(periodontal ligament cells)是牙周组织中最主要的细胞成分,有研究表明,应力刺激可以调节其骨保护素(osteoprotegerin,OPG)、核因子κb受体活化因子配体(receptor activator for nuclear factor-κb ligand,RANKL)等破骨细胞分化调控蛋白的表达[1-4],影响牙槽骨吸收进程,而缺氧环境是否能改变该细胞OPG、RANKL的表达,在国内外少见报道。本实验通过检测缺氧条件下体外培养的人牙周膜细胞(human periodontal ligament cells)OPG、RANKL mRNA 表达的变化,为揭示缺氧在正畸牙移动压力侧骨吸收中的作用提供实验依据。
1 资料与方法
1.1 一般资料 选取11~14岁因正畸拔除的健康前磨牙,用加有双抗(100U/mL青霉素,100μg/mL链霉素)的PBS缓冲液冲洗3次,去除残留血迹及附着的牙龈软组织,1mg/mLⅠ型胶原酶(Gibco)消化37℃,1h,吸取消化液,离心,去上清液,将牙周膜碎片均匀放置于培养瓶底,加入含10%FBS(Gibco公司)的DMEM(Gibco公司)培养基,置于CO2培养箱(37℃,5%CO2,95%空气)中培养4h,待组织块贴壁后翻转培养瓶继续培养。当原代细胞生长到覆盖培养瓶底80%时,去除组织碎片,使用0.1%EDTA、0.25%胰酶(Sigma公司)消化收集细胞,传代培养。取3~5代人牙周膜细胞,将细胞接种于6孔板中,在CO2培养箱中培养48h后,将实验细胞置于三气培养箱中,O2浓度设定为2%(缺氧状态),对照组细胞仍置于CO2培养箱中,O2浓度为20%(常氧状态)。在培养3、6、12和24h后,采用倒置相差显微镜观察细胞形态。
1.2 方法 对培养结束后的细胞,用Trizol(Invitrogen公司)提取细胞总RNA,用RT-PCR试剂盒(Takara公司)将2μg总RNA逆转录为cDNA,取5μL cDNA进行PCR扩增。OPG的上游引物设计为:5′-TCA GTT TGT GGC GAA TAA-3′,下游引物设计为:5′-TTG GAC CTG GTT ACC TAT C-3′,片段长度为197bp;RANKL的上游引物设计为:5′-TGC CAA CAT TTG CTT TCG-3′,下游引物设计为:5′-CCT CCT TTC ATC AGG GTA T-3′,片段长度为126bp;β-actin的上游引物设计为:5′-CTC CAT CCT GGC CTC GCT GT-3′,下游引物设计为:5′-GCT GTC ACC TTC ACC GTT CC-3′,片段长度为268bp。将反应产物取5μL作1.5%琼脂糖凝胶电泳,运用Bio-Rad凝胶扫描及图像分析系统,采集OPG、RANKL和βactin条带灰度值,计算同次电泳所得 OPG/β-actin、RANKL/β-actin的比值,并计算RANKL/OPG的比值。各实验样本重复3次,取平均值。
1.3 统计学处理 采用SPSS15.0统计软件对数据进行分析处理,所有计量资料以x±s表示,组间比较行t检验,计数资料以率比较,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
缺氧(2%O2浓度)培养3、6、12和24h后,细胞贴壁生长情况和细胞形态与对照组比较无明显变化。由OPG的RTPCR产物电泳条带可见,缺氧环境可以抑制人牙周膜细胞的OPG基因表达,随着缺氧处理时间的延长,人牙周膜细胞的OPG基因表达水平逐渐降低(图1A)。电泳条带灰度值计算显示:缺氧培养3、6h后,人牙周膜细胞的OPG基因表达轻度减少,但与对照组比较差异无统计学意义(P>0.05),缺氧培养12h和24h后,人牙周膜细胞的OPG基因表达进一步减少,明显低于对照组(P<0.05),见图1C。由RANKL的RTPCR产物电泳条带可见,缺氧环境可以促进人牙周膜细胞的RANKL基因表达,随着缺氧处理时间的延长,人牙周膜细胞的RANKL基因表达水平逐渐升高(图1B)。电泳条带灰度值计算显示:缺氧培养3、6h后,人牙周膜细胞的RANKL基因表达轻度增加,但与对照组比较差异无统计学意义(P>0.05),缺氧培养12h和24h后,人牙周膜细胞的RANKL基因表达进一步增加,明显高于对照组(P<0.05),见图1C。
计算RANKL/OPG比值可见,缺氧环境可以升高人牙周膜细胞的RANKL/OPG比值,随着缺氧处理时间的延长,人牙周膜细胞的RANKL/OPG比值逐渐升高(图2)。缺氧培养3、6h后,人牙周膜细胞的RANKL/OPG比值轻度增加,但与对照组比较差异无统计学意义(P>0.05),缺氧培养12h和24h后,人牙周膜细胞的RANKL/OPG比值显著增加,明显高于对照组(P<0.05)。
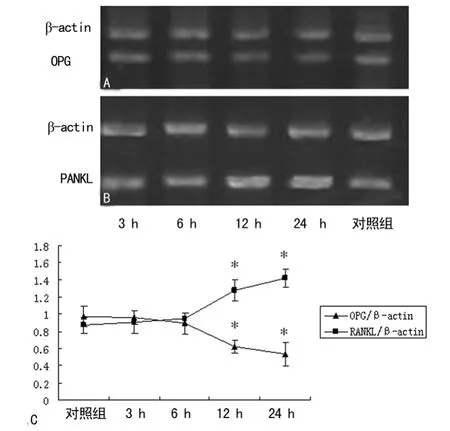
图1 缺氧对人牙周膜细胞OPG、RANKL基因表达的影响
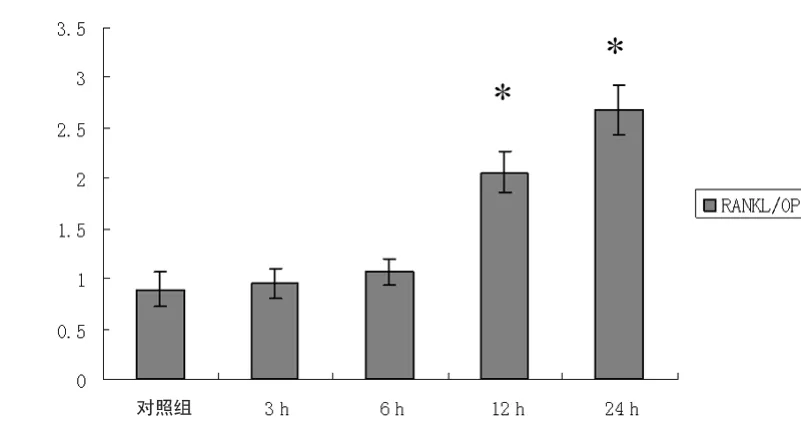
图2 缺氧对人牙周膜细胞RANKL/OPG比值的影响
3 讨 论
正畸力作用下牙周组织的改建是正畸治疗的生物学基础。其中,牙槽骨的改建是牙周组织改建的中心环节,由成骨细胞介导的骨形成以及破骨细胞介导的骨吸收是骨改建的2个基本过程。牙周膜细胞是牙周组织中最主要的细胞成分,有研究表明,牙周膜细胞在受到应力刺激后,可以向成骨细胞分化[5]。另外,牙周膜细胞也可表达与破骨细胞相关的各种调控蛋白[6],由此可见,牙周膜细胞在牙槽骨的改建中有着不可忽视的作用。
氧是生命活动所必需的环境因素,其浓度对机体细胞、组织的功能活动具有重要影响。在正畸力作用下压力侧牙周膜发生血管受压、管壁断裂等血管反应,导致血供减少,形成了缺氧的微环境。近年来,学者们对牙周膜细胞在缺氧刺激下的生物学效应及相关机制进行了较多研究。Motohira等[7]对缺氧环境下牙周膜细胞骨吸收相关蛋白的表达进行了研究,发现缺氧促进牙周膜细胞 VEGF、IL-6、IL-1β基因和蛋白的表达。Amemiya等[8]对缺氧环境下牙周膜细胞成骨能力进行了研究,发现缺氧可以上调牙周膜细胞ALP、BSP、VEGF等mRNA的表达。侯超等[9]研究发现缺氧可以上调人牙周膜细胞HIF-1α蛋白表达水平,同时促进VEGF基因和蛋白的表达。Chae等[10]研究发现缺氧可以促进牙周膜细胞IL-1β、IL-6、IL-8和VEGF的mRNA表达,并且缺氧与机械压应力对牙周膜细胞基因表达的调节有协同作用。Kitase等[11]利用基因芯片技术对缺氧条件下牙周膜细胞基因表达变化进行了研究,共发现11种基因表达发生显著性变化。
在多种破骨细胞分化调控蛋白中,RANKL被认为是介导破骨细胞分化、活化的关键因子[12-13]。它能刺激破骨细胞的分化、活化,抑制破骨细胞凋亡,而OPG则通过阻断RANKL的功能,抑制破骨细胞的分化和活化,诱导破骨细胞凋亡[14-15]。OPG与RANKL的比值决定破骨细胞的成熟及功能状态。应力刺激下,牙周膜细胞OPG和RANKL的表达变化已被较多文献证实[1-4],而在缺氧环境下,牙周膜细胞OPG和RANKL的表达变化,在国内外少见报道。
本实验中作者采用2%氧浓度作为实验条件,研究缺氧条件下人牙周膜细胞OPG、RANKL基因表达的变化。在缺氧对细胞增殖和功能影响的体外研究中,采用何种氧浓度最为合适,目前还没有定论。国内外学者使用较多的氧浓度常为5%、2%或1%。本实验中2%氧浓度处理24h后,细胞贴壁生长情况和细胞形态与对照组比较无明显变化,未出现细胞大面积脱落、坏死等现象,细胞缺氧处理模型建立成功。研究结果显示,2%O2浓度培养12h和24h后,人牙周膜细胞的OPG基因表达降低,而RANKL基因表达升高,RANKL/OPG的比值升高,说明缺氧环境可以促进牙周膜细胞介导的破骨细胞分化,这与有的研究者等[7,10]发现缺氧促进牙周膜细胞IL-6、IL-1β等骨吸收促进因子的表达所反映的规律一致,即缺氧可以促进牙周膜细胞表达破骨细胞分化调控蛋白,进而影响破骨细胞的成熟和功能状态,这与临床上观察到的正畸牙移动压力侧骨吸收的情况一致。正畸牙移动的骨机械化学学说认为,牙齿受力时局部牙周组织血氧张力会发生改变,张力侧血氧张力上升有利于成骨细胞分化,压力侧血氧张力下降可引起破骨细胞分化,本研究结果与该理论相符,由此推测氧分压的改变在正畸应力促发细胞反应的过程中发挥了重要的作用。在后续研究中,作者将进一步探讨不同氧浓度对牙周膜细胞OPG、RANKL表达的影响,以及缺氧影响OPG、RANKL表达的分子机制,以期更深入地揭示缺氧在正畸牙槽骨改建中的重要作用,为丰富正畸牙移动的理论提供实验基础。
[1] Kanzaki H,Chiba M,Shimizu Y,et al.Periodontal ligament cells under mechanical stress induce osteoclastogenesis by receptor activator of nuclear factor kappaB ligand up-regulation via prostaglandin E2synthesis[J].J Bone Miner Res,2002,17(2):210-220.
[2] Yang YQ,Li XT,Rabie AB,et al.Human periodontal ligament cells Express osteoblastic phenotypes under intermittent force loading in vitro[J].Front Biosci,2006,11:776-781.
[3] Yamamoto T,Kita M,Kimura I,et al.Mechanical stress induces expression of cytokines in human periodontal ligament cells[J].Oral Dis,2006,12(2):171-175.
[4] Tsuji K,Uno K,Zhang GX,et al.Periodontal ligament cells under intermittent tensile stress regulate mRNA expression of osteoprotegerin and tissue inhibitor of matrix metalloprotease-1and-2[J].J Bone Miner Metab,2004,22(2):94-103.
[5] 李小彤,张丁,傅民魁,等.机械牵张力对人牙周膜细胞成骨样细胞功能的影响[J].中华口腔医学杂志,2002,37(2):58-61,89.
[6] 王峰,林珠,李永明,等.机械力作用下人牙周膜细胞ODF及OCIF的表达及意义[J].实用口腔医学杂志,2005,21(1):85-87.
[7] Motohira H,Hayashi J,Tatsumi J,et al.Hypoxia and reoxygenation augment bone-resorbing factor production from human periodontal ligament cells[J].J Periodontol,2007,78(9):1803-1809.
[8] Amemiya H,Matsuzaka K,Kokubu E,et al.Cellular responses of rat periodontal ligament cells under hypoxia and re-oxygenation conditions in vitro[J].J Periodontal Res,2008,43(3):322-327.
[9] 侯超,唐开亮,杨丕山,等.乏氧对人牙周膜细胞 HIF-1α及 VEGF表达的影响[J].上海口腔医学,2010,19(3):329-334.
[10]Chae HS,Park HJ,Hwang HR,et al.The effect of antioxidants on the production of pro-inflammatory cytokines and orthodontic tooth movement[J].Mol Cells,2011,32(2):189-196.
[11]Kitase Y,Yokozeki M,Fujihara S,et al.Analysis of gene expression profiles in human periodontal ligament cells under hypoxia:the protective effect of CC chemokine ligand 2to Oxygen shortage[J].Arch Oral Biol,2009,54(7):618-624.
[12]Hofbauer LC,Khosla S,Dunstan CR,et al.The roles of osteoprotegerin and osteoprotegerin ligand in the paracrine regulation of bone resorption[J].J Bone Miner Res,2000,15(1):2-12.
[13]Theill LE,Boyle WJ,Penninger JM.RANK-L and RANK:T cells,bone loss,and mammalian evolution[J].Annu Rev Immunol,2002,20:795-823.
[14]Udagawa N,Takahashi N,Yasuda H,et al.Osteoprotegerin produced by osteoblasts is an important regulator in osteoclast development and function[J].Endocrinology,2000,141(9):3478-3484.
[15]Schoppet M,Preissner KT,Hofbauer LC.RANK ligand and osteoprotegerin:paracrine regulators of bone metabolism and vascular function[J].Arterioscler Thromb Vasc Biol,2002,22(4):549-553.

