培美曲塞和紫杉醇分别联合奥沙利铂用于非小细胞肺癌术后辅助化学治疗疗效比较*
太 祥,陈满军,洪文娟,洪志鹏
(昆明医科大学第一附属医院胸外科,昆明650032)
目前,肺癌是影响人类生存的恶性肿瘤之一,发病率逐年升高,成为恶性肿瘤中发病率第2、病死率第1的恶性肿瘤[1]。手术治疗Ⅰ~Ⅲa期肺癌已成为综合治疗的基石。然而,如何减轻手术后患者在化学治疗中的不良反应,提高患者对化学治疗药物的耐受性和生活质量,最大限度地使患者受益已经成为临床医师在诊疗活动中必须考虑的问题。本研究以2010年1月至2011年12月在本科治疗的86例非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)患者为研究对象,对接受培美曲塞联合奥沙利铂(培美曲塞联合组)与接受紫杉醇联合奥沙利铂(紫杉醇联合组)进行回顾性分析,旨在为临床医师对肿瘤术后患者选择个体化化学治疗方案提供依据。
1 资料与方法
1.1 一般资料 选取2010年1月至2011年12月在本科治疗的NSCLC患者86例为回顾性研究对象。入选标准:根据美国国立综合癌症网络(national comprehensive cancer network,NCCN)的肺癌诊疗指南诊断为原发性NSCLC;根据美国肿瘤联合会(AJCC)关于NSCLC的TNM分期法,肿瘤分期为Ⅰ~Ⅲa期;无手术禁忌,均行肺癌根治术;术后的病理学诊断为NSCLC;治疗前体力状况(PS)评分0~2分;均有化学治疗适应证,无化学治疗禁忌或不愿化学治疗的患者;患者对化学治疗方案知情同意并签署化学治疗知情同意书;治疗期间没有接受其他化学治疗。排除标准:妊娠期或哺乳期妇女,未控制及无自知力的脑转移者,合并不可控制的感染者,合并失代偿的心肺肝肾功能者,合并有未治愈的第2个原发肿瘤者。本研究经本院伦理委员会审核通过。
1.2 方法 符合标准的86例患者纳入回顾性分析,其中,培美曲塞联合组46例,紫杉醇联合组40例。进行电话随访末次随访时间截至2014年4月30日。定期复查(术后2年内每3个月复查1次,2年后每6个月复查1次),复查内容包括:复查胸部CT、血常规、肝功能等。按照美国国立癌症研究所(NCI)制定的毒性评价标准评价不良反应。所有患者均能耐受不良反应至治疗结束,无1例发生严重不良事件而死亡。两组患者基本资料的比较见表1。
1.3 统计学处理 采用SPSS17.0统计软件对数据进行分析处理。采用Kaplan-Meire方法进行生存分析。计数资料采用χ2检验比较两组患者治疗后的不良反应。经单因素分析选出有意义的变量作为自变量,并采用Cox模型进行预后的多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 主要研究终点 本研究86例患者在研究期限内存活30例(34.9%),其中,培美曲塞联合组17例,紫杉醇联合组13例。培美曲塞联合组和紫杉醇联合组中位总生存期(OS)分别为36.0个月和33.0个月,组间比较差异无统计学意义(χ2=0.648,P=0.421)。两组患者OS生存曲线见图1。
2.2 次要研究终点
2.2.1 无进展生存期(PFS) 培美曲塞联合组中位PFS为15.0个月;紫杉醇联合组中位PFS为15.0个月。组间比较差异无统计学意义(χ2=0.758,P=0.384)。两组患者的PFS生存曲线见图2。
2.2.2 不良反应比较 86例患者化学治疗期间不良反应,按NCI 3.0标准评价,Ⅲ度以上白细胞减少发生率培美曲塞联合组为34.8%(16例),紫杉醇联合组为60.0%(24例),组间比较差异有统计学意义(χ2=5.469,P=0.019);Ⅲ度谷丙转氨酶(ALT)升高发生率培美曲塞联合组为12.2%(5例),紫杉醇联合组为35.0%(14例),组间比较差异有统计学意义(χ2=7.238,P=0.007);Ⅲ度以上谷草转氨酶(AST)升高发生率培美曲塞联合组为13.0%(6例),紫杉醇联合组为32.5%(13例),组间比较差异有统计学意义(χ2=4.706,P=0.030);神经毒性发生率培美曲塞联合组为28.2%(13例),紫杉醇联合组为65.0%(26 例),组间比较差异有统计学意义(χ2=11.652,P=0.001);Ⅲ度以上消化道反应发生率培美曲塞联合组为47.8%(22例),紫杉醇联合组为57.5%(23例),组间比较差异无统计学意义(χ2=0.803,P=0.370)。
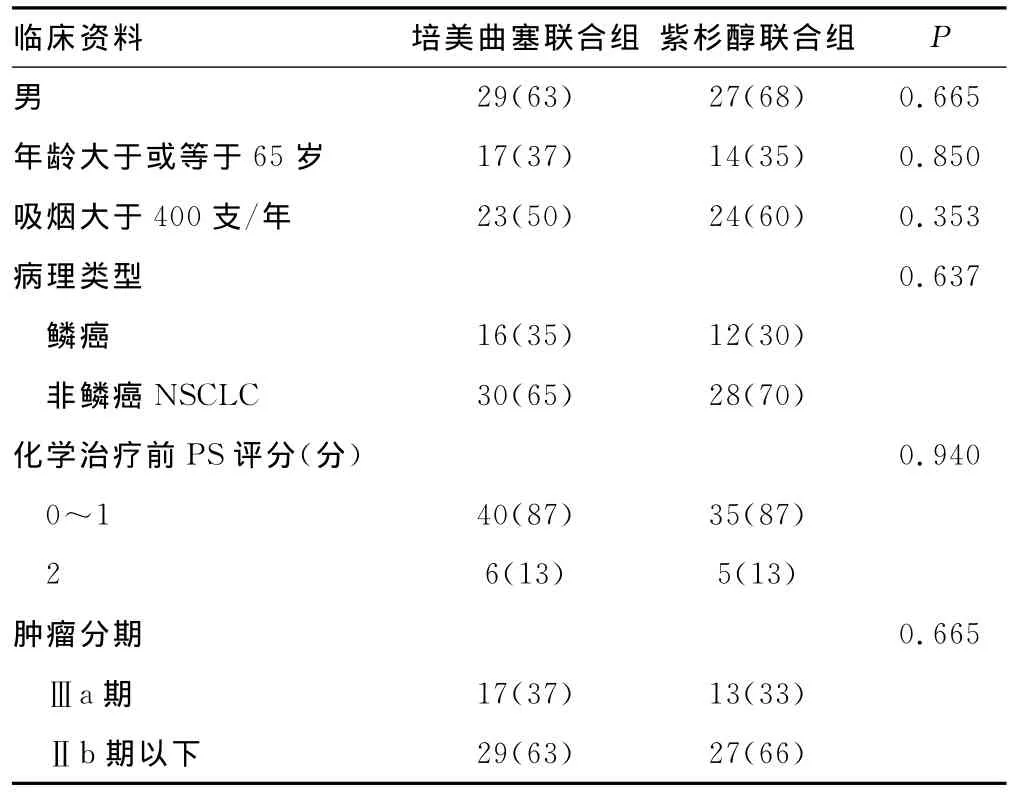
表1 培美曲塞联合组和紫杉醇联合组手术后NSCLC患者基本资料特征比较[n(%)]
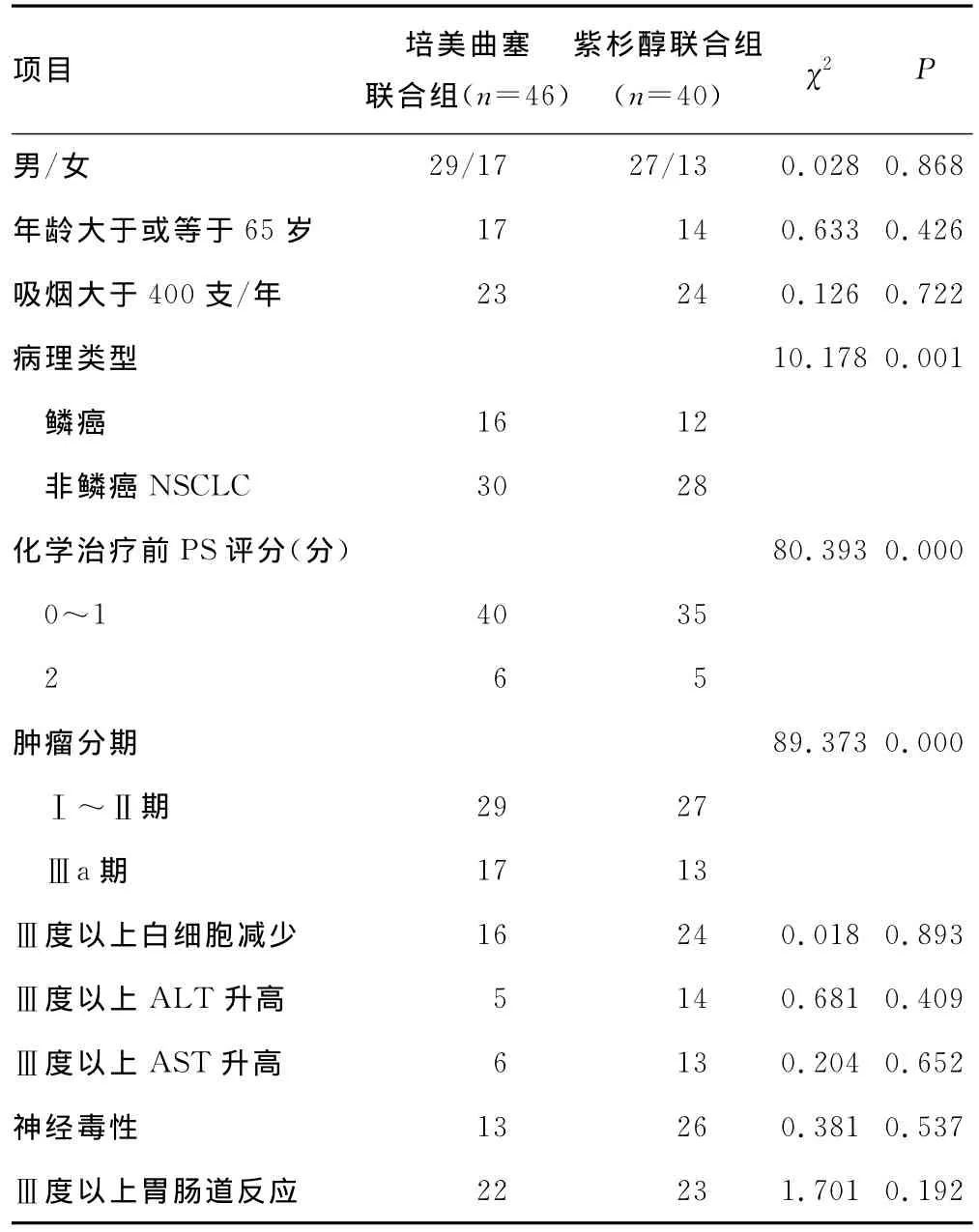
表2 培美曲塞联合组和紫杉醇联合组患者预后单因素分析
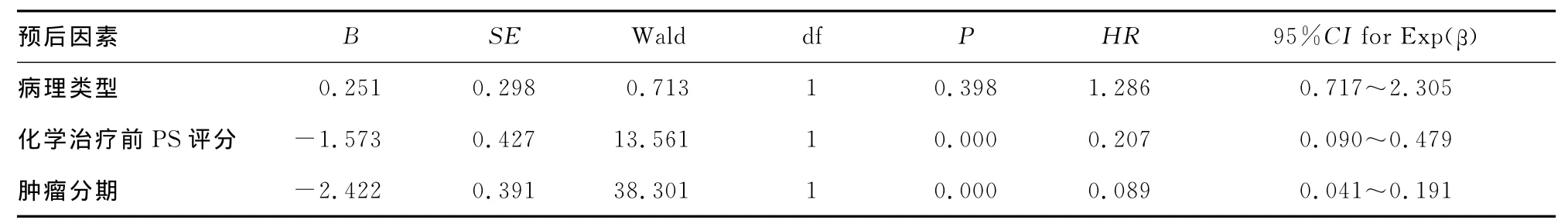
表3 影响患者预后的多因素分析
2.3 预后因素分析
2.3.1 单因素分析 培美曲塞联合组患者中病理类型、肿瘤分期、化学治疗前PS评分等3个因素对患者预后有影响,见表2。
2.3.2 Cox多因素分析 培美曲塞联合组患者中将病理类型、肿瘤分期、化学治疗前PS评分等因素纳入Cox多因素分析,得出化学治疗前PS评分、肿瘤分期是影响预后生存的独立因素,见表3。
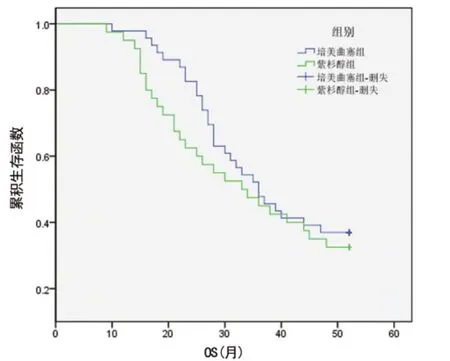
图1 培美曲塞联合组和紫杉醇联合组OS生存曲线
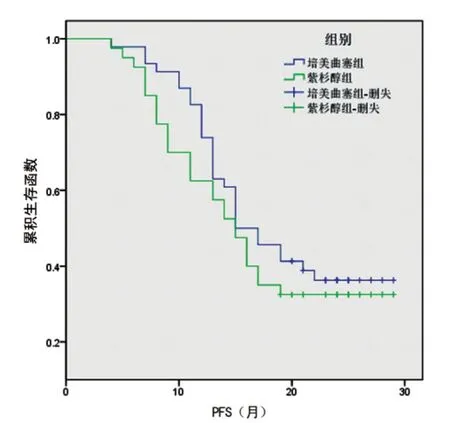
图2 培美曲塞联合组和紫杉醇联合组PFS生存曲线
3 讨 论
肺癌是影响人类生存的恶性肿瘤之一,目前,对NSCLCⅠ~Ⅲ期患者治疗主要是以手术治疗加辅助化学治疗为主的综合治疗[2]。Ⅱ期患者手术后辅助化学治疗的获益已经有Ⅰ类证据作为支撑[3-4]。而对Ⅲa期NSCLC应该采取手术治疗并行术后辅助化学治疗,对肺癌术后辅助化学治疗价值曾经有争议。国际肺癌辅助治疗研究(IALT)的结果显示:术后化学治疗可以提高患者生存率[5]。Wisnivesky等[6]发现术后化学治疗甚至在年龄大于80岁的患者都有获益。2014年NCCN发布的肺癌诊疗指南中Ⅲa期手术后患者纳入新辅助或辅助化学治疗的范围。化学治疗方案为含铂两药方案为标准的一线治疗方案;由于术后患者经历手术创伤,一般情况差,处于负氮平衡状态,对化学治疗药物耐受性差。故选择高效、低毒的个体化化学治疗方案,减少化学治疗不良反应,提高患者耐受性和生活质量,已经成为临床医师在面对术后NSCLC患者化学治疗时需要思考的问题。
培美曲塞是一种高效、不良反应低且患者易耐受的化学治疗药物。培美曲塞是一种多靶点抗代谢的细胞毒药物,与多西紫杉醇等药物比较,其不良反应更轻,作为叶酸拮抗剂,可以抑制胸通过抑制胸苷酸合成酶(TS)、二氢叶酸还原酶(DHFR)、甘氨酰胺核苷甲酰基转移酶(GARFT)、基咪唑羧酰胺核苷甲酰转移酶(ALCARFT)的活性,使嘌呤和胸腺嘧啶核苷生物合成减少,从而影响肿瘤细胞DNA和RNA的合成,特别是使肿瘤细胞停滞于 S期,促进肿瘤细胞凋亡[7-8]。Scagliotti等[9]在进行了一线治疗晚期NSCLC的临床研究(JMDB)结果显示:培美曲塞联合顺铂组的疗效与吉西他滨联合顺铂组完全相当(中位OS分别为10.3个月、10.3个月;中位PFS分别为4.8个月、5.1个月),刘延霞等[10]研究也得出相同的结果。Lilembaum等[11]进行了卡铂联合培美曲塞联合与培美曲塞单用的疗效分析,研究结果显示培美曲塞联合卡铂效果优于培美曲塞单独应用(中位 OS分别为9.1个月、5.6个月,HR=0.57,P=0.001;中位PFS分别为5.9个月、3.0个月,HR=0.46,P<0.001)。在2014年NCCN的肺癌诊疗指南中培美曲塞联合铂类的化学治疗方案作为一线新辅助和辅助化学治疗的地位已经得到承认,但不建议用于鳞癌NSCLC患者。
本研究结果显示手术后患者用培美曲塞联合奥沙利铂治疗组和紫杉醇联合奥沙利铂组的 OS(χ2=0.648,P=0.421)、PFS(χ2=0.758,P=0.384)比较差异无统计学意义。提示培美曲塞联合奥沙利铂方案与紫杉醇联合铂类的经典化学治疗方案在延长患者OS和PFS方面有相似的效果或仅有细微的差别。在不良反应方面,Patel等[12]研究得出培美曲塞较紫杉醇的化学治疗方案有更低的不良反应。本研究结果显示,培美曲塞联合奥沙利铂组较紫杉醇联合奥沙利铂组在白细胞减少、肝功能损伤、神经毒性等方面发生率更低,而胃肠道毒性则与紫杉醇相当,可以看出培美曲塞在减轻患者化学治疗不良反应方面更具优势。王强等[13]Meta分析研究也得出相似的结果。在韩国和台湾相关研究发现贝伐单抗较培美曲塞有较高的经济效能比[14],但是俄罗斯的相关研究显示由于培美曲塞有更低的毒性,可以减少因毒性反应带来的经济负担,相反可以节约经济成本和提高患者生活质量[15]。
Travis等[16]研究发现,特定的预后因素可以预测NSCLC患者的预后情况,其中肿瘤分期、PS评分、体质量状况成为影响预后的因素。本研究进行的单因素分析中结果表明年龄大于或等于65岁的NSCLC患者中位OS为30.0个月,年龄小于65岁患者中位OS为36.0个月,差异无统计学意义(P=0.426)。说明老年患者与其他年龄组的患者比较可以从术后化学治疗中得到相似的生存时间。另外,患者性别、胃肠道不良反应、肝脏毒性反应、治疗的方案等因素对患者的预后生存也没有影响。本研究经单因素筛选后最终将病理类型、化学治疗前PS评分、肿瘤分期等因素纳入Cox模型中分析后得出化学治疗前PS评分、肿瘤分期是影响预后生存的独立因素。说明PS评分2分患者和肿瘤分期为Ⅲa期患者预后并不乐观。
总之,手术治疗作为Ⅰ~Ⅲ期NSCLC患者的治疗基础,术后辅助化学治疗可以使患者明显获益,患者经历手术的创伤后一般情况差,处于负氮平衡状态,选择高效、安全、低毒的个体化化学治疗方案显得尤为重要。本研究发现培美曲塞联合奥沙利铂与紫杉醇联合奥沙利铂两种化学治疗方案对术后NSCLC患者有着相似的治疗效果。但是,培美曲塞联合奥沙利铂方案的不良反应更低,提高了患者对手术后化学治疗的耐受性和患者的生活质量。同时为临床医师选择化学治疗方案个体化治疗时提供了依据。由于本研究受回顾性分析条件限制,故仍有待更大样本量的研究进一步验证。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics 2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2] 支修益,吴一龙,马盛林,等.原发肺癌诊疗规范(2011版)[J].中国肺癌杂志,2012,15(21):677-688.
[3] Pignon JP,Tribodet H,Scagliotti GV,et al.Lung adjuvant cisplatin evaluation:apooled analysis by the LACE Collaborative Group[J].Clin Oncol,2008,26(21):3552-3559.
[4] Howington JA,Blum MG,Chang AC,et al.Treatment of stageⅠandⅡ non-small cell lung cancer:Diagnosis and management of lung cancer,3rd ed:American College of Chest Physicians evidence-based clinical practice guidelines[J].Chest,2013,143(5Suppl):e278S-e313S.
[5] Chevalier TL,Pignon JP,Bergman B,et al.Results of the randomized international adjuvant lung cancer trail(IALT):ciplatin based chemotherapy(CT)vs no CT in 1867patients with resected non-small cell lung cancer(NSCLC)[J].Lung Cancer,2003,41(52):3-7.
[6] Wisnivesky JP,Smith CB,Packer S,et al.Survival and risk of adverse events in older patients receiving postoperative adjuvant chemotherapy for resected stagesⅡ-ⅢA lung cancer:observational cohort study[J].BMJ,2011,343:d4013.
[7] Ceppi P,Rapa I,Lo Iacono M,et al.Expression and phar-macological inhibition of thymidylate synthase and Src kinase in nonsmall cell lung cancer[J].Int J Cancer,2012,130(8):1777-1786.
[8] Gonen N,Assaraf YG.Antifolates in cancer therapy:structure,activity and mechanisms of drug resistance[J].Drug Resist Updat,2012,15(4):183-210.
[9] Scagliotti G,Hanna N,Fossella F,et al.The differential efficacy of pemetrexed according to NSCLC histology:a review of two PhaseⅢ studies[J].Oncologist,2009,14(3):253-263.
[10]刘延霞,刘峰.培美曲塞或吉西他滨联合顺铂治疗晚期NCSLS随机对照研究[J].中华肿瘤防治杂志,2013,20(22):1748-1750.
[11]Lilembaum R,Zukin M,Rodriguez-Pereira J,et al.A randomized phase Ⅲ trial of single-agent pemetrexed(P)versus carboplatin and pemetrexed(CP)in patients with advanced non-small cell lung cancer(NSCLC)and performance status(PS)of 2[J].Clin Oncol,2012,30(Suppl):abstract 7506.
[12]Patel JD,Socinski MA,Garon EB,et al.PointBreak:a randomized phaseⅢstudy of pemetrexed plus carboplatin and bevacizumab followed by maintenance pemetrexed and bevacizumab versus paclitaxel plus carboplatin and bevacizumab followed by maintenance bevacizumab in patients with stageⅢB orⅣnonsquamous non-small-cell lung cancer[J].Clin Oncol,2013,31(34):4349-4357.
[13]王强,马玲,申红丽,等.培美曲塞联合铂类一线治疗晚期NSCLC疗效与安全性 Meta分析[J].中华肿瘤防治杂志,2014,21(1):61-66.
[14]Ahn MJ,Tsai CM,Hsia TC,et al.Cost-effectiveness of bevacizumab-based therapy versus cisplatin plus pemetrexed for the first-line treatment of advanced non-squamous NSCLC in Korea and Taiwan[J].Asia Pac J Clin Oncol,2011,7(Suppl 2):22-33.
[15]Davey P,Kanivets Y,Barraclough H,et al.Cost analysis,safety,and efficacy of pemetrexed/cisplatin compared with bevacizumab/gemcitabine/cisplatin in patients with previously untreated advanced non-squamous NSCLC in Russia[J].Value Health,2011,14(3):A161.
[16]Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].Thorac Oncol,2011,6(2):244-285.

