原代人子宫内膜细胞分离及培养鉴定*
刘 妍,李卫红△,韦尉元
(1.广西中医药大学妇科教研室,南宁530001;2.广西医科大学研究院,南宁530021)
子宫内膜是性激素作用的靶器官,其功能细胞在月经、妊娠及子宫内膜疾病等生理与病理方面的作用机制尚未完全阐明。随着分子生物技术的发展,子宫内膜细胞的体外培养为研究细胞生长“分化”代谢以及激素作用机制提供一个理想的试验模型[1]。因此,建立一种可获得高纯度子宫内膜细胞的体外培养体系尤为重要,既可用于其生理功能的研究,也可用于子宫内膜异位症、功能失调性子宫出血、子宫内膜癌等多种疾病发病机制的进一步研究。子宫内膜细胞,即间质细胞(endometrial stromal cell,ESC)和腺上皮细胞(endometrial glandular epithelial cell,EEC)的分离纯化方法众多,当前国外最常用且操作相对较简单的是二次筛网过滤法[2-3]。本研究通过在二次筛网过滤法的基础上根据自身试验条件对之加以改良,以探索一种相对简单易行的人子宫内膜细胞分离方法,并对分离人子宫内膜细胞的存活率和纯度进行判定,为子宫内膜细胞相关课题研究奠定基础。
1 材料与方法
1.1 标本来源和采集 本试验所采集的10例子宫内膜组织均来自广西中医药大学附属瑞康医院妇科因“子宫内膜异位症或子宫腺肌症”行开腹或经腹腔镜下全子宫切除术的患者。患者年龄38~49岁,平均(42.26±3.58)岁,术前3个月均未经激素药物治疗。术中取得子宫内膜组织后,立刻投入无菌生理盐水内快速清洗,初步洗去血污及杂质,然后放入含无菌预冷DMEM/F-12培养液(含双抗)中,于30min内送往实验室进行分离培养。本试验涉及的全部子宫内膜均经病理检查证实为增生期或分泌期子宫内膜,并排除子宫内膜增生症、子宫内膜炎性病变等。子宫内膜组织标本的留取经过医院伦理委员会批准,且征得其本人同意并签署了知情同意书。
1.2 仪器与试剂
1.2.1 主要试剂 D′hanks液(捷瑞生物工程有限公司,上海);DMEM/F-12(赛默飞世尔公司,北京);青霉素、链霉素混合液、0.25%胰蛋白酶、4.00%多聚甲醛(均来自索莱宝公司,北京);胎牛血清(天杭生物科技公司,浙江);0.25%I型胶原酶(Sigma公司,美国);细胞角蛋白抗体、波形蛋白抗体(均为Boster公司,武汉);SP-9000免疫组织化学试剂盒(中杉金桥生物技术有限公司,北京);FITC标记的羊抗鼠抗体、两步法抗兔/鼠通用型免疫组织化学试剂盒(中山生物技术有限公司,北京)。
1.2.2 仪器 水套式二氧化碳培养箱(2323-2,SHEL LAB生产);电热恒温水温箱(SHH.W21.600S,上海跃进医疗厂生产);洁净工作台(SW-CJ-IF,苏州安泰空气技术公司生产);倒置式生物显微镜(CKX41SF,Olympus生产);高速冷冻离心机(Centrifuge 5430R,Eppendorf生产)。
1.3 方法
1.3.1 人子宫内膜细胞的分离、纯化及传代 所取到的内膜组织参照文献[4]的方法加以改良,具体步骤如下。(1)清洗:用D′hanks液将新鲜刮取的内膜组织清洗3次,尽量将血污及杂质清除干净,将清洗后的组织剪碎约为1mm3,肉眼呈糊状;(2)消化:加入0.25%I型胶原酶400μL,37℃恒温水浴8min左右,期间适度振荡4~5次。加入3倍体积DMEM/F-12培养液终止消化;(3)纯化:细胞悬液依次过100目及400目细胞过滤网并用培养液冲洗细胞网,收集其表面的腺上皮细胞团。得到的2种细胞悬液分别进行离心(1 000r/min×10min),弃上清液,保留细胞沉淀;(4)培养和传代:按细胞密度为105/mL接种于25cm2细胞培养瓶内,37℃,5%CO2培养箱中孵育。次日换液,之后每48~72小时进行细胞换液。待细胞铺满瓶底后,用0.25%胰蛋白酶(含0.02%EDTA)进行消化传代[2]。传代后的细胞平均分成2瓶继续培养。
1.3.2 细胞形态学观察 每天于倒置相差显微镜下观察2种内膜细胞的形态与生长规律。
1.3.3 免疫细胞化学法染色 (1)细胞爬片:以细胞浓度为106/mL的细胞悬液接种于放有无菌盖玻片的6孔板内,于细胞培养箱内孵育24h,待细胞长满90%后,取出细胞爬片。4.0%多聚甲醛固定细胞,0.1%~0.2%聚乙二醇辛基苯基醚通透细胞。5.0%正常山羊血清孵育30min后弃血清;(2)分别加入角蛋白抗体、波形蛋白抗体(工作浓度均为1∶50),同时设立阴性对照(用PBS代替一抗),4℃湿盒内过夜。次日复温后滴加稀释的二抗,37℃孵育30min,采用SP法进行染色(滴加辣根酶标记链酶乳白素工作液)。中性树胶封片,光学显微镜下观察。
1.3.4 免疫细胞荧光 (1)细胞爬片:同免疫细胞化学;(2)加入一抗(此步骤同免疫细胞化学),(避光)加入荧光标记二抗,即FITC标记的羊抗鼠抗体,37℃孵育1h后,DAPI复染细胞核10min。50%~90%甘油封片,指甲油封片的四周,光学显微镜下观察。
2 结 果
2.1 培养结果 所取10例标本成功分离并培养出ESC和EEC的例数为8例,其余2例均为培养过程中真菌污染。结果证实此方法有效、可行且简便。
2.2 细胞生长情况及形态观察 (1)ESC:接种后约2h左右开始贴壁,此时,可观察到2种形态的细胞:梭形细胞占多数,少量呈多角形。ESC细胞质饱满,核居中且圆,细胞呈平铺生长。ESC易传代,连续培养3~4d后,细胞逐渐延伸成长梭形,平行排列成束,密度大的区域则成团生长(图1),最长可存活数月;(2)EEC:一般于接种后24h左右开始贴壁,细胞呈蝌蚪形或多角形,细胞质丰富,核圆而大,细胞边界清楚,排列紧密(图2),约4d后呈漩涡状排列生长。EEC平均生长时间约为6周。在EEC培养过程中会掺杂少量ESC。子宫内膜原代细胞经首次传代后生长力旺盛,大约5~6d可再次传代。与文献[5-6]报道相符合。
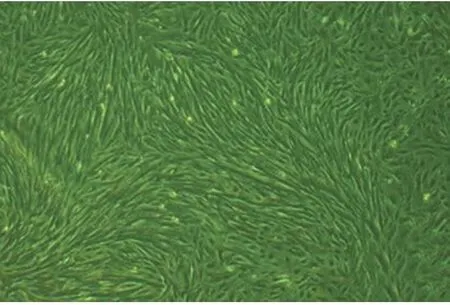
图1 光学显微镜下ESC细胞影像学表现(×100)
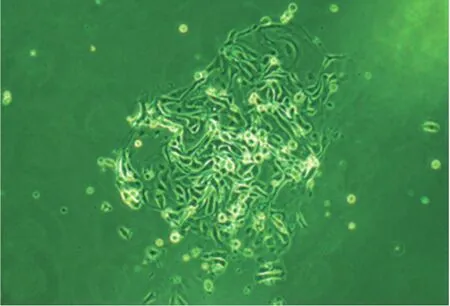
图2 光学显微镜下EEC细胞影像学表现(×100)
2.3 子宫内膜细胞的纯度鉴定 ESC的特异性标志分子为波形蛋白,EEC的特异性标志分子为细胞角蛋白。阳性结果判定:ESC与EEC均为细胞质染色,棕黄色视为阳性染色;方法为:在低倍镜下每张盖玻片随机选取10个视野计数染色阳性细胞数和染色阴性细胞数。免疫细胞化学染色结果显示,ESC角蛋白染色阴性,波形蛋白染色阳性,阳性率95%,阳性细胞质呈棕黄色,核为蓝色(图3);EEC角蛋白染色阳性,波形蛋白染色阴性,阳性率90%,阳性细胞质染成棕黄色,核为蓝色(图4)。
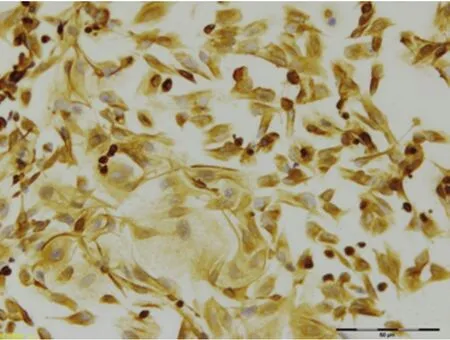
图3 ESC细胞染色影像学表现(×200)
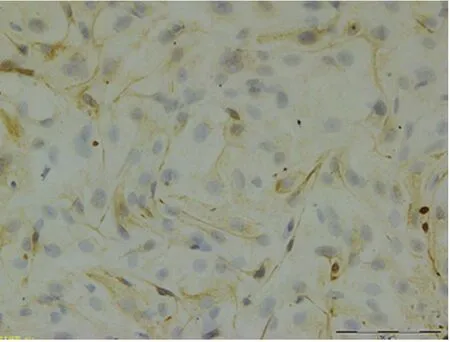
图4 EEC细胞染色影像学表现(×200)
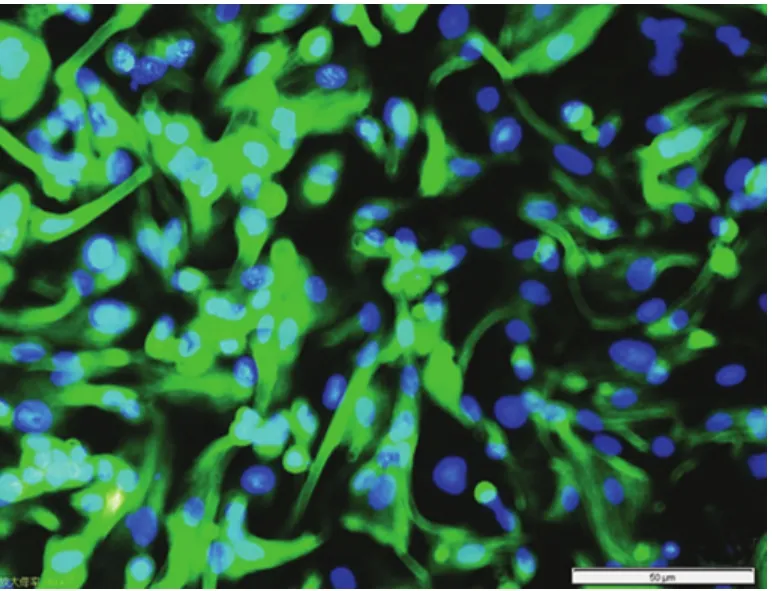
图5 ESC细胞免疫荧光染色结果(×200)
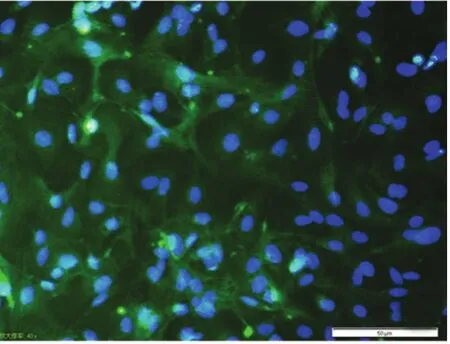
图6 EEC细胞免疫荧光染色结果(×200)
2.4 细胞免疫荧光结果 (1)ESC角蛋白染色阴性,波形蛋白染色阳性,阳性率95%,阳性细胞质呈荧光反应,核为蓝紫色(图5);(2)EEC角蛋白染色阳性,波形蛋白染色阴性,阳性率90%,阳性细胞质呈荧光反应,核为蓝紫色(图6)。
3 讨 论
3.1 成功建立高纯度子宫内膜细胞体外培养系统的重要意义
目前,子宫内膜细胞体外培养是研究子宫内膜相关疾病公认的一种有效途径,应用子宫内膜细胞分离纯化及培养技术,建立人子宫内膜细胞体外培养系统,可对胚胎着床,月经调节机制和子宫内膜异位症的产生机制等进行基础研究,并且可为研究药物作用机制及肿瘤发生等提供有效的手段[7-8]。
3.2 人子宫内膜原代细胞体外培养的主要影响因素 子宫内膜原代细胞能否成功培养与以下因素密切相关:细胞的活力、纯度及细胞的接种密度[9]。目前,有文献主张应用复合酶进行组织的消化,经过多次试验,最终认为I型胶原酶对细胞的活力影响较小,性价比较高,与许艳丽等[10]研究结论相符。本研究采用的标本均来自无菌条件下刮取的子宫内膜组织,并立即放入含双抗的培养液中,最大程度避免了污染。此外,有研究表明,适当增加冲洗组织标本的次数有利于将血污及黏液的进一步去除,并可清除病原体[11]。消化后得到的悬液中包括ESC、EEC及红细胞等其他杂质细胞,其中,ESC和EEC可分别通过400目及100目细胞筛网,而红细胞及其他杂质细胞则极少能通过100目细胞筛网。故本研究采用分次筛网进行过滤,离心后可得到较纯的ESC悬液及EEC悬液。Arnold等[12]认为,若在接种时细胞的密度过稀,则可因为细胞之间失去相互支持,而最终导致培养失败。作者认为在接种细胞时ESC以105/mL浓度,EEC则以500/mL的浓度进行接种比较适宜。在进行原代培养的过程中,还有国外学者采用2种细胞混合培养作为体外细胞模型[13-14],此种方法有待进一步探索。此外,人子宫内膜原代细胞分离、培养过程不改变细胞特异蛋白的表达,可通过特异性抗体免疫标记离体细胞以鉴定培养结果[4]。本试验中角蛋白与波形蛋白进行细胞鉴定的成功充分说明了这一点。
在本试验的探索过程中,可总结以下经验:(1)消化时采用终浓度为0.1%I型胶原酶,消化时间为8min左右得到的细胞较多、活力较好;(2)低速单次离心(1 000r/min×10min)细胞的损伤较小;(3)取材时尽量去除血污及杂质,并在次日换液,能更好地去除混杂的红细胞,以减少红细胞破裂死亡后释放的酶对子宫内膜细胞产生的影响;(4)细胞消化传代时用含0.02%EDTA的0.25%胰蛋白酶效果佳,因EDTA为一种螯合剂,可对贴壁细胞起到一定的解离作用[15];(5)原代细胞在分离培养过程中易被污染,需严格遵守无菌操作要求。
总之,本方法采用单酶(胶原酶)消化和细胞筛网2次过滤并低速离心,成功分离获取高纯度的子宫内膜ESC和EEC且没有改变其细胞特征。本方法具备操作简单、费用较低、所需试剂少等优点,且分离培养的细胞纯度高,可为进一步研究子宫内膜细胞相关生理病理机制提供满意的体外细胞平台。
[1] Herrler A,Von Rango U,Beier HM.Embryo-maternal signalling:how the embryo starts talking to its mother to accomplish implantation[J].Reprod Biomed Online,2003,6(2):244-256.
[2] Bilotas M,Meresman G,Buquet R,et al.Effect of vascular endothelial growth factor and interleukin-1beta on apoptosis in endometrial cell cultures from patients with endometriosis and controls[J].J Reprod Immunol,2010,84(2):193-198.
[3] Shimizu Y,Mita S,Takeuchi T,et al.Dienogest,a synthetic progestin,inhibits prostaglandin E2production and aromatase expression by human endometrial epithelial cells in a spheroid culture system[J].Steroids,2011,76(1/2):60-67.
[4] 李春霞,王蕊,柴奇,等.人子宫内膜细胞纯化方法的研究[J].中国全科医学,2010,13(9):964-966.
[5] 鲍远红,王秀霞.一种新的子宫内膜腺上皮细胞和基质细胞的分离纯化及培养方法的探讨[J].中国医科大学学报,2007,36(5):608-610.
[6] 俞超芹,石书芳,刘玉环,等.人子宫内膜异位症在位和异位内膜细胞原代培养及形态学观察[J].中西医结合学报,2006,4(2):189-193.
[7] Schickling BM,Aykin-Burns N,Leslie KK,et al.An inhibitor of K+channels modulates human endometrial tumor-initiating cells[J].Cancer Cell Int,2011,11(1):25.
[8] Guo X,Liu G,Schauer IG,et al.Overexpression of theβ subunit of human chorionic gonadotropin promotes the transformation of human ovarian epithelial cells and ovarian tumorigenesis[J].Am J Pathol,2011,179(3):1385-1393.
[9] 陈诚,常青,梁志清,等.人子宫内膜细胞原代培养方法的改良[J].第三军医大学学报,2007,29(6):507-509.
[10]许艳丽,杨卓,陈英汉,等.人子宫内膜异位症在位内膜间质细胞原代培养方法探讨[J].中国全科医学,2009,12(18):1669-1672.
[11]王欣,成娅,程湘,等.人子宫内膜腺上皮细胞原代培养方法的改进[J].重庆医学,2005,34(5):702-703,705.
[12]Arnold JT,Kaufman DG,Seppala M,et al.Endometrial stromal cells regulate epithelial cell growth in vitro:a new co-culture model[J].Hum Reprod,2001,16(5):836-845.
[13]Akoum A,Lawson C,Herrmann-Lavoie C,et al.Imbalance in the expression of the activating typeⅠand the inhibitory typeⅡinterleukin 1receptors in endometriosis[J].Hum Reprod,2007,22(5):1464-1473.
[14]Gazvani R,Smith L,Fowler PA.Effect of interleukin-8(IL-8),anti-IL-8,and IL-12on endometrial cell survival in combined endometrial gland and stromal cell cultures derived from women with and without endometriosis[J].Fertil Steril,2002,77(1):62-67.
[15]薛庆善.体外培养的原理与技术[M].北京:科学出版社,2001:94-95.

