右美托咪定对脂多糖诱导大鼠外周血中性粒细胞TREM-1mRNA表达的影响*
何绮霞,卢 燕,陈翠平,顾晓霞,庄海霞,张良清(广东医学院附属医院麻醉科,广东湛江524001)
脂多糖(LPS)是革兰阴性细菌细胞壁的主要成分,机体免疫系统会对LPS诱导产生免疫应答,大量细胞因子和炎性介质分泌,从而诱发全身炎性反应,严重者可导致脓毒血症和多器官功能障碍综合征。髓样细胞触发受体-1(triggering receptor expressed on myeloid cells-1,TREM-1)是近年来发现的表达于髓样细胞(如单核/巨噬细胞、中性粒细胞)表面的免疫球蛋白超家族活化受体,它介导的信号传导通路在炎性反应的发生和级联放大中起重要作用[1],在盲肠结扎穿孔的脓毒症实验动物模型研究发现LPS能引起中性粒细胞和中性粒细胞TREM-1的表达明显增加[2]。右美托咪定是一种高选择性的α2肾上腺素能受体激动剂,可产生镇静、镇痛、抑制交感活动的作用。最近国外多个研究报道地塞米松(DEX)还具有明显的脏器保护及抗炎作用[3-7]。本研究拟探讨右美托咪定对LPS诱导大鼠外周血中性粒细胞TREM-1mRNA表达的影响。
1 材料与方法
1.1 主要试剂和仪器 右美托咪定(江苏恒瑞医药股份有限公司),LPS(Sigma公司,美国),大鼠中性粒细胞分离液(天津灏洋生物制品科技有限公司),台盼蓝检测试剂盒(江苏碧云天生物公司),ELISA试剂盒(大连宝生物工程有限公司),RTPCR相关试剂(Takara公司,日本),引物合成(上海生工生物工程技术服务有限公司),9600型PCR扩增仪(PE公司,美国),DH2000凝胶成像分析系统(中国计量科学研究所)。
1.2 动物选择及外周血中性粒细胞分离 选取健康雄性Wistar大鼠40只,体质量230~270g,由广东医学院实验动物中心提供。用肝素湿润过的注射器穿刺大鼠心脏取血样6 mL,加2mL 6%右旋糖酐生理盐水,混匀后在室温静置30~45min,使红细胞下沉,取上层细胞按1∶1比例叠加到聚蔗糖-泛影葡胺分层液面上,500r/min离心30min;将沉淀细胞用0.83%NH4Cl溶液破坏红细胞,离心洗涤后,悬于2~3mL 0.10%白明胶Hank′s液中,计数并调整细胞浓度,取细胞液涂片,分别作台盼蓝拒染试验和Giemsa染色,鉴定其存活率与纯度。
1.3 实验分组 随机数字表法将细胞随机分为4组(n=10),A组:阴性对照;B组:中性粒细胞中加入LPS(终浓度为100 μg/L);C组:中性粒细胞中加入LPS(终浓度为100μg/L)加右美托咪定(终浓度为0.5ng/mL);D组:中性粒细胞中加入LPS(终浓度为100μg/L)加右美托咪定(终浓度为1.0ng/mL)。
1.4 观察指标 各组细胞孵育24h后,收集培养上清液,-20℃存放,采用 ELISA 法测定 TNF-α、IL-1β和IL-6的浓度。另提取细胞总RNA,RT-PCR法测定TREM-1mRNA表达水平。TREM-1上游引物:5′-ACC ACC ACC ATG GAA CTC CGA GCT GCA ACT AAA T-3′;下 游 引 物:5′-GGG AAC ACA CCT CGA GCC TGA TGA TAT CTG TCA C-3′。扩增片段长度552bp。以β-actin作为内参,β-actin上游引物:5′-ACC ACA GCT GAG AGG AAT CG-3′,下游引物:5′-AGA GGT TTA CGT GTC AAC GC-3′,扩增片段长度 256bp。PCR反应体系25μL,反应条件为:94℃变性5min后,按94℃30s,60℃50s,72℃50s,扩增30个循环,最后72℃延伸10min。取各样本PCR产物4μL和溴酚蓝载样缓冲液1μL,加入1.5%琼脂糖凝聚样品孔中,80V恒压电泳20min,用DH2000凝胶图像分析系统进行分析结果,以TREM-1mRNA条带灰度值与β-actin条带灰度值的比值反映TREM-1mRNA表达水平。
1.5 统计学处理 采用SPSS 16.0统计软件分析处理,计量资料以x±s表示,计数资料采用χ2检验,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
4 组 大 鼠 外 周 血 中 性 粒 细 胞 TNF-α、IL-1β、IL-6 和TREM-1mRNA的比较。与A组比较,B组TREM-1mRNA表达上调,TNF-α、IL-1β和IL-6的浓度升高(P<0.05);与 B组比较,C组和 D组 TREM-1mRNA 表达下调,TNF-α、IL-1β和IL-6的浓度降低(P<0.05);C组与D组 TREM-1mRNA表达及TNF-α、IL-1β和IL-6的浓度比较差异无统计学意义(P>0.05),见表1。
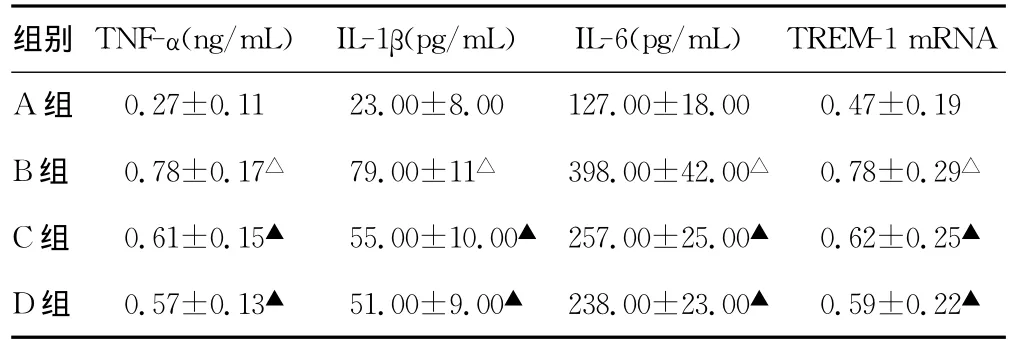
表1 4组大鼠外周血中性粒细胞 TNF-α、IL-1β、IL-6和TREM-1mRNA的比较(x±s,n=10)
3 讨 论
2001年,Bouchon等[8]首次报道了 TREM-1作为介导脓毒性休克的关键介质触发并扩大了炎性反应。TREM-1能够通过跨膜调节蛋白DAP12引起髓样细胞内蛋白激酶磷酸化,触发和放大炎性反应,使中性粒细胞和单核细胞释放IL-1β、IL-2、IL-6、IL-8、IL-12、p40、TNF-α、髓过氧化酶(MPO)、中性粒细胞趋化蛋白-1(MCP-1)、MCP-3、巨噬细胞炎性蛋白-1α(MIP-1α),以及活性氧自由基,触发中性粒细胞和单核细胞的炎症反应,诱导炎症因子的分泌和钙离子的动员,使机体产生炎症因子形成瀑布效应,使炎症扩大甚至失去控制[1,9-10]。陆立仁等[11]前期研究表明,用100μg/L的LPS刺激人中性粒细胞系THP-1细胞表面的TREM-1表达上调。因此,本研究将LPS终浓度定为100μg/L,结果表明,给予LPS刺激后,B组与A组比较,大鼠外周血中性粒细胞TREM-1mRNA表达上调,TNF-α、IL-1β和IL-6的浓度升高,说明LPS可诱导中性粒细胞活化,导致 TREM-1合成增加,从而诱发 TNF-α、IL-1β和IL-6的生成与释放。临床上右美托咪定的推荐治疗靶浓度为0.4~1.2ng/mL。因此,本研究选择C、D组分别加入右美托咪定终浓度为0.5ng/mL和1.0ng/mL,结果表明,与B组比较,C组和 D 组 TREM-1mRNA 表达下调,TNF-α、IL-1β和IL-6的浓度降低,说明右美托咪定可下调TREM-1mRNA表达,抑制TREM-1的合成,抑制LPS诱导大鼠外周血中性粒细胞 TNF-α、IL-1β和IL-6生成与释放。
右美托咪定下调TREM-1mRNA表达的机制目前尚不清楚。 研 究 结 果 显 示[12-13],在 TLR-4 配 体 存 在 的 条 件 下,TREM-1激活可放大促炎性细胞因子 TNF-α、IL-1β的释放,同时减少抗炎细胞因子IL-10释放,而且激活TLR可使TREM-1表达水平上升,TREM-1表达水平可改变TLR-4信号转导途径关键受体和效应蛋白的表达,从而调节TLR-4途径效应,因而,TREM-1与TLR信号通路可能存在协同作用。闫东来等[14]研究显示,DEX可通过下调 TLR-4mRNA的表达,抑制TLR-4的合成,从而抑制LPS诱导大鼠外周血单核细胞TNF-α、IL-1β和IL-6生成与释放。因此,作者推测右美托咪定下调TREM-1mRNA表达与TLR-4信号转导途径关键受体和效应蛋白的表达有关。
[1] Tessarz AA,Cerwenka A.The TREM-1/DAP12pathway[J].Immunol Lett,2008,116(2):111-116.
[2] Bouchon A,Dietrich J,Colonna M.Cutting edge:inflammatory responses can be triggered by TREM-1,a novel receptor expressed on neutrophils and monocytes[J].J Immunol,2000,164(10):4991-4995.
[3]Ibacache M,Sanchez G,Pedrozo Z,et al.Dexmedetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart[J].Biochim Biophys Acta,2012,1822(4):537-545.
[4] Yan M,Dai HB,Ding TT,et al.Effects of dexmedetomidine on the release of glial cell line-derived neurotrophic factor from rat astrocyte cells[J].Neurochem Int,2011,58(5):549-557.
[5] Zhang XY,Liu ZM,Wen SH,et al.Dexmedetomidine administration before,but not after,ischemia attenuates intestinal injury induced by intestinal ischemia-reperfusion in rats[J].Anesthesiology,2012,116(5):1035-1046.
[6] Tasdogan M,Memis D,Sut N,et al.Results of a pilot study on the effects of propofol and dexmedetomidine on inflammatory responses and intraabdominal pressure in severe sepsis[J].J Clin Anesth,2009,21(6):394-400.
[7] Taniguchi T,Kurita A,Kobayashi K,et al.Dose-and time-related effects of dexmedetomidine on mortality and inflammatory responses to endotoxin-induced shock in rats[J].J Anesth,2008,22(3):221-228.
[8] Bouchon A,Facchetti F,Weigand MA,et al.TREM-1amplifies inflammation and is a crucial mediator of septic shock[J].Nature,2001,410(6832):1103-1107.
[9] Bleharski JR,Kiessler V,Buonsanti C,et al.A role for triggering receptor expressed on myeloid cells-1in host defense during the early-induced and adaptive phases of the immune response[J].J Immunol,2003,170(7):3812-3818.
[10]Radsak MP,Salih HR,Rammensee HG,et al.Triggering receptor expressed on myeloid cells-1in neutrophil inflammatory responses:differential regulation of activation and survival[J].J Immunol,2004,172(8):4956-4963.
[11]陆立仁,张良清,卢燕.异丙酚对内毒素诱导人单核细胞系THP-1细 胞 TREM-1表 达 的 影 响 [J].天 津 医 药,2014,42(8):759-761,785.
[12]Unoshima M.Therapeutic effect of anti-HMGB1antibody and anti-RAGE antibody on SIRS/sepsis[J].Nippon Rinsho,2004,62(12):2323-2329.
[13]Ornatowska M,Azim AC,Wang X,et al.Functional genomics of silencing TREM-1on TLR4signaling in macrophages[J].Am J Physiol Lung Cell Mol Physiol,2007,293(6):L1377-1384.
[14]闫东来,于泳浩,刘宏伟,等.右美托咪定对脂多糖诱导大鼠外周血单核细胞Toll样受体4mRNA表达的影响[J].中华麻醉学杂志,2011,31(1):115-117.

