静脉注射免疫球蛋白对T细胞的作用及其在自身 免疫性疾病中的应用
赵文婷,吴云综述 梁庆成审校
综 述
静脉注射免疫球蛋白对T细胞的作用及其在自身 免疫性疾病中的应用
赵文婷,吴云综述 梁庆成审校
免疫球蛋白;T细胞;自身免疫性疾病
【DOI】 10.3969 / j.issn.1671-6450.2015.04.032
近年来,大剂量静脉注射用免疫球蛋白(intravenous immunoglobulin,IVIg)越来越广地应用在各种自身免疫性疾病的治疗中,并已成为了多种疾病的临床一线治疗药物,如特发性血小板减少性紫癜(idiopathic thrombocytopenia purpura,ITP)、川崎病(Kawasaki di-sease,KD)、周围性神经病、慢性炎性脱髓鞘性多神经病(chronic inflammatory demyelinating polyneuropathy,CIDP)以及吉兰—巴雷综合征(Guillain-Barré syndrome,GBS)和多发性硬化(multiple sclerosis,MS)等,以上疾病均属于自身免疫性疾病范畴。目前已明确的IVIg的作用机制仍不能完全解释其在自身免疫性疾病中是如何发挥作用的。在自身免疫性疾病中,使用大剂量免疫球蛋白(免疫缺陷病治疗量的5~10倍)是为了增大其中某种低效价成分的含量,例如,针对细胞因子的天然自身抗体,即抗独特型抗体[1,2]。这些作用最终影响了自身抗体的产生和功能。但是,在那些自身抗体并不起主导作用或细胞免疫占主导作用的自身免疫疾病中,IVIg的作用机制则有所不同。
1 IVIg与细胞免疫
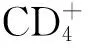
2 IVIg与Th1/Th2的平衡
IVIg治疗自身免疫性疾病的机制与效应T细胞分泌的细胞因子水平密切相关。川崎病患者的血浆中,Th1细胞分泌的干扰素-γ(interferonγ,IFN-γ)与肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的水平明显升高,但是在应用了IVIg后,水平迅速恢复至正常[6]。在一个独立的川崎病组中,Th2细胞相关细胞因子IL-4与IL-5的水平,与冠状动脉病变的发展呈负相关,但在应用IVIg治疗后水平明显升高。从传统观点来说,Th1细胞与Th2细胞相关细胞因子之间的平衡与自身免疫性疾病的发病和进展过程密切相关,这种关联性即使在应用了IVIg后仍然存在。这一论点在ITP、KD和MS相关实验中均得到了证实[7~9]。许多自身免疫性疾病的动物模型实验结果均支持如下观点:Th2细胞分泌的相关细胞因子扮演了保护性的角色。但目前Th1/Th2的平衡体系已经不足以充分解释IVIg的治疗机制。在近年来的临床试验研究中,Th1与Th2之间此消彼长的这种认知受到了挑战。Th2型免疫偏倚在全身性自身免疫疾病中是非常常见的,例如,系统性红斑狼疮和硬皮病,且与病情严重程度及对治疗的反应相关。IVIg的应用可使IFN-γ和IL-12的表达升高,从而改善Th1与Th2之间的失衡[10]。在川崎病患者中,出现冠状动脉病变者表现出更高的IL-4水平,且维持高水平的细胞因子是IL-6、IL-10,而不是IFN-γ,这是IVIg治疗效果欠佳的表现。由此可知,在某些临床情况下,IVIg不仅不能促进,反而可以抑制Th2方向的活化反应。随着研究的进展,许多过去固有的观点被推翻或更新,帮助我们更深刻的认识IVIg与T细胞之间的关系。
3 IVIg与Th17细胞
在过去的10年里,Th17细胞作为一个新兴的研究热点在自身免疫性疾病领域里占据了重要的位置[11]。在一个研究IVIg治疗多发性肌炎/皮肌炎的肌肉活检实验中,发现分泌IFN-γ的细胞水平下降程度低于分泌IL-17的细胞水平下降程度,提示了IVIg的作用对于Th17细胞的影响大于对Th1细胞的影响[12]。RORγt是Th17细胞特异性的转录因子。在CIDP患者中,存在于外周血和脑脊液中的效应T细胞表达 RORγt的水平与血浆中的IL-17A浓度水平,同脑脊液中的蛋白含量呈正相关,也与疾病的活动性呈正相关,且在使用了IVIg或皮质类固醇治疗后,水平均降低[13]。Th17细胞作为近年来的研究热点,不仅增进了我们对细胞免疫的认识,也使我们在探索IVIg作用机制的领域中找到了新的方向。
4 IVIg与调节性T细胞(regulatory T cells,Treg)
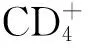
5 IVIg的免疫调节受体
IVIg提高Treg细胞的功能是通过以下几方面的相互作用实现的:首先是Treg细胞明显提高增殖分化,FoxP3、IL-10、TGF-β等因子的高表达,以及Treg细胞的抑制性活性作用增强。此外,IVIg的抗炎作用中,分离的IgG片段到底起着怎样的作用至今仍未有定论。有研究表明,唾液酸化IgG或者唾液酸化的IgG Fc片段可以通过结合树突细胞表面的II型跨膜凝集素受体(DC-specific intercellular adhesion molecule-3-grabbing non-integrin,DC-SIGN)来实现IVIg的生物活性。F(ab’)2片段的唾液酸化对于IVIg的抗炎活性和进一步的相互作用来说是必须的,Fc片段的唾液酸化则不是这样,体外实验研究中发现,多克隆的F(ab’)2片段能够与DC-SIGN结合,而Fc段则不能[19]。
最近的研究结果中,强调了Treg细胞与树突状细胞(dendritic cell,DC)的相互作用在IVIg抗炎活性中的关键作用。从正常献血者或多发性硬化患者中分离出的DC用IVIg处理后,可产生较低水平的IL-12[9],并且可以通过具有免疫抑制活性的前列腺素E2(prostaglandin E2,PGE2)来促进Treg细胞的增殖活化[19]。从接受了IVIg治疗的多发性硬化患者体内分离出的T细胞,对其进行转录水平的分析,发现了PGE2的受体-EP4的过表达[21],在实验性自身免疫性脑脊髓炎动物实验(experimental autoimmune encephalomyelitis,EAE)中,用环氧化酶抑制剂抑制了PGE2的产生后,也抑制了IVIg诱导的Treg细胞的活化。在这些模型中,尽管阻断了DC-SIGN,但只能部分性地减少了环氧化酶-2(COX-2)的活性及Treg细胞的活化,提示IVIg的作用机制仍需要其他选择性受体的参与[19]。
6 IVIg与免疫耐受的重建
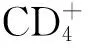
7 小结
由于在适应性免疫中的重要作用,T细胞已成为重建自身免疫耐受的一个重要靶点。针对T细胞免疫应答的不同层次,已研制出了许多小分子生物制剂,用于治疗从多发性硬化到1型糖尿病等多种自身免疫性疾病,取得了良好的疗效。目前临床证实有效的几种治疗措施,都与建立良好的Treg细胞/效应T细胞之间的平衡有关,如抗胸腺细胞球蛋白或抗CD3单克隆抗体等[23],在临床上,IVIg作为一种非标准化的生物制剂,治疗效果确实是令人惊喜的。我们讨论了IVIg治疗的几种可能的免疫调节机制,包括其与固有免疫应答和适应性免疫应答之间的相互作用,以及如何促进了自身抗原特异性的诱导型Treg细胞(iTreg)的产生。上述机制已成为调节体液免疫与自身反应性细胞免疫中关键的一步,也使之成为了抗原特异性免疫治疗的一个理想靶点[16,17]。据推测,Treg细胞的功能失调可能是由于某种还未被确定的环境因素造成的,且自身免疫性疾病的发病率在过去几年间几乎增加了2倍,并且仍然以稳定的速度增长[19]。从20世纪70年代IVIg被研制出以后,在过去的20年里,IVIg在临床上的应用得到了巨大的推广。临床上IVIg制剂不断地改进,治疗的成本和可用性也越来越成为一个值得关注的问题。从免疫功能正常的献血者分离出的B细胞,在体外进行扩增培养,即可获得具有丰富多样性的多克隆抗体。这种制剂比现在普遍应用的IVIg制剂含有更丰富的唾液酸化IgG,但是这种方式的扩增多样性以及生产成本仍是一个值得讨论的问题[24]。这些研究结果有望在不久的将来,帮助临床医师为自身免疫性疾病患者提供个体化的、并且是针对特异抗原或特定疾病的标准治疗规范。
1 Ballow M. The IgG molecule as a biological immune response modifier: mechanisms of action of intravenous immune serum globulin in autoimmune and inflammatory disorders[J].J Allergy Clin Immunol,2011,127(2):315-323.
2 Berger M, McCallus DE, Lin CS. Rapid and reversible responses to IVIG in autoimmune neuromuscular diseases suggest mechanisms of action involving competition with functionally important autoantibodies[J].J Peripher Nerv Syst,2013,18(4):275-296.
4 Mausberg AK, Dorok M, Stettner M, et al. Recovery of the T-cell repertoire in CIDP by IV immunoglobulins[J].Neurology,2013,80(3):296-303.
5 Thiruppathi M,Sheng JR, Li L,et al.Recombinant IgG2a Fc (M045) multimers effectively suppress experimental autoimmune myasthenia gravis[J].J Autoimmun,2014,42:64-73.
6 Wang YJ,Wang W,Gong FQ,et al.Evaluation of intravenous immunoglobulin resistance and coronary artery lesions in relation to Th1/Th2 cytokine profiles in patients with Kawasaki disease[J].Arthritis Rheum,2013,65(3):805-814.
7 Kuo HC,Wang CL,Liang CD,et al.Association of lower eosinophil-related T helper 2 (Th2) cytokines with coronary artery lesions in Kawasaki disease[J].Pediatr Allergy Immunol,2009,20(3):266-272.
8 Mouzaki A,Theodoropoulou M,Gianakopoulos I,et al.Expression patterns of Th1 and Th2 cytokine genes in childhood idiopathic thrombocytopenic purpura (ITP) at presentation and their modulation by intravenous immunoglobulin G (IVIg) treatment: their role in prognosis[J].Blood,2002,100(5):1774-1779.9 Reske D,Thomas AV,Petereit HF,et al.Impact of immunomodulatory treatment on leukocyte cytokine production in multiple sclerosis patients and healthy donors[J].Neuroimmunomodulation,2009,16(6):385-391.
10 Kudo H, Jinnin M, Yamane K, et al. Intravenous immunoglobulin treatment recovers the down-regulated levels of Th1 cytokines in the sera and skin of scleroderma patients[J].J Dermatol Sci,2013,69(1):77-80.
11 Annunziato F, Cosmi L, Liotta F, et al. Main features of human T helper 17 cells[J].Ann N Y Acad Sci,2013,1284:66-70.
12 Tournadre A,Porcherot M,Chérin P,et al.Th1 and Th17 balance in inflammatory myopathies: interaction with dendritic cells and possible Link with response to high-dose immunoglobulins[J].Cytokine,2009,46(3):297-301.
13 Chi LJ,Xu WH,Zhang ZW,et al.Distribution of Th17 cells and Th1 cells in peripheral blood and cerebrospinal fluid in chronic inflammatory demyelinating polyradiculoneuropathy[J].J Per Nerv Syst,2010,15(4):345-356.
14 Macmillan HF,Lee T,Issekutz AC.Intravenous immunoglobulin G-mediated inhibition of T-cell proliferation reflects an endogenous mechanism by which IgG modulates T-cell activation[J].Clinical Immunology,2009,132(2):222-233.
16 Soyer OU,Akdis M,Ring J,et al.Mechanisms of peripheral tolerance to allergens[J].Allergy,2013,68(2):161-170.
17 Ulivieri C,Baldari CT.T-cell-based immunotherapy of autoimmune diseases[J].Expert Rev Vaccines,2013,12(3, SI):297-310.
18 杨承志,徐忠信.静脉注射免疫球蛋白治疗吉兰-巴雷综合征机制研究进展[J].中风与神经疾病杂志,2004,21(6):571-572.
19 Trinath J,Hegde P,Sharma M,et al.Intravenous immunoglobulin expands regulatory T cells via induction of cyclooxygenase-2-dependent prostaglandin E2 in human dendritic cells[J].Blood,2013,122(8):1419-1427.
20 De St Groth BF.Regulatory T-cell abnormalities and the global epidemic of immuno-inflammatory disease[J].Immunol Cell Biol,2012,90(3):256-259.
21 Pigard N,Elovaara I,Kuusisto H,et al.Therapeutic activities of intravenous immunoglobulins in multiple sclerosis involve modulation of chemokine expression[J].J Neuroimmunol,2009,209(1/2):114-120.
22 Su Y,Rossi R,De Groot AS,et al.Regulatory T cell epitopes (Tregitopes) in IgG induce tolerance in vivo and lack immunogenicity per se[J].J Leukoc Biol,2013,94(2):377-383.
23 Bluestone JA, Bour-Jordan H. Current and future immunomodulation strategies to restore tolerance in autoimmune diseases[J].Cold Spring Harb Perspect Biol,2012,4(11):pii:a007542.
24 Ritamo I,Cloutier M,Valmu L,et al.Comparison of the glycosylation of in vitro generated polyclonal human IgG and therapeutic immunoglobulins[J].Mol Immunol,2014,57(2):255-262.
150086 哈尔滨医科大学附属第二医院神经内科
梁庆成,E-mail:qingcheng_liang@126.com
2014-10-08)

