人结直肠癌组织中mTOR、HIF-1α、PKM2的表达 及临床意义
林萍,邓涛,叶彦,汪维波,刘苗,罗和生
论著·基础
人结直肠癌组织中mTOR、HIF-1α、PKM2的表达 及临床意义
林萍,邓涛,叶彦,汪维波,刘苗,罗和生
目的 观察人体结直肠癌组织中哺乳动物雷帕霉素靶蛋白(mTOR)、低氧诱导因子-1α(HIF-1α)和酪氨酸激酶M2(PKM2)的表达,并探讨其临床意义。方法 外科手术及纤维结肠镜切除并经病理确诊的结直肠癌标本87例为结直肠癌组,正常结直肠组织30例为正常结直肠组,运用免疫组化方法检测其mTOR、HIF-1α、PKM2的表达。结果 结直肠癌组mTOR、HIF-1α及PKM2的平均光密度值均显著高于正常结直肠组(分别为5 165.6±391.8vs. 1 215.8±153.4,4 474.4±255.9vs. 1 633.0±115.6,9 736.0±128.7vs. 4 031.8±477.1,P<0.05)。结直肠癌患者不同性别、年龄、分化程度下mTOR、HIF-1α及PKM2表达率无统计学差异(P>0.05);不同Dukes分期和淋巴转移下mTOR、HIF-1α及PKM2的表达率有统计学差异(P<0.05);不同浸润深度下mTOR和PKM2的表达率有统计学差异(P<0.05),而HIF-1α表达率差异无统计学意义(P>0.05)。结直肠癌组织中mTOR与HIF-1α、PKM2蛋白间呈正相关(r=0.247、0.512,P<0.05),且HIF-1α与PKM2亦呈正相关(r=0.568,P<0.05)。结论 人体结直肠癌组织中mTOR、HIF-1α及PKM2的相对表达量均显著高于非肿瘤人群,且其表达与结直肠癌的增殖转移相关,可作为结直肠癌靶向治疗作用位点。
结直肠癌;酪氨酸激酶;雷帕霉素靶蛋白;低氧诱导因子-1α;免疫组化
【DOI】 10.3969 /j.issn.1671-6450.2015.04.015
结直肠癌是常见的恶性肿瘤之一,具有较高的发病率及病死率[1,2]。目前大部分结直肠癌虽可进行手术治疗,却无法明确改善治疗效果和预后。结直肠癌的转移是影响其治疗效果及预后的重要因素。结直肠癌细胞的快速增殖、侵袭和转移与其独特的能量代谢密切相关[3],即正常的细胞只有在缺氧的条件下才进行糖酵解,而肿瘤细胞即使在有氧的条件下也优先进行糖酵解,消耗葡萄糖,产生乳酸,这就是Warburg效应[4]。Warburg效应在胚胎细胞及恶性肿瘤细胞中发生,有研究表明部分肿瘤细胞利用有氧糖酵解合成的三磷酸腺苷(ATP)可达到总量的60%[5]。肿瘤细胞利用Warburg效应来获取足够的能量及其他生物大分子,因此干扰这一效应是治疗肿瘤的新方向。研究肿瘤细胞糖酵解相关蛋白的表达,探讨其在结直肠癌早期发现、动态监测、疗效评价及预后评估上的作用是目前研究的焦点所在。本研究主要采用免疫组织化学技术检测糖酵解相关蛋白mTOR、HIF-1α及PKM2在结直肠癌组织中的表达,以探讨其在结直肠癌增殖、侵袭和转移过程中的意义。
1 材料与方法
1.1 标本来源 2013年1—12月武汉大学人民医院胃肠外科结直肠癌患者手术切除、并经病理确诊的结直肠癌标本87例作为结直肠癌组,纳入研究的全部患者术前均未进行放疗、化疗及生物治疗。男47例,女40例, 平均年龄(58.2±11.1)岁。(1)浸润深度:黏膜下层或肌层20例,浆膜层或浆膜外层67例;(2)分化程度:高分化26例,中分化53例,低分化8例;(3)淋巴结转移:有淋巴结转移者42例,无淋巴结转移者45例;(4)肿瘤Dukes分期:A期17例,B期29例,C期39例,D期2例。另外从武汉大学人民医院消化内镜中心收集纤维结肠镜活检标本中正常结直肠黏膜组织30例,作为正常结直肠组。
1.2 主要试剂 mTOR (7C10) Rabbit mAb、Hydroxy-HIF-1α (Pro564) Rabbit mAb及PKM2 (D78A4) XP®Rabbit mAb单克隆抗体均购自Cell Signaling Technology公司,免疫组化SP试剂盒及DAB显色剂均购自武汉博士德公司。
1.3 mTOR、HIF-1α、PKM2检测方法 采用免疫组化法进行检测:标本收集后即进行分类整理,先将组织标本浸入10%福尔马林溶液中进行器官组织的固定,3 d后取出固定好的组织进行石蜡包埋、4 μm连续切片。石蜡切片经过常规脱蜡、水化,微波加热修复抗原,试剂盒A液100~400 μl封闭非特异性抗原,室温下处理1 h,移走封闭液再加入100~400 μl稀释后的一抗在4℃冰箱中孵育过夜;再滴加稀释后的二抗(100~400 μl) 室温孵育30 min;以上各步骤均用0.01 mol/L、pH 7.4 PBS缓冲液振洗5 min×3次;加DAB显色,于显微镜下观察,蒸馏水终止,苏木精复染10 s,蒸馏水冲洗,梯度乙醇脱水,二甲苯透明,树胶封片。以PBS取代一抗作阴性对照,用已知阳性对照图片作阳性对照。
1.4 结果判断 Olympus BX50系统显微镜(日本奥林巴斯公司)下观察染色结果,细胞浆、胞膜或胞核中见棕黄色染色颗粒者即为阳性细胞。每组每个指标随机抽取20例样本进行分析,每个样本显微镜下随机选择4~6个高倍视野(×200) 进行拍照,应用Media Cybernetics公司的Image-Pro Plus图像分析软件分析评价光密度值(optical density average)并配对比较其差异。

2 结 果
2.1mTOR、HIF-1α、PKM2的表达mTOR阳性染色表现为棕黄色颗粒弥漫性分布于整个胞浆,结直肠癌组织的平均光密度值为(5 165.6±391.8),正常结直肠黏膜组织为(1 215.8±153.4);HIF-1α阳性染色主要表现为胞质或胞核为棕黄色,于肿瘤坏死明显处和肿瘤浸润边缘的表达量明显增多,结直肠癌组织的平均光密度值为(4 474.4±255.9),正常结直肠黏膜组织为(1 633.0±115.6);PKM2阳性染色主要表现为棕黄色颗粒弥漫性分布于整个胞浆或呈线性分布于核膜周边,结直肠癌组织的平均光密度值为(9 736.0±128.7),正常结直肠黏膜组织为(4 031.8±477.1)。mTOR、HIF-1α及PKM2在结直肠癌组织表达的平均光密度值均显著高于正常结直肠组织(P<0.05)。见表1。图1,2见封3。
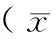
表1 mTOR、HIF-1α及PKM2在结直肠癌和正常 结直肠组织中的平均光密度值±s)
2.2mTOR、HIF-1α和PKM2在结直肠癌组织中表达与临床特征之间的关系 将结直肠癌患者依据性别、年龄、有无淋巴转移、浸润深度、分化程度及分期等临

表2 结直肠癌不同临床特征下mTOR、HIF-1α、PKM2表达率的比较 [例(%)]
床特征进行分组,结果发现结直肠癌患者在不同性别、年龄及分化程度下mTOR、HIF-1α和PKM2的表达率无统计学差异(P>0.05);在不同Dukes分期、淋巴转移下mTOR、HIF-1α和PKM2的表达率差异有统计学意义(P﹤0.05);不同浸润深度下mTOR、PKM2的表达率有统计学差异(P﹤0.05),而HIF-1α的表达率无统计学差异(P>0.05)。见表2。
2.3mTOR、HIF-1α和PKM2蛋白表达的相关性分析 结直肠癌组织中mTOR与HIF-1α和PKM2蛋白间呈正相关(r=0.247、0.512,P﹤0.05),且HIF-1α与PKM2亦呈正相关(r=0.568,P<0.05)。
3 讨 论
20世纪20年代生物化学家Warburg首次提出了存在于肿瘤细胞中的特殊代谢方式,即使在有氧的条件下也优先进行糖酵解,消耗葡萄糖、产生乳酸,而正常的细胞在氧气充足的情况下会进行葡萄糖的有氧氧化来获取能量,仅仅于缺氧的条件下才进行糖酵解,即Warburg效应,由此引起了有关肿瘤代谢机制方面研究的热潮[6]。
mTOR是磷脂酰肌醇激酶相关激酶超家族的一员,作为丝/苏氨酸激酶而起作用,其底物主要是控制与细胞生长和增殖密切相关的一系列蛋白的合成[7]。mTOR是调控细胞生长信号和调节细胞周期的汇聚点,集聚了来自于细胞内外的营养、能量、生长因子和环境调节信号,通过其下游的效应器调控细胞的生长,调节周期进程,并在细胞分化及凋亡方面起控制作用[8,9]。在肿瘤的发生发展过程中,与mTOR相关的信号通路被过度激活,引起细胞周期调节失控,进而对细胞转化和肿瘤进展进行调控[10]。在多种肿瘤中(包括肾癌、胃癌和肝癌等)mTOR过度表达[11],抑制mTOR表达及其介导的信号通路现已成为肿瘤监测和治疗的热点。本结果发现mTOR在结直肠癌组织中的表达明显高于正常结直肠黏膜组织,表明mTOR在结直肠癌的发病过程中起重要作用;且mTOR的高表达与肿瘤浸润深度、淋巴转移和临床分期均显著相关,提示mTOR的高表达与结直肠癌的进展高度相关。
在多数肿瘤细胞中,HIF-1α和部分糖酵解关键酶的表达都是升高的,HIF-1α可调控一些与缺氧反应有关的基因,以及与糖酵解反应有关的关键酶,如醛缩酶A、丙酮酸激酶、磷酸甘油酸激酶1等的表达,但调节的具体机制目前尚不清楚[12,13]。一般情况下,HIF-1α只有在缺氧的条件下才会上调以适应和调节机体的应激反应,而过度活化的mTOR在氧气充足的条件下也可从转录水平激活HIF-1α的表达[14,15]。HIF-1α的表达发生于结直肠癌增殖、侵袭和转移的全过程,通过增加肿瘤细胞对组织低氧和低能量物质供应的适应能力,从而促进结直肠癌的发生与发展[16]。此次实验发现HIF-1α在结直肠癌组织中的表达量与正常结直肠黏膜组织比较,差异有统计学意义,且HIF-1α的表达与肿瘤的临床分期、淋巴转移显著相关,表明HIF-1α在结直肠癌的发生发展中扮演重要的角色。
PKM2是一种丙酮酸激酶同工酶,表达于人体生长发育过程中的胚胎期,然而其在增殖旺盛的细胞,如肿瘤细胞中会再次表达。PKM2的高表达调控着肿瘤细胞选择有氧糖酵解的代谢方式,并且其在肿瘤的生长过程中起着至关重要的作用[17~19]。PKM2是PKM前体RNA选择性剪切的产物,有报道发现在PKM选择性剪切的过程中,c-Myc介导的hnRNPs蛋白表达增加后下调PKM1的表达,上调PKM2的表达[20]。此外,mTOR通路可激活c-Myc和HIF-1α,进而上调PKM2的表达。本研究发现PKM2在结直肠癌组织中的表达量明显高于正常结直肠黏膜组织,且PKM2的表达与结直肠癌的临床分期、浸润深度和淋巴转移显著相关,显示PKM2在结直肠癌的发生、发展过程中起着重要作用。
有研究发现mTOR通路过度活化后产生低氧效应,上调HIF-1α的表达,HIF-1α通过介导的选择性剪切使PKM2表达量上调,高水平的PKM2进一步介导Warburg效应的发生[21]。这一发现中的mTOR/HIF-1α/PKM2糖酵解级联反应为肿瘤发生与发展所必需,目前认为mTOR信号通路的激活是多数肿瘤中发生Warburg效应的主要原因。
综上所述,mTOR/HIF-1α/PKM2糖酵解级联反应中的各个蛋白分子在结直肠癌的发生发展中具有重大意义,且相关性分析表明mTOR/HIF-1α/PKM2之间存在一定的交互关系,3种蛋白在结直肠癌细胞发生发展过程中互相联系,并与其他相关的信号通路交织而促进肿瘤细胞生长、浸润、侵袭及转移。临床检测体液或病变组织中mTOR、HIF-1α、PKM2的表达量,对于结直肠癌早期发现、动态监测、疗效评价及预后评估具有重要临床指导意义,并可作为结直肠癌治疗的新的作用靶点。
1JemalA,BrayF,CenterMM,etal.Globalcancerstatistics[J].CACancerJClin,2011,61(2):69-90.
2WangJS,LiuLQ,QiuHJ,etal.Ursolicacidsimultaneouslytargetsmultiplesignalingpathwaystosuppressproliferationandinduceapoptosisincoloncancercells[J].PLoSOne,2013,8(5):e63872.
3CairnsRA,HarrisIS,MakTW.Regulationofcancercellmetabolism[J].NatRevCancer,2011,11(2):85-95.
4WarburgO.Ontheoriginofcancercells[J].Science,1956,123(3191):309-314.
5GilliesRJ,GatenbyRA.Hypoxiaandadaptivelandscapesintheevolutionofcarcinogenesis[J].CancerMetastasisRev,2007,26(2):311-317.
6BayleyJP,DevileeP.Thewarburgeffectin2012[J].CurrOpinOncol,2012,24(1):62-67.
7WeichhartT,SaeemannMD.ThePI3K/Akt/mTORpathwayininnateimmunecells:emergingtherapeuticapplications[J].AnnRheumDis,2008,67(3):70-74.
8WeichhartT,CostantinoG,PoglitschMA,etal.TheTSC-mTORsignalingpathwayregulatestheinnateinflammatoryresponse[J].Immunity,2008,29(4):565-577.
9WalidS,EisenR,RatcliffeDR,etal.ThePI3-kinaseandmTORsignalingpathwaysareimportantmodulatorsofepithelialtubuleformation[J].JCellPhysiol,2008,216(2):469-479.
10ChanS.Targetingthemammaliantargetofrapamycin(mTOR):anewapproachtotreatingcancer[J].BrJCancer,2004,91(8):1420-1424.
11KremerCL,KleinRR,MendelsonJ,etal.ExpressionofmTORsignalingpathwaymarkersinprostatecancerprogression[J].Prostate,2006,66(11):1203-1212.
12AhnJE,ZhouX,DowdSE,etal.Insightintohypoxiatoleranceincowpeabruchid:metabolicrepressionandheatshockproteinregulationviahypoxia-induciblefactor1[J].PLoSOne,2013,8(4):57267-57277.
13MedjkaneS,PerichonM,MarsolierJ,etal.TheileriainducesoxidativestressandHIF1αactivationthatareessentialforhostleukocytetransformation[J].Oncogene,2014,33(14):1809-1817.
14BrugarolasJB,VazquezF,ReddyA,etal.TSC2regulatesVEGFthroughmTOR-dependentand-independentpathways[J].CancerCell,2003,4(2):147-158.
15XuQ,BriggsJ,ParkS,etal.Targetingstats3blocksbothHIF-1andVEGFexpressioninducedbymultipleoncogenicgrowthsignalingpathways[J].Oncogene,2005,24(36):5552-5560.
16RankinEB,GiacciaAJ.Theroleofhypoxia-induciblefactorsintumorigenesis[J].CellDeathDiffer,2008,15(4):678-685.
17HeidenMG,LocasaleJW,SwansonKD,etal.Evidenceforanalternativeglycolyticpathwayinrapidlyproliferatingcells[J].Science,2010,329(5998):1492-1499.
18ChristofkHR,VanderHeidenMG,WuNA,etal.PyruvatekinaseM2isaphosphotyrosine-bindingprotein[J].Nature,2008,452(7184):U27-181.
19MazurekS.PyruvatekinasetypeM2:Akeyregulatorofthemetabolicbudgetsystemintumorcells[J].InterJBioch&CellBiol,2011,43(7):969-980.
20DavidCJ,ChenCJ,AssanahM,etal.HnRNPproteinscontrolledbyc-MycderegulatepyruvatekinasemRNAsplicingincancer[J].Nature,2010,463(7279):364-368.
21 孙倩.M2型丙酮酸激酶(PKM2)在肿瘤代谢和发生中的作用[J].基础医学与临床,2012,32(5):462-467.
医学论文中有关实验动物描述的要求
在医学论文的描述中,凡涉及到实验动物者,在描述中应符合以下要求:(1)品种、品系描述清楚;(2)强调来源交待;(3)遗传背景;(4)微生物学质量;(5)明确体质量;(6)明确等级;(7)明确饲养环境和实验环境;(8)明确性别;(9)有无质量合格证;(10)有对饲养的描述(如饲料类型、营养水平、照明方式、温度要求、湿度要求);(11)所有动物数量准确;(12)详细描述动物的健康状况;(13)对动物实验的处理方式有单独清楚的交代;(14)全部有对照,部分可采用双因素方差分析。
Expression of mTOR, HIF-1α and PKM2 in human colorectal cancer tissues
LINPing,DENGTao,YEYan,WANGWeibo,LIUMiao,LUOHesheng.
DepartmentofGastroenterology,RenminHospitalofWuhanUniversity,Wuhan430060,China
DENGTao,E-mail:dengtao1120@hotmail.com
Objective To observe the expression of mammalian target of rapamycin observation of human colorectal cancer tissues (mTOR), hypoxia inducible factor 1 alpha (HIF-1α) and tyrosine kinase M2 (PKM2), and to explore its clinical significance.Methods 87 specimens of colorectal cancer after surgical operation and colonoscopic resection were enrolled as colorectal cancer group, 30 cases of normal colorectal tissues were enrolled as normal colorectal cancer group, the expression of immunohistochemistry method was used to detect the mTOR, HIF-1α, PKM2.Results The average optical density of mTOR, HIF1α and PKM2 in colorectal cancer group were significantly higher than that in normal colorectal cancer group (1 215.8±153.4 vs. 5 165.6±391.8, 1 633±115.6 vs. 4 474.4 ±255.9, 4 031.8±477.1 vs. 9 736±128.7, respectively,P<0.05).underdifferentgender,age,thedegreeofdifferentiation,mTOR,HIF-1αandPKM2expressionrateshowednosignificantdifference(P>0.05);theexpressionofdifferentDukesstagesandlymphnodemetastasisofmTOR,HIF-1αandPKM2wasstatisticallysignificant(P<0.05);underdifferentdegreeofinvolvement,expressionofmTORandPKM2wasstatisticallysignificantdifferent(P<0.05),andHIF-1αexpressionshowednosignificantdifference(P>0.05).MTORincolorectalcancerwaspositivecorrelatedwithHIF-1α,PKM2protein(R=0.247,R=0.512,P<0.05),andHIF-1αwaspositivelycorrelatedwithPKM2 (r=0.568,P<0.05).Conclusion The relative expression of mTOR, HIF-1α and the amount of PKM2 in human colorectal carcinoma was significantly higher than non-oncology population, and its expression is associated with colorectal cancer proliferation and metastasis, and can be used as targeted therapy for colorectal cancer action site.
Colorectal cancer; Tyrosine kinase; Target of rapamycin; Hypoxia inducible factor 1α;Immunohistochemistry
湖北省自然科学基金项目资助项目(No.2011CHB024)
430060 武汉大学人民医院消化内科/消化系统疾病湖北省重点实验室
邓涛,E-mail:dengtao1120@hotmail.com
2015-01-08)

