草药抑制癌性疼痛研究进展
罗 淦,陆 锦,李荣亨,骆云鹏(.江西中医药大学护理学院0级本科生,江西 南昌 000;.重庆植恩药业有限公司质量管理部,重庆 0009;.重庆医科大学第一附属医院中医科,重庆 000;.重庆医科大学病理生理学教研室,重庆 0006)
草药抑制癌性疼痛研究进展
罗淦1,陆锦2,李荣亨3,骆云鹏4
(1.江西中医药大学护理学院2012级本科生,江西南昌330004;2.重庆植恩药业有限公司质量管理部,重庆400039;3.重庆医科大学第一附属医院中医科,重庆400042;4.重庆医科大学病理生理学教研室,重庆400016)
[摘要]目的:归纳并综述国内外镇痛作用显著的草药在治疗癌性疼痛中的研究进展。方法:利用PubMed在线搜索“herbal”、“analgesia”、“antinociceptive”和“cancer pain”等关键词,筛选符合本文综述范围的文献进行分析。结果:不少有清热解毒、活血化瘀、解热镇痛功效的中草药均有共同的镇痛活性成分,如黄酮类化合物、生物碱和甾醇等;主要通过抑制机体的伤害性化学物质分泌,阻碍痛觉信号传导,降低疼痛感受器对伤害性刺激的敏感性等机制,达到治疗癌性疼痛的目的。结论:探明草药(包括中草药)抑制癌痛的作用机制,对临床合理选用效果显著且毒副作用小的止痛植物药具有重要意义。
[关键词]镇痛;草药;疼痛;机制
[Abstract]Objective:To review research progress of Chinese herbal medicine with significant analgesic effect in the treatment of cancer pain at home and abroad. Method:PubMed was employed to search for “herbal”,“analgesia”,“antinociceptive”,“cancer pain” and other relative words,then discussed and summarized the search results eligible for this review. Result:The majority of herbal medicine with clearing and detoxifying,promoting blood circulation and removing blood stasis,antipyretic and analgesic effect has analgesic active ingredients in common,such as flavonoids,alkaloids,sterols and so on. In addition, inhibiting the secretion of harmful chemicals,hindering the transmission of pain signals,decreasing the nociceptive sensitivity of pain receptors in the treatment of cancer pain may be the primary mechanisms. Conclusion:Establishing the mechanism of inhibiting cancer herbs is advantageous for judicious use of effective herbal medicine with fewer toxic side effects in clinical medication.
[Key Words]Analgesia;Herbs;Pain;Mechanism
临床上,疼痛为癌症患者最常见的并发症,贯穿患癌、治疗到预后整个过程。癌性疼痛(cancer pain)严重影响其病情发展与生命质量。临床上约75%的癌性疼痛由疾病本身引起[1],其余的大部分归因于诊断和治疗过程。目前,WHO推广的“三阶梯药物止痛法”仍被广泛用于治疗癌性疼痛,然而这些药物所致毒副作用又成为患者的新困扰。因此,研究探寻镇痛作用显著且副作用更小的药物,一直是癌症治疗领域亟待解决的难题。
欧盟委员会于2009年开展抗癌治疗调查活动[2]。结果显示,在符合纳入标准的47所治疗中心反馈的疗法中,补充和替代药物法(CMA)使用更频繁。在这47所机构中,26所采纳针灸治疗,19所采用顺势疗法,18所采用中草药治疗,17所采纳中医疗法,10所采纳人智学,6所采纳同类毒学,30所还辅助采用了其他疗法。这些疗法主要针对减少不良反应,放疗化疗,尤其是恶心、呕吐和白细胞减少。此外,CAM也用于缓解疼痛和疲劳(10.9%),减少医源性更年期的副作用(8.8%)和改善焦虑和抑郁(5.9%)、胃肠道疾病(5%)、睡眠障碍和神经病变(3.8%)。中草药治疗癌痛潜力巨大。
1 植物药缓解癌性疼痛的作用机制
中国中医科学院苏凤哲认为,癌性疼痛的病机大致分为两类:即实证的“不通则痛”和虚证的“不荣则痛”。癌肿压迫筋脉,致筋脉瘀阻,气机不畅,故“不通则痛”。癌症消耗机体气血阴阳,致正气虚弱经脉失养,故“不荣则痛”。国内著名肿瘤专家张明曾指出:具有活血化瘀、温经补益或行气之效的植物药,可用于治疗甚至预防癌性疼痛的产生。疼痛与个人主观感受有关,诸多实验证明具有养心安神解郁之效的植物药可提高痛阈;在发现致痛原因之前,某些中药能预防血栓的发生,防止组织缺氧,防患于未然如中药五灵脂、薤白有促纤溶作用,蒲黄、血竭有抗血小板聚集作用,苏木、急性子有抗血栓形成作用,丹参、川芎有降低血黏度,促进组织灌流的作用(见表1)。
2 可治疗癌性疼痛的植物药
2.1国内中草药
三七。三七为五加科植物三七的干燥根和根茎;味甘,性微温;被誉为伤科要药,化瘀止血且不留瘀。其主要成分为三七总皂苷(PNS)。《本草纲目》指出,三七有“止血散血定痛”之功效。杨帆等[3]通过实验证实PNS有一定镇痛作用。镇痛机制主要有三:发挥阿片肽受体激动剂的作用,且不具成瘾性[4];显著抑制星形胶质细胞活化,减少反应性星形胶质细胞释放的促炎性因子和神经营养因子的释放[5],因神经营养因子可以明显加强N-甲基-D-天冬氨酸受体(NMDA)介导的中枢敏化作用[6];调节神经元功能,抑制痛觉过敏和中枢敏化。黄瑾等[7]研究发现,人参皂苷Rb1可显著抑制细胞内Ca2+内流,干预瞬时感受器电位香草酸受体(TRPVI)介导的核因子活化,降低白介素和前列腺素PGE2的分泌,而PGE2能增加低伤害性感受器的敏感度并降低其活化阈值。
延胡索。本品为罂粟科、紫堇属多年生草本植物延胡索之块茎,味辛、苦,性温。《本草纲目》谓其“活血,利气,止痛,通小便。延胡索,能行血中气滞,气中血滞,故专治一身上下诸痛,用之中的,妙不可言。”延胡索的有效成分左旋四氢巴马亭(L-THP)既可阻断多巴胺受体(D1、D2),增强中枢内阿片肽功能;又可改变体内Ca2+的流动,抑制神经元异位自发放电。有研究报道指出,延胡索中的镇痛活性成分——去氢紫堇球碱(DHCB)并不通过刺激阿片受体发挥作用,而是通过抗多巴胺D2受体达到镇痛效果[8]。
双肾藤。本品亦称羊蹄甲,为豆科羊蹄甲属植物鄂羊蹄甲的根茎叶,味苦、性平(《四川中药志》谓之“性温,味苦涩,无毒”),可清热利湿,消肿止痛。实验研究发现,双肾藤并不作用于阿片受体,其镇痛机制可能涉及cGMP通路和ATP-敏感K+通道,激动阿片受体产生中枢镇痛效应;此外,双肾藤的镇痛活性成分最有可能为富含黄酮类化合物,并认为双肾藤是非阿片类镇痛药的潜在首选品[9]。有报道指出,黄酮类化合物不但能抑制血小板凝聚、脂肪氧化酶活性和环加氧酶,抑制毛细管脆性和渗透性,还具有抗菌、抗病毒、消炎、抗过敏和扩张血管等多重药理作用[10,11]。
莲子草。亦称满天星、水牛膝,为苋科莲子草属植物莲子草的全草,味微甘、淡,性凉,有散瘀消毒、清火退热之效。莲子草有利尿、补血、抗氧化、抗炎、解热、抗溃疡、抗菌和敛创等诸多特性[12,13]。在孟加拉国等南亚国家,莲子草被广泛用于治疗风湿痛、伤口肿胀、疟疾等诸多病症,有镇痛功效[14]。Mondal H等[15]研究发现,莲子草提取物通过作用于对乙酸敏感的内脏受体,抑制前列腺素等疼痛递质的释放,明显减少小鼠扭体次数。莲子草具有中枢及外周镇痛活性,因其含有黄酮类化合物、羽扇豆醇及生物碱等多种具有镇痛活性的成分。Margareth B C Gallo等[16]证实羽扇豆醇通过抑制IL-4,IL-5和IL-13产生镇痛活性。
乌头。本品维西乌头,为毛茛科乌头属植物乌头之一种,母根称乌头,为镇痉剂,冶风庳,风湿神经痛;侧根(子根)名附子,有回阳、逐冷、祛风湿作用。味辛、苦,性热,有大毒,用之宜慎。维西乌头产于云南省维西傈僳族自治县,为当地百姓治疗风湿痛的常用药。维西乌头的有效镇痛成分为具有镇痛、抗炎、强心和抗心律失常活性的二萜和三萜生物碱。维西乌头与其他乌头属显著不同在于毒性方面,通过对新C18二萜生物碱的结构分析发现,其镇痛活性源自8-O-ethylaconosine。有临床观察显示川产乌头制成的注射液疗效显著,不但能缓解胃癌、肝癌患者的消化道症状,而且还有明显的镇痛效果,且无毒副作用,不成瘾,疗效优于化疗[17]。乌头用于治疗癌性疼痛有一定优势。
蟾酥。本品为蟾蜍科动物中华大蟾蜍、黑眶蟾蜍的耳后腺及皮肤腺所分泌的白色浆液,经收集加工而成;味辛,性温;有解毒,止痛,开窍醒神之效。在日本,蟾酥作为非处方药(OTC),如“救心”(Kyushin)的一种成分,可有效改善心悸、气促。Inoue E等[18]研究发现,蟾酥的镇痛作用与中枢5-羟色胺神经系统有关,并建议蟾酥可用作三叉神经痛、糖尿病性神经痛以及术后或创伤后疼痛的潜在治疗药物。Vanegas H[19]提出,在神经病理性疼痛中,下行疼痛抑制系统与与中枢5-羟色胺神经系统和中枢去甲肾上腺素神经系统的功能衰减及失衡有关。虽然几乎所有类型的伤害性疼痛可以通过联合使用非甾体类抗炎药或麻醉性镇痛药治疗,但神经病理性疼痛是慢性、顽固性的疼痛,对非甾体类抗炎药、麻醉性镇痛药有拮抗作用,而蟾酥则对神经病理性疼痛有独特疗效。
木姜子。本品亦称山苍子、山鸡椒,为樟科木姜子属植物的全草;性辛,微苦,温;有理气散结,解毒消肿止血之功效。Koo HJ等[20]研究发现,日本木姜子果实的镇痛抗炎作用通过抑制NF-κB和κJNK、p38 MAPK活化来实现,而从木姜子果实提取物中分离出的两种内酯hamabiwa A和hamabiwa B所具有的抗炎及强镇痛活性也与镇痛不无联系。同许多有镇痛作用的草药一样,木姜子也含有能抑制疼痛递质分泌的黄酮类化合物和生物碱。
胡卢巴。本品亦称芦巴子,为豆科植物胡卢巴的干燥成熟种子;性温,味苦;有温肾助阳,散寒止痛之效;芦巴子油可催乳。在19世纪的美国,胡芦巴已用于治疗痛经,还普遍用于抗胃肠道系统的解痉。Vyas S等[21]证实芦巴子具有抗炎与镇痛作用。Younesy S等[22]研究认为,胡卢巴通过作用于5-羟色胺系统以实现镇痛,并有证据表明其提取液无毒作用;芦巴子浆,亦可消肿敛疮与止痛。胡芦巴含有丰富的赖氨酸和色氨酸、黄酮类化合物,也用于治疗治疗痛风、腺炎、肿瘤、创伤诸症。
2.2国际植物药
娑罗双。本品为龙脑香科娑罗双属植物娑罗双娑罗双的叶。在印尼等东南亚地区,以及印度传统医学阿育吠陀医学中,娑罗双叶被广泛用于治疗创伤、溃疡、瘙痒、麻风、淋病、咳嗽及头耳痛等诸疾,其渗出之树脂有收敛、清洁之性能。Wani TA等[23]研究发现,娑罗双提取物显著延长了甩尾试验和热板试验中小鼠对疼痛刺激的反应时间,并认为娑罗双叶提取物有中枢和外周神经系统镇痛作用,既具有抗化学和热致痛的镇痛活性,又可对抗炎症性或非炎症介导的疼痛。
野老鹳草。本品为为牻牛儿苗科老鹳草属植物的墨西哥老鹳草,性辛、苦、平,有祛风收敛、止泻之功效。《滇南本草》记载:“祛诸风皮肤发痒。治筋骨疼痛,痰火痿软,手足筋挛,麻木,利小便,泻膀胱积热,攻散诸疮肿毒,退痨热发烧,治风火虫牙,痘疹疥癞等症。”可见其有清热解毒,镇痛之效。在墨西哥的伊达尔戈州山区,老鹳草为民间常用药,广泛用于治疗发热、疼痛和胃肠道疾病。Küpeli E等[24]证实老鹳草提取物槲皮素糖苷发挥中枢镇痛及抗炎功能。Velázquez-González C等[25]通过多项试验发现,老鹳草提取物鞣花酸、槲皮素发挥外周镇痛及抗炎功能,并认为老鹳草可作为传统医学治疗轻度疼痛的药物。而Moreira AS等[26]证实,老鹳草提取物所含的黄酮类化合物,是优良的抗氧化剂和镇痛药。
牛油果属。本品为山榄科牛油果属植物牛油果树的干燥树皮。牛油果遍布印度,既是观赏树,又是水果及药用植物,有降脂抗炎之效。Yoganarashiman SN[27]和Kirtikar KR等[28]分别在其所著印度药用植物书籍中指出,印度传统医学将牛油果树皮视作收涩、利尿和壮阳药,用其治疗牙科疾病、烧灼、子宫疾病、溃疡、心脏病及发热诸症。Purnima A等[29]利用牛油果树皮的70%乙醇提取物进行大鼠试验研究,观察和分析发现,牛油果乙醇提取物可降低血管通透性,祛湿,抑制肉芽肿的形成;能抑制前列腺素的释放,具有显著的抗炎、解热和镇痛活性。其解热机制,类似对乙酰氨基酚。
迷迭香。本品为唇形科迷迭香属植物迷迭香全草,原属观赏芳香植物,后被广泛用于食品调味。在传统医学中,迷迭香因其解痉功效已被用作止痛剂,用以缓解肾绞痛、痛经及呼吸系统疾病[30]。Ngo SN等[31]分析历年相关文献发现,迷迭香的抗癌特性使癌症发展多个阶段中的分子发生改变,抑制包括结肠、乳腺、肝、胃等多器官在内的肿瘤以及黑色素瘤和白血病细胞的发展;而迷迭香及其活性成分对不同的分子靶点的调制是临床肿瘤化学预防试验成功的有用指标。Raskovic A等[32]通过药物对比实验研究发现,迷迭香精油能在福尔马林试验早期(神经源性疼痛)和晚期(炎性疼痛)产生抑制,其镇痛效果略高于对乙酰氨基酚,但明显低于可待因,迷迭香精油具有中枢镇痛作用。刘晓丽等[33]认为瞬时感受器电位香草酸受体l(TRPVI)是一种非选择性阳离子通道,主要表达在感觉神经元上,属于瞬时感受器电位(TRP)家族成员之一。该受体可被机械性刺激,化学性刺激或内源性配基等激活,介导疼痛的传递,导致机体功能损伤。
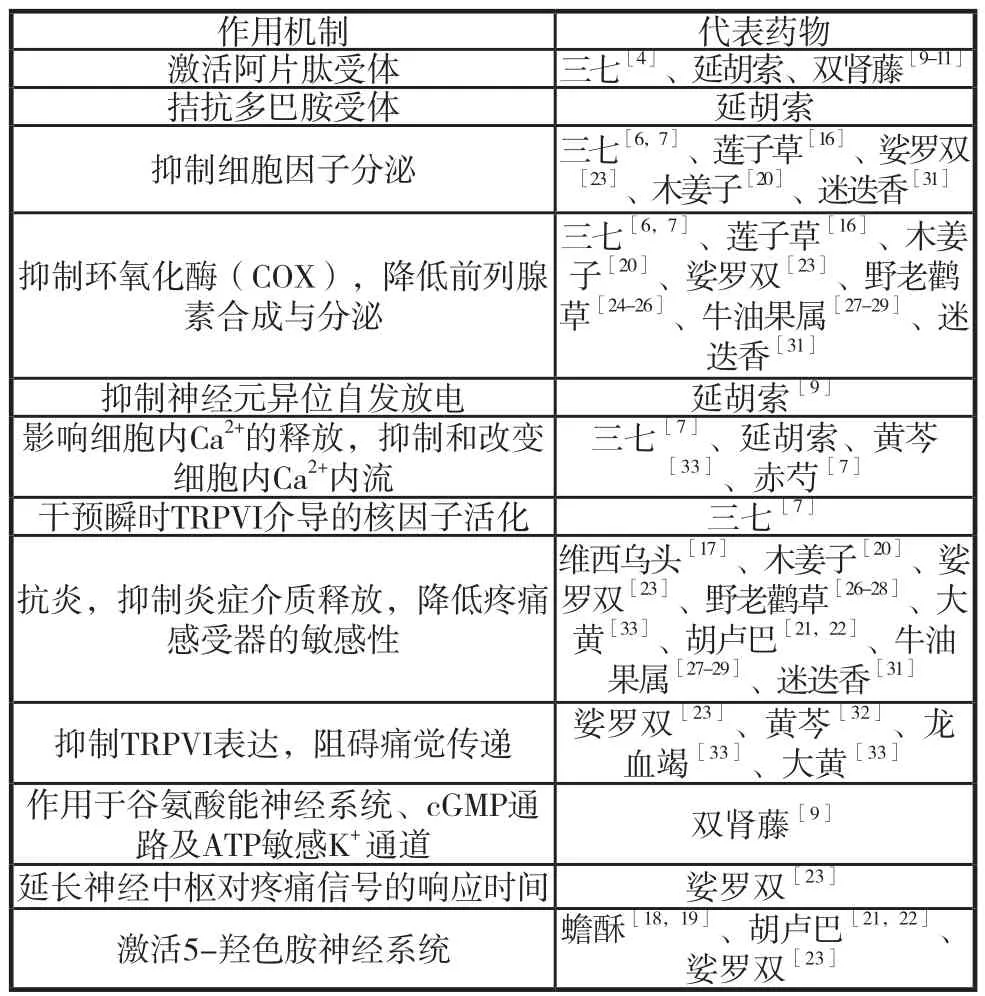
表1 治疗癌痛的中草药的镇痛机制分类
3 小 结
癌性疼痛的产生与化学致痛因子分泌增多、神经对痛觉的敏感性增高及痛阈改变等诸多因素有关。中医认为疼痛的发生机制为“不通则痛”,寒性收引和瘀血阻滞均能导致血脉不通而疼痛,清热解毒中药多数具有抗炎效果,温里药和活血化瘀药具有通畅血脉的作用。因此,无论从抗炎角度或通脉角度,清热解毒药、温里药和活血化瘀药均具有止痛作用。而不少有清热解毒、活血化瘀、解热镇痛功效的草药,含有如黄酮类化合物、甾醇和二萜生物碱等活性成分,可减少疼痛递质的合成与分泌,阻碍神经对痛觉的传递与响应,提高机体的痛阈,可用于临床阻断和缓解癌性疼痛。在中医不断国际化的同时,认可不同国家民族医学,取长补短,更有利于中医中药的发展,更有利于改善癌症患者的病情发展,进一步提高其生命质量。
[参考文献]
[1]Portenoy RK.Treatment of cancer pain[J].The Lancet,2011,377(9784):2236-2247.
[2]Rossi E,Vita A,Baccetti S,et,al.Complementary and alternative medicine for cancer patients:results of the EPAAC survey on integrative oncology centres in Europe[J].Support Care Cancer,2015,23 (6):1795-1806
[3]杨帆,刘红,万炜.三七总皂苷对大鼠扭体模型的镇痛作用[J].中医临床研究,2014,9(6):70-71.
[4]王一菱,陈迪,吴景兰.三七总皂甙抗炎和镇痛作用及其机理探讨[J].中国中西医结合杂志,1994,14(1):35-36.
[5]李花,赵子进,潘丁,等.三七总皂苷对脊髓损伤后的保护作用及GFAP相关机制[J].现代生物医学进展,2010,10(10):1825-1827,1835.
[6]李卉丽,秦绿叶,万有,等.疼痛研究的新亮点:星形胶质细胞[J].生理科学进展,2003,34 (1):45-48.
[7]黄瑾,胡晋红.TRPVl在角质形成细胞释放炎症介质中的作用及药物的干预研究[D].第二军医大学,2009.
[8]Zhang Y,Olivier Civelli,Wang CR,et al.A Novel Analgesic Isolated from a Traditional Chinese Medicine [J].Curr Biol,2014,24(2):117-123.
[9]Xu JL,Zhao QZ,Wei L,et al.Phytochemical Composition and Antinociceptive Activity of Bauhinia glauca subsp.hupehana in Rats[J].PLoS One,2015,10(2):e0117801.
[10]刘安成,李慧,王亮生.石榴类黄酮代谢产物的研究进展[J].植物学报,2011,46(2):129-137.
[11]Roy A,Saraf S.Diuretic activity of Alternanthera sessilis R.Br.Ex DC an ethnomedicine of Chhattisgarh (India)[J].Biosci Biotechnol Res Asia,2008,5(1):369-372.
[12]Arollado EC,Osi MO.Hematinic activity of Alternanthera sessilis (L.) R.BR. (Amaranthaceae) in mice and rats[J]. E-International Scientific Res J,2010,2(2):110-117.
[13]Jalalpure SS,Agrawal N,Patil MB,et al.Antimicrobial and wound healing activities of leaves of Alternanthera sessilis Linn[J].Int J Green Pharm,2008,2(3):141-144.
[14]Tan KK,Kim KH.Alternanthera sessilis Red ethyl acetate fraction exhibits antidiabetic potential on obese type 2 diabetic rats[J].Evid Based Complement Alternat Med,2013,(2):443-458.
[15]Mondal H,Saha S,Awang K,et al.Centralstimulating and analgesic activity of the ethanolic extract of Alternanthera sessilis in mice[J].BMC Complement Altern Med,2014,14:398.
[16]Margareth B C Gallo,bullet Miranda,J Sarachine. Biological activities of lupeol[J].Intl J Biomed Pharma Sci,2009,3(S1):46-66.
[17]Zhao DK,Ai HL,Zi SH,et al.Four new C 18 -diterpenoid alkaloids with analgesic activity from Aconitum weixiense[J].Fitoterapia,2013,91 (8):280-283.
[18]Inoue E,Shimizu Y,Masui R,et al.Analgesic Effects of Toad Cake and Toad-cake-containing Herbal Drugs:Analgesic effects of toad cake[J].J Pharmacopuncture,2014,17(1):74-79.
[19]Vanegas H,Schaible HG.Descending control of persistent pain:inhibitory or facilitatory?[J].Brain Res Brain Res Rev,2004,46(3):295-309.
[20]Koo HJ,Yoon WJ,Sohn EH,et al.The analgesic and anti-inflammatory effects of Litsea japonica fruit are mediated via suppression of NF-κB and JNK/ p38 MAPK activation[J].Int Immunopharmacol,2014,22(1):84-97.
[21]Vyas S,Agrawal RP,Solanki P,et al.Analgesic and anti-inflammatory activities of Trigonella foenumgraecum (seed) extract[J].Acta Pol Pharm,2008,65(4):473-476.
[22]Younesy S,Amiraliakbari S,Esmaeili S,et al.Effects of Fenugreek Seed on the Severity and Systemic Symptoms of Dysmenorrhea[J].J Reprod Infertil,2014,15(1):41-48.
[23]Wani TA,Kumar D,Prasad R,et al.Analgesic activity of the ethanolic extract of Shorea robusta resin in experimental animals[J].Indian J Pharmacol,2012,44(4):493-499.
[24]Küpeli E,Tatli II,Akdemir ZS,et al.Estimation of antinociceptive and antiinflammatory activity of Geranium pretense subsp finitum and its phenolic compounds[J].J Ethnopharmacol,2007,114 (2):234-240.
[25]Velázquez-González C,Cario-Cortés R,Gayosso de Lucio JA,et al.Antinociceptive and antiinflammatory activities of Geranium bellum and its isolated compounds[J].BMC Complement Altern Med,2014,14(1):506.
[26]Moreira AS,Spitzer V,Schapoval EE,et al.Antiinflammatory activity of extracts and fractions from leaves of Gochanatia polymorpha[J].Phytother Res,2000,14(8):638-640.
[27]Yoganarashiman SN.Medicinal plants of India[M]. Bangalore (Karnataka):Srinivasan for interline publishing Pvt Ltd,1996:313.
[28]Kirtikar KR,Basu BD.Indian Medicinal Plants[M].2nd ed.Allahabad:Lalit Mohan Basu,1988:1494.
[29]Purnima A,Koti BC,Thippeswamy AHM,et al.Antiinflammatory,analgesic and antipyretic activities of Mimusops elengi Linn[J].Indian J Pharm Sci,2010,72(4):480-485.
[30]Al-Sereiti MR,Abu-Amer KM,Sen P.Pharmacology of rosemary (Rosmarinus officinalis Linn.)and its therapeutic potentials[J].Indian J Exp Biol,1999,37(2):124-130.
[31]Ngo SN,Williams DB,Head RJ.Rosemary and cancer prevention:preclinical perspectives[J].Crit Rev Food Sci Nutr,2011,51(10):946-954.
[32]Raskovic A,Milanovic I,Pavlovic N,et al.Analgesic effects of rosemary essential oil and its interactions with codeine and paracetamol in mice [J].Eur Rev Med Pharmacol Sci,2015,19 (1):165-172.
[33]刘晓丽,吕翠,张文生.TRPV1与中药止痛作用研究进展[J].中国中药杂志,2014,39(10):1757-1760.
[收稿日期]2015-07-24
[通讯作者]陆锦
[中图分类号]R285.5
[文献标识码]A
[文章编号]1004-2814(2015)12-1200-04

