丙酮酸乙酯对肝细胞氧化应激损伤的保护作用及其机制研究
王浩 何义舟 罗哲
(复旦大学附属中山医院麻醉科,上海 200032)
·论著·
丙酮酸乙酯对肝细胞氧化应激损伤的保护作用及其机制研究
王浩何义舟罗哲
(复旦大学附属中山医院麻醉科,上海200032)
摘要目的:探讨丙酮酸乙酯在肝细胞氧化应激损伤中的作用及机制。方法:通过对人肝细胞系L-02进行缺氧/复氧处理各1 h建立氧化应激损伤模型。将L-02根据干预措施分为对照组(Control组)、乳酸钠林格液组(LR组)、丙酮酸乙酯组(EP组)。应用日本日立公司7020 全自动分析仪检测细胞培养上清液中天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)和丙氨酸氨基转移酶(alanine aminotransferase,ALT)浓度;采用Hoechst 33342/碘化丙啶双标记荧光染色以及原位缺口末端标记法(TUNEL)检测各组细胞的凋亡和坏死情况;采用蛋白质印迹(Western blotting)法检测各组caspase-9、caspase-3与多聚二磷酸腺苷核糖聚合酶(PARP)蛋白的表达;采用荧光素发光法测量各组肝细胞内ATP浓度。结果:EP组细胞培养上清液中AST和ALT浓度均低于Control组和LR组(P<0.05);EP组坏死细胞比例低于Control组和LR组(P<0.05),但凋亡细胞比例高于Control组和LR组(P<0.05)。EP组活化形式的caspase-9、caspase-3与PARP蛋白表达水平高于Control组和LR组(P<0.05)。EP组细胞内ATP浓度显著高于Control组和LR组(P<0.05)。结论:EP对肝细胞氧化应激损伤有保护作用,能减少坏死细胞数量,增加凋亡细胞数量,改变坏死及凋亡细胞比例。EP的细胞保护作用机制可能在于改善能量代谢,提高细胞内ATP浓度,激活“凋亡/坏死共同通路”,激活凋亡过程。
关键词氧化应激损伤;坏死;凋亡;丙酮酸乙酯
肝脏的缺血再灌注损伤(ischemia-reperfusion injury,IRI)的致病机制主要有:Kupffer细胞和内皮细胞的活化、氧自由基富集、钙超载、炎性介质活性增加和线粒体功能失常等[1-6]。目前对IRI的主要干预措施是采用自由基清除剂、血红素氧化酶、缺血预处理与后处理、热休克蛋白等。然而,大多数干预措施尚处于实验阶段,可供临床应用的IRI预防和治疗措施有限。
丙酮酸既是糖酵解的终末产物,又是三羧酸循环(tricarboxylic acid cycle,TCA)的起始底物,还具备清除细胞内活化氧自由基(reactive oxygen species,ROS)H2O2和OH-的作用[3]。然而,丙酮酸水溶液极其不稳定,易生成副丙酮酸(parapyruvate),该物质是TCA的抑制剂,从而影响了丙酮酸在临床上的应用。酯化后的丙酮酸,即丙酮酸乙酯(ethyl pyruvate,EP),克服了丙酮酸水溶液不稳定的缺点,还具备丙酮酸的抗氧化作用,成为近年来研究较多的细胞保护物质[4]。多项研究[5-6]指出,EP在出血性休克、脓毒血症、烧伤、急性胰腺炎、放射性损伤和脑IRI等损伤中发挥细胞保护作用。研究[7-8]证实,EP可通过多环节、多通路发挥细胞保护作用,主要包括抑制氧化还原反应、清除氧自由基和抑制核因子κB(nuclear factor κB,NF-κB)或JAK/STAT等相关的炎性反应通路。EP作为新一代晶体复苏液体中阴离子的重要组成成分,替代了临床常用的乳酸钠林格液。但目前研究尚未验证EP对肝细胞的保护作用。因此,本研究将EP应用于肝脏L-02细胞缺氧/复氧损伤模型中,研究EP对肝脏氧化应激损伤的保护作用及可能的机制。
1资料与方法
1.1材料无糖及含糖RPMI-1640培养液(含糖RPMI-1640培养液与无糖培养液按1∶80体积比混匀得低糖培养液)、0.25%胰蛋白酶购自美国Invitrogen公司;特级胎牛血清购自美国Hyclone公司;缺氧装置购自美国Billups-Rothenberg 公司;“95% N2+5% CO2”混合气体与“95% O2+5% CO2”混合气体购自中国科学院上海有机化学研究所;EP、Hoechst33342(HO)与碘化丙啶(propidium iodide,PI)购自美国Sigma公司;原位缺口末端标记法(TUNEL)凋亡检测试剂盒购自瑞士罗氏公司;caspase-3、caspase-9、多聚二磷酸腺苷核糖聚合酶(PARP)抗体购自美国CST公司;ATP检测试剂盒与丙氨酸氨基转移酶(alanine aminotransferase,ALT)/天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒购自江苏南京建成生物工程研究所。
1.2细胞培养与处理人肝细胞系L-02由复旦大学肝癌研究所提供。用添加胎牛血清的 RPMI-1640 培养液在37 ℃、CO2体积分数为5%、95%湿度条件下培养。
缺氧/复氧模型的建立:将细胞置入无血清低糖RPMI-1640培养液,并放入缺氧装置,充入95% N2+5% CO2混合气体,经出气口水封管溢出,使容器内保持缺氧状态,5 min后关闭进出口,使容器内氧浓度<0.5%。再将容器放入37 ℃恒温箱中,缺氧1 h。然后更换含血清含糖RPMI-1640培养液,以 5 L/min 流量在进气口通入95% O2+5% CO2混合气体,予复氧处理1 h。
分组:根据干预措施分为空白对照组(Control组)、乳酸钠林格液组(LR组)、EP组,每组3个复孔。Control组:更换无血清低糖RPMI-1640培养液时不给予任何干预;EP组:更换无血清低糖RPMI-1640培养液时加入EP,终浓度为2 mmol/L;LR组:更换无血清低糖 RPMI-1640 培养液时加入等同EP组EP体积的乳酸钠林格液。造模后收取各组细胞进行下一步实验。
1.3HO/PI双标记荧光染色检测细胞坏死胰蛋白酶消化细胞后,加入1 mg/mL Hoechst33342染色液20 μL,终浓度为10 μg/mL,37 ℃反应 10 min;继续加入1 mg/mL PI染色液20 μL,终浓度为10 μg/mL,4 ℃反应20 min;将上述细胞悬液滴加在载玻片上,涂抹均匀后于荧光显微镜(日本 Olympus公司)下观察并拍照。
1.4TUNEL法检测细胞凋亡细胞凋亡检测操作流程按照TUNEL试剂盒说明书进行。
1.5蛋白质印迹(Western blotting)法检测caspase-9、caspase-3、PARP蛋白的表达裂解细胞总蛋白后经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离、转膜。5%脱脂牛奶封闭1 h,加入caspase-9、caspase-3与PARP多克隆抗体(1∶1000稀释),一抗4 ℃孵育过夜。加入辣根过氧化物酶标记的羊抗鼠或兔IgG 抗体(1∶2000稀释)后室温孵育1 h。采用电化学发光法进行化学发光并用X光胶片记录条带,通过灰度分析条带的光密度。
1.6ALT和AST浓度测定取细胞培养上清液1 mL,1000 r/min离心10 min,吸取上清液;取50 μL上清液,用HITACHI 7020 全自动分析仪(日本日立公司)检测ALT和AST的浓度。
1.7ATP浓度的检测收取1×106细胞,4000 r/min 离心10 min,取上清液并测定ATP的浓度,具体操作步骤参考试剂盒说明书。
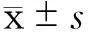
2结果
2.13组肝细胞缺氧/复氧后细胞培养上清液中AST、ALT氨酶浓度的比较EP组细胞培养上清液中AST和ALT浓度均低于LR组和Control组(P<0.05),见图1。
2.23组肝细胞缺氧/复氧后坏死及凋亡细胞比例的变化EP组“HO+/PI-”活细胞比例高于Control组与LR组(P<0.05);EP组“HO+/PI+”坏死细胞比例低于Control组与LR组(P<0.05),见图2A;EP组TUNEL+的凋亡细胞比例高于Control组与LR组(P<0.05),见图2B。
与Control组及LR组比较,*P<0.05

A:HO/PI双染色法,与Control组及LR组比较,*P<0.05;B:TUNEL法

A:Western blotting(内参照GAPDH:甘油醛-3-磷酸脱氢酶);B:活化形式的caspase-3、caspase-9与PARP条带的相对灰度值;与Control组及LR组比较,*P<0.05
图33组肝细胞缺氧/复氧后凋亡相关蛋白表达水平的比较
2.43组肝细胞缺氧/复氧后肝细胞内ATP浓度的比较EP组细胞内ATP浓度为(3.48±0.5)μmol/g,显著高于Control组与LR组[分别为(1.78±0.3)μmol/g和(1.73±0.4)μmol/g],P<0.05。
3讨论
Sims等[9]首先将丙酮酸的酯化衍生物EP应用于肠系膜IRI的动物模型中,发现EP可以缓解小肠黏膜结构和功能的损伤,而且优于等当量的丙酮酸钠溶液。本研究在肝脏L-02细胞体外缺氧/复氧损伤模型中发现,EP干预后可导致细胞上清液中AST和ALT浓度明显下降,提示EP对于肝脏细胞缺氧/复氧损伤有保护作用。EP的细胞保护作用机制主要包括自由基清除作用和抗炎作用[10]。EP的自由基清除作用与其α-酮羧基的结构有关,在对EP的早期研究(如失血性休克、急性肾功能衰竭或肠系膜IRI的模型研究)中均强调了自由基清除作用;而且近期一项研究[11]报道称,在IRI的动物模型实验中,EP较其他含α-酮羧基的物质具有更显著的细胞保护作用,这与其亲脂特性有关。Yang等[6]最早在出血性休克的动物模型中证实了EP的抗炎作用,它能够降低NF-κB等炎性因子的表达。随后的研究[12]证实了EP可以下调各种炎性信号分子的表达,包括JNK和MAPK等。自由基被认为是炎性反应第二信号,调节下游的炎性介质,包括NF-κB、肿瘤坏死因子等。进一步的研究[13-14]提示,EP通过作用于NF-κB的p65亚基而调节NF-κB的作用,降低相关炎性因子的水平。因此,EP的自由基清除特性也是其抗炎作用的重要机制。
本研究发现,EP干预的肝脏L-02细胞缺氧/复氧损伤表现为坏死细胞数量下降、凋亡细胞数量增加,凋亡相关蛋白表达增加。虽然凋亡和坏死都属细胞死亡,但不同的细胞死亡方式对其结局有着不同的意义。一项有关肺癌细胞的体外研究[15]提示,无糖状况下,EP可以减少细胞坏死,同时刺激凋亡通路,使细胞凋亡增多,与本研究结果相一致。
根据“坏死/凋亡学说”,细胞内ATP浓度决定细胞以何种方式死亡。ATP是细胞发生凋亡的必要的能量物质,当ATP明显缺失时,凋亡通路将被抑制,而转向坏死。当细胞内ATP达到正常值的10%~15%时,即可激活caspase-9和caspase-3依赖的凋亡通路[2]。有研究[16]提示,应用果糖提高IRI肝细胞内ATP水平后,能减少细胞死亡,增加凋亡。本研究也发现,EP组肝细胞内的ATP浓度高于对照组和LR组。EP可自由进入细胞内,并分解为丙酮酸,在后者转变为乳酸的同时,使得NADH转化为NAD+,进而提高NAD+/NADH比例水平,有助于糖酵解;EP作为ATP生成的前体物质,可促进TCA,提高细胞内ATP水平。目前在胰岛细胞、心肌细胞、神经细胞等的研究[17-19]中,均证实了EP可以提高细胞内ATP的浓度。
综上所述,本研究通过体外实验发现EP对肝脏L-02细胞缺氧/复氧损伤有保护作用。EP可能通过提高细胞内ATP的浓度而影响“凋亡/坏死共同通路”,激活凋亡过程、减少坏死细胞,进而降低内源性损伤物质的表达,减轻炎性反应,起到细胞保护作用。
参考文献
[1]Jaeschke H.Molecular mechanisms of hepatic ischemia-reperfusion injury and preconditioning[J]. Am J Physiol Gastrointest Liver Physiol,2003,284(1):G15-G26.
[2]Jaeschke H,Lemasters JJ.Apoptosis versus oncotic necrosis in hepatic ischemia/reperfusion injury[J].Gastroenterology,2003,125(4):1246-1257.
[3]Brand KA,Hermfisse U.Aerobic glycolysis by proliferating cells:a protective strategy against reactive oxygen species[J].FASEB J,1997,11(5):388-395.
[4]Fink MP.Ethyl pyruvate[J].Curr Opin Anaesthesiol,2008,21(2):160-167.
[5]Tawadrous ZS,Delude RL,Fink MP.Resuscitation from hemorrhagic shock with Ringer’s ethyl pyruvate solution improves survival and ameliorates intestinal mucosal hyperpermeability in rats[J].Shock,2002,17(6):473-477.
[6]Yang R,Gallo DJ,Baust JJ,et al.Ethyl pyruvate modulates inflammatory gene expression in mice subjected to hemorrhagic shock[J].Am J Physiol Gastrointest Liver Physiol,2002,283(1):G212-G221.
[7]Shen H,Hu X,Liu C,et al.Ethyl pyruvate protects against hypoxic-ischemic brain injury via anti-cell death and anti-inflammatory mechanisms[J].Neurobiol Dis,2010,37(3):711-722.
[8]Bennett-Guerrero E,Swaminathan M,Grigore AM,et al.A phase II multicenter double-blind placebo-controlled study of ethyl pyruvate in high-risk patients undergoing cardiac surgery with cardiopulmonary bypass[J].J Cardiothorac Vasc Anesth,2009,23(3):324-329.
[9]Sims CA,Wattanasirichaigoon S,Menconi MJ,et al.Ringer’s ethyl pyruvate solution ameliorates ischemia/reperfusion-induced intestinal mucosal injury in rats[J].Crit Care Med,2001,29(8):1513-1518.
[10]Kao KK,Fink MP.The biochemical basis for the anti-inflammatory and cytoprotective actions of ethyl pyruvate and related compounds[J].Biochem Pharmacol,2010,80(2):151-159.
[11]Cruz RJ Jr,Harada T,Sasatomi E,et al.Effects of ethyl pyruvate and other α-keto carboxylic acid derivatives in a rat model of multivisceral ischemia and reperfusion[J].J Surg Res,2011,165(1):151-157.
[12]Mollen KP,McCloskey CA,Tanaka H,et al.Hypoxia activates c-Jun N-terminal kinase via Rac1-dependent reactive oxygen species production in hepatocytes[J].Shock,2007,28(3):270-277.
[13]Johansson AS,Palmblad J.Ethyl pyruvate modulates adhesive and secretory reactions in human lung epithelial cells[J].Life Sci,2009,84(23-24):805-809.
[14]Sappington PL,Fink ME,Yang R,et al.Ethyl pyruvate provides durable protection against inflammation-induced intestinal epithelial barrier dysfunction[J].Shock,2003,20(6):521-528.
[15]Lim SC,Choi JE,Kim CH,et al.Ethyl pyruvate induces necrosis-to-apoptosis switch and inhibits high mobility group box protein 1 release in A549 lung adenocarcinoma cells[J].Int J Mol Med,2007,20(2):187-192.
[16]Kim JS,Qian T,Lemasters JJ.Mitochondrial permeability transition in the switch from necrotic to apoptotic cell death in ischemic rat hepatocytes[J]. Gastroenterology,2003,124(2):494-503.
[17]Mertz RJ,Worley JF,Spencer B,et al.Activation of stimulus-secretion coupling in pancreatic beta-cells by specific products of glucose metabolism. Evidence for privileged signaling by glycolysis[J].J Biol Chem,1996,271 (9):4838-4845.
[18]Taylor MD,Grand TJ,Cohen JE,et al.Ethyl pyruvate enhances ATP levels,reduces oxidative stress and preserves cardiac function in a rat model of off-pump coronary bypass[J].Heart Lung Circ,2005,14(1):25-31.
[19]Zeng J,Liu J,Yang GY,et al.Exogenous ethyl pyruvate versus pyruvate during metabolic recovery after oxidative stress in neonatal rat cerebrocortical slices [J].Anesthesiology,2007,107(4):630-640.
Mechanism of Protection of Ethyl Pyruvate against Oxidative Stress Injury in Hepatocytes
WANGHaoHEYizhouLUOZhe
DepartmentofAnesthesiology,ZhongshanHospital,FudanUniversity,Shanghai200032,China
AbstractObjective: To investigate the protective effect of ethyl pyruvate on oxidative stress injury in hepatocytes and its underlying molecular mechanism. Methods: Hypoxia/reoxygenation-induced oxidative stress injury model was performed with 1 h hypoxia followed by 1 h reoxygenation.According to the different interventions, L-02 hepatocytes were divided into control group(Con group),lactate Ringer’s group(LR group) and ethyl pyruvate group(EP group). The concentrations of aspartate aminotransferase(AST) and alanine aminotransferase(ALT) in supernatants of cell culture medium were measured by Hitachi 7020 Automatic Analyzer (Hitachi, Tokyo, Japan). The percentages of necrotic cells and apoptotic cells were examined by Hoechst 33342/propidium iodide (PI) and TdT-mediated dUTP nick end labeling(TUNEL) staining. The expression levels of caspase-9, caspase-3 and poly (ADP-ribose) polymerase (PARP) were determined by Western blotting.The concentrations of ATP in hepatocytes were measured by using luciferase luminescence method. Results: The concentrations of AST and ALT in EP group were lower than that in Con group and LR group(P<0.05). The percentage of necrotic cells was lower and the percentage of apoptotic cells was higher in EP group than those in Con group and LR group(P<0.05). The expression levels of cleaved caspase-9, caspase-3 and PARP in EP group were higher than that in Con group and LR group(P<0.05). The concentration of ATP in EP group was higher than that in Con group and LR group(P<0.05). Conclusions: Ethyl pyruvate can decrease the percentage of necrotic cells but increased the percentage of apoptotic cells in hepatocytes insulted by hypoxia/reoxygenation.Ethyl pyruvate may protect hepatocytes against oxidative stress injury through up-regulating the intracellular ATP levels and consequently skewing the necrosis-apoptosis pathway.
Key WordsOxidative stress injury;Necrosis;Apoptosis;Ethyl pyruvate
中图分类号R363
文献标识码A

