低分子量聚乙烯亚胺/金纳米棒纳米载体的制备及毒性研究
王 倩,刘丽炜,朱泠西,邹 鹏,胡思怡,卜承飞
(长春理工大学理学院国际纳米光子学与生物光子学联合研究中心,吉林长春 130022)
低分子量聚乙烯亚胺/金纳米棒纳米载体的制备及毒性研究
王 倩,刘丽炜*,朱泠西,邹 鹏,胡思怡,卜承飞
(长春理工大学理学院国际纳米光子学与生物光子学联合研究中心,吉林长春 130022)
以表面修饰巯基十一烷酸的金纳米棒(GNRs/MUA)为骨架,将低分子量的聚乙烯亚胺(PEI)连接到GNRs/MUA表面,构建GNRs/MUA/PEI纳米载体。首先采用MUA对GNRs进行表面修饰,减少由于GNRs表面的十六烷基三甲基溴化铵(CTAB)所造成的生物毒性。然后采用低分子量PEI进一步修饰,同时利用GNRs巨大的比表面积进一步放大PEI的携带基因能力,这样既能够降低阳离子聚合物的毒性,又能够提高整个体系的转染效率。利用透射电子显微镜(TEM)、紫外可见吸收光谱(UV-Vis)、Zeta电位等对纳米载体进行了表征。结果显示,MUA与PEI已成功修饰到GNRs表面,并很好地保留了GNRs的光学性质,其表面电位发生正负交替变化。采用噻唑蓝(MTT)比色法对纳米载体进行细胞毒性研究,结果显示GNRs/MUA/PEI (1.8 kDa)非病毒纳米载体,细胞存活率在控制聚合物浓度为300 μg/mL时仍然稳定在75%以上,明显高于商品化的PEI(25 kDa)。
金纳米棒;聚乙烯亚胺;非病毒载体;细胞毒性
1 引 言
基因疗法在介入治疗领域应用广泛,可以治疗多种疾病,包括传染病、遗传病、癌症等。它克服了蛋白治疗的缺点,成为一种新的治疗方法,引起了越来越多科研学者的极大兴趣和广泛关注。然而,限制基因治疗的一个关键因素是安全高效基因载体的制备。基因载体一般分为病毒类和非病毒类。相对于病毒载体,非病毒基因载体具有低细胞毒性和低免疫原性、生物相容性好、可以生物降解等优点,因此应用最为广泛,主要包括有脂质体、阳离子聚合物和纳米颗粒等[1-5]。金纳米棒(Gold nanorods,GNRs)是一种棒状的金纳米颗粒,它比球形金纳米粒子具有更大的比表面积和更为奇特的光电性质[6],具有合成方法简单、化学性质稳定、产率高、低毒性、易于官能化等优点,可作为小分子药物及大生物分子如DNA、SiRNA的输送载体,展现出了良好的应用前景。到目前为止,研究者们已经能够制备出多种形貌的金纳米颗粒。其中棒状金纳米颗粒具有更为特殊的表面等离子体共振(SPR)特性,通过控制不同长短轴比可以人为调控纵向SPR峰位置(从可见光区到近红外光区)。另外,GNRs能够有效地吸收红外光能量进行局部加热,导致蛋白质变性并致细胞死亡,在疾病的光热治疗中具有特殊的优越性[7-9]。
阳离子聚合物聚乙烯亚胺(PEI),富含氨基,可以通过静电作用与DNA或SiRNA等生物分子缔合成复合物。由于其独特的“质子海绵效应”,能够保护DNA免受核酸酶降解,促进与细胞的结合和摄取,成为阳离子聚合物基因载体的典型代表,在大多数的体外基因转染和动物体内基因治疗研究中均取得了良好的效果[10-14]。但同时它也会对细胞产生较大的毒性作用,同时不可降解,限制了其在生物医学领域的应用[12,15]。研究发现,降低相对分子质量可以减少聚乙烯亚胺的毒性,但同时转染效率下降[16-18]。因此,越来越多的研究者们投入到进一步提高聚乙烯亚胺的转染效率并降低其毒性的研究中。本文将低分子量的PEI与GNRs相结合,采用低分子量PEI降低阳离子聚合物的细胞毒性,同时利用GNRs巨大的比表面积进一步放大PEI的携带基因能力,构建GNRs/MUA/PEI基因载体。这样既能够降低阳离子聚合物的毒性,又能够提高整个体系的转染效率。利用MTT法检测GNRs/MUA/PEI (1.8 kDa)对MCF-7细胞的细胞毒性,结果证实GNRs/MUA/PEI(1.8 kDa)对细胞毒性较小,体现了其作为新型非病毒纳米载体的可行性及优越性,为开发高效基因及药物运输载体提供了一个新的思路。
2 实 验
2.1 仪器与试剂
仪器:样品的吸收光谱通过紫外可见近红外分光光度计(Carry5000,美国,安捷伦)检测,高倍透视电镜(FEI Tecnai G2 S-Twin)观察制备的GNRs的形貌和尺寸。胶体粒度Zeta电位测定仪(Nano ZS90,德国,马尔文)用于测定样品的水合粒径及表面电位。利用多功能酶标仪(Infinite M200 Pro,瑞士,TECAN)进行MTT测试。
试剂:氯金酸(HAuCl4·3H2O,99%)、十六烷基三甲基溴化胺(CTAB,99%)、抗坏血酸(Ascorbic acid,AA,99%)、硝酸银(AgNO3,99.9%)、硼氢化钠(NaBH4,98%)、聚乙烯亚胺(PEI,25 kDa,99%)、11-巯基十一酸(11-mercaptoundecanoic acid,MUDA,95%)均购自Sigma公司。聚乙烯亚胺(PEI,1.8 kDa,99%)购自Alfa公司。pH 7.2的PBS缓冲溶液、DMEM(GIBCO)、胎牛血清(Fetal bovine serum,FBS)、胰酶细胞消化液(Typsin-EDTA solution)、抗生素(Penicillin-streptomycin)、甲基噻唑基四唑(Methyl thiazolyl tetrazolium,MTT)均购自碧云天生物技术有限公司。
2.2 金纳米棒的合成
目前,对于GNRs的合成已经研究出许多有效的方法,如模板法、电化学法、光化学法以及晶种生长法等。晶种法对设备的要求比较低且制备过程较简单,是目前制备GNRs最成功的方法[19-22],因此本文采用晶种生长法制备GNRs。
在10 mL浓度为0.1mol/L的CTAB溶液中加入0.2 mL浓度为0.01 mol/L的HAuCl4溶液,缓慢搅拌,溶液立即由浅黄色转为棕黄色。然后,迅速加入500 μL浓度为0.01 mol/L的冰的NaBH4,溶液呈金棕色,继续缓慢搅拌2 min,即得到金种溶液待用。
分别配制适量浓度为25 mmol/L的HAuCl4、浓度为0.2 mol/L的抗坏血酸(AA),浓度为0.1mol/L的CTAB溶液。取一个试剂瓶,取适量上述溶液依次加入试剂瓶中,反应一定时间配制成50 mL生长液。
将0.5 mL金种加入到50 mL生长液中,静置在30℃水浴中过夜,即得到GNRs/CTAB溶液。
2.3 GNRs/MUA/PEI的制备
GNRs/MUA/PEI纳米载体的制备原理如图1所示。首先,取22 mg MUA固体于一支10 mL玻璃试剂瓶中,加入4 mL HPLC水,超声分散至溶液呈白色悬浊液。加入800 μL 20%的NaOH,缓慢搅拌5 min后得到透明溶液,补加水到5 mL,得到浓度为23 mmol/L的MUA溶液。向装有5 mL浓度为3 mg/mL的GNRs溶液的试剂瓶中缓慢加入1 mL浓度为23 mmol/L的MUA溶液,常温反应24 h。以6 000 r/min的转速离心20 min,移去上清液,向其中加入5 mL水,超声分散,得到GNRs/MUA溶液。
然后,取浓度为1 mg/mL的PEI溶液加入到1 mL的GNRs/MUA溶液中,室温下反应30 min。以4 500 r/min的转速离心15 min,去除未结合的反应物。之后,向其中加入1 mL水溶解,待用。

图1 GNRs/MUA/PEI纳米载体的制备原理示意图Fig.1 Synthetic scheme of GNRs/MUA/PEI
2.4 毒性测试
将对数生长期的MCF-7细胞分散在含10%胎牛血清的培养基中。细胞计数之后,将其置于96孔板中,每孔约10 000个细胞,在CO2孵育箱中孵育12 h(37℃、体积分数为5%的饱和湿度),使其贴壁。分别将20 μL的细胞培养液和不同浓度的GNRs/CTAB、GNRs/MUA、PEI(1.8 kDa)、PEI(25 kDa)、GNRs/MUA/PEI(25 kDa)、GNRs/MUA/PEI(1.8 kDa)加入96孔板。不同聚合物在体系中的最终浓度分别为25,50,100, 200,300 μg/mL。第一组孵育时间为24 h,第二组孵育时间为48 h。
3 结果与讨论
3.1 不同长径比GNRs的表征
图2为采用晶种生长法制备的GNRs的透射电镜(TEM)图像,GNRs的长径比分别为2∶1、3.5∶1、4.5∶1,0.3 mol/L盐酸的加入量分别为200,400,600 μL。由图2可以看出,所制备的GNRs大小尺度均一,表面光滑,分散性较好。通过改变实验条件,可以调控GNRs的红外共振吸收峰位置。图3分别为加入200,400,600,800 μL盐酸所制备的不同长径比的GNRs的吸收光谱。由图中可知,随着盐酸加入量的增加,GNRs的纵向等离子共振吸收峰发生了不同程度的红移,从640 nm红移至850 nm,表明GNRs的长径比不断增大。
结果显示,通过控制溶液中盐酸的加入量可以有效地控制金纳米粒子的长径比。这是由于随着酸的加入,溶液的pH值随之减小,CTAB的吸附特性也随之改变。CTAB强吸附在{110}面上形成双层从而抑制金纳米颗粒在{110}面上的生长,所以金纳米棒的宽度(侧面)生长减慢,GNRs的长径比不断增大。
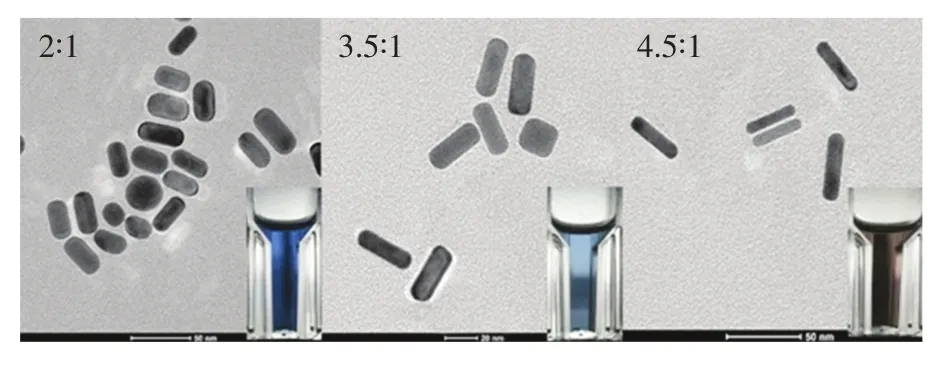
图2 长径比分别为2∶1、3.5∶1、4.5∶1的GNRs的实物图及对应的TEM图。Fig.2 TEM images of GNRs with aspect ratios of 2∶1,3.5∶1,and 4.5∶1,respectively.

图3 不同长径比的GNRs的吸收光谱Fig.3 Surface plasmon absorption spectra of GNRs with different aspect ratios
3.2 不同长径比的金纳米棒的胶体稳定性测试
为了选择稳定性较好的GNRs进行进一步的研究应用,我们对所制备的不同长径比的GNRs进行了胶体稳定性测试。首先通过调节实验中加入盐酸的量,制备不同长径比的GNRs。然后利用动态光散射粒度分析设备测定了不同长径比的GNRs在水溶液中的胶体稳定性,以便于后续修饰以及生物应用。从图4中的结果可以发现,长径比为2∶1的GNRs的水合粒径稳定在50 nm左右,无大幅度变化,其分散性及稳定性较好,所以在后面的实验中我们选用的GNRs长径比约为2∶1。
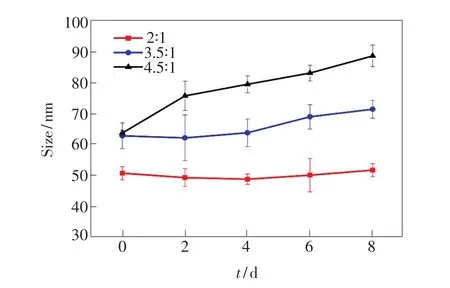
图4 长径比分别为2∶1、3.5∶1、4.5∶1的GNRs在水溶液中的胶体稳定性。Fig.4 Colloid stability of GNRs at the aspect ratios of 2∶1, 3.5∶1,and 4.5∶1,respectively.
3.3 GNRs/MUA/PEI纳米粒子的物理表征
由于MUA与阳离子聚合物PEI修饰到GNRs表面会导致其Zeta电位发生明显的正负交替变化,因此由图5的结果可知,MUA与PEI已成功修饰到GNRs表面。由于表面修饰前GNRs的表面吸附了大量的CTAB分子,Zeta电位为+36.8 mV,其表面带正电;修饰MUA后,其Zeta电位变为-46.4 mV,说明MUA通过S—Au键成功地共价连接起来,其表面的CTAB被MUA分子替换,使金纳米棒表面带负电[23]。经过不同分子量的PEI修饰后,GNRs的Zeta电位分别为+32.4 mV和+48.5 mV,证明阳离子聚合物已成功地通过静电吸附作用吸附到GNRs/MUA表面。
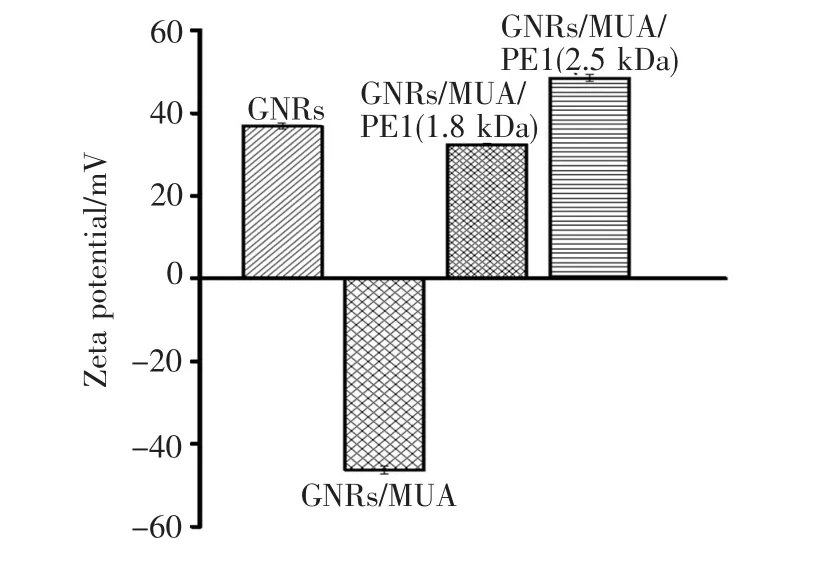
图5 GNRs、GNRs/MUA、GNRs/MUA/PEI的Zeta电位图。Fig.5 Zeta potential of GNRs,GNRs/MUA,and GNRs/ MUA/PEI,rspectively.

图6 表面修饰后的GNRs的吸收光谱Fig.6 Surface plasmon absorption spectra of the surface functionalized GNRs
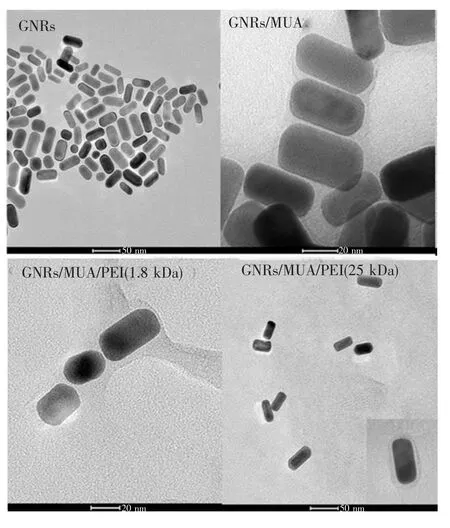
图7 GNRs、GNRs/MUA、GNRs/MUA/PEI(1.8 kDa)、GNRs/MUA/PEI(25 kDa)纳米颗粒的TEM图像。Fig.7 TEM images of GNRs,GNRs/MUA,GNRs/MUA/ PEI(1.8 kDa),and GNRs/MUA/PEI(25 kDa), respectively.
图6是经过不同表面修饰的GNRs溶液的可见-近红外吸收光谱。从图中可以看到,GNRs的吸收峰在650 nm处,GNRs/MUA、GNRs/MUA/ PEI的纵向吸收峰相比于GNRs均发生了不同程度的红移。这是由于金纳米棒所处的环境介质折射率发生了变化,这与理论上PEI的折射率大于MUA及CTAB分子层的折射率相符[24]。修饰后的GNRs峰形对称、未发生展宽,说明聚合物未造成纳米颗粒的团聚,GNRs/MUA、GNRs/MUA/PEI可以很好地保留GNRs的光学性质。图7分别为修饰MUA和PEI的GNRs的TEM图。从图中可以看到,修饰后GNRs的长约为50 nm,宽约为20 nm,且修饰后的纳米材料具有很好的分散性。
3.4 不同分子量PEI修饰的GNRs的细胞毒性
晶种生长法合成得到的GNRs表面被大量的CTAB所覆盖。而GNRs表面的CTAB所具有的生物毒性对于GNRs在生物体系中的应用有很大的限制性[25-26]。因此,我们对GNRs初步离心去除一部分CTAB之后,再在其表面修饰MUA,分别与MCF-7细胞作用24 h和48 h后,测得的毒性结果如图8所示,只加入培养基的细胞作为空白对照(Control)。GNRs在修饰MUA后的毒性明显减小,生物兼容性增大,可以更好地应用于生物体系中。然后,我们再将低分子量的PEI修饰到GNRs的表面,测得的毒性结果如图8所示。GNRs/MUA/PEI(1.8 kDa)的细胞毒性较小,改变聚合物的浓度从25~300 μg/mL,细胞存活率仍在75%以上,远高于商品化的PEI(25 kDa)。在另一对照组中,我们采用高分子量的PEI(25 kDa)修饰GNRs/MUA,结果显示,随着聚合物浓度的增大,GNRs/MUA/PEI(25 kDa)对MCF-7细胞的毒性明显增强。相比之下,GNRs/MUA/PEI (1.8 kDa)体现出明显的优越性。

图8 MTT法检测GNRs、GNRs/MUA、GNRs/MUA/PEI在不同浓度下与MCF-7细胞分别作用24 h(a)、48 h (b)的细胞毒性。Fig.8 Viability of MCF-7 cells incubated with GNRs, GNRs/MUA,GNRs/MUA/PEI for 24 h(a)and 48 h(b)at different concentrations.
我们采用另一对照组,分别对比GNRs/ MUA/PEI(1.8 kDa)与PEI(1.8 kDa)及GNRs/ MUA/PEI(25 kDa)、PEI(25 kDa)对MCF-7细胞的毒性。结果从图9中可以看到,PEI(1.8 kDa)毒性较低;而当浓度不断增大时,PEI(25 kDa)的细胞存活率明显降低。这进一步证实了我们采用低分子量PEI制备纳米载体的合理性。在相同浓度的情况下,GNRs/MUA/PEI(1.8 kDa)与PEI (1.8 kDa)相比无明显变化。
4 结 论
采用晶种生长法制备GNRs,通过改变生长液中酸的加入量对GNRs的长径比进行调控,从而选取稳定性较高的样品进行了表面修饰。然后分别将MUA与PEI修饰到GNRs表面,成功得到GNRs/MUA/PEI(1.8 kDa)纳米载体。所制备的纳米载体很好地保留了GNRs的光学性质。采用MTT比色法测试纳米载体的细胞毒性,结果显示GNRs/MUA/PEI(1.8 kDa)纳米载体细胞毒性较小。改变聚合物的浓度从25~300 μg/mL,细胞存活率仍在75%以上,而相同条件下的PEI(25 kDa)细胞存活率仅在30%以上,可见其细胞存活率远高于商品化的PEI(25 kDa)。GNRs/MUA/ PEI(1.8 kDa)纳米载体的制备方法简单,并且结合了PEI(1.8 kDa)低毒性和GNRs巨大表面积的优势,有望作为高效的纳米载体运送基因及药物应用于生物医学领域。
[1]Zuckerman J E,Choi C H J,Han H,et al.Polycation-siRNA nanoparticles can disassemble at the kidney glomerular basement membrane[J].Proc.Natl.Acad.Sci.,2012,109(8):3137-3142.
[2]Videira M,Arranja A,Rafael D,et al.Preclinical development of siRNA therapeutics:Towards the match between fundamental science and engineered systems[J].Nanomedicine,2014,10(4):689-702.
[3]Novo L,Van Gaal E V B,Mastrobattista E,et al.Decationized crosslinked polyplexes for redoxtriggered gene delivery [J].J.Controll.Release,2013,169(3):246-256.
[4]Kwok A,Hart S L.Comparative structural and functional studies of nanoparticle formulations for DNA and siRNA delivery [J].Nanomedicine,2011,7(2):210-219.
[5]Novo L,Mastrobattista E,Van Nostrum C F,et al.Targeted decationized polyplexes for cell specific gene delivery[J]. Bioconjug.Chem.,2014,25(4):802-812.
[6]Yin F,Yang C B,Wang Q Q,et al.A light-driven therapy of pancreatic adenocarcinoma using gold nanorods-based nanocarriers for co-delivery of doxorubicin and siRNA[J].Theranostics,2015,5(8):818-833.
[7]Sun G M,Yang P H,Sun J H,et al.Fluorescence imaging of hepatocellular carcinoma cells labeled with gold nanorods and detection by AFM[J].Chin.J.Lumin.(发光学报),2011,32(6):636-641(in Chinese).
[8]Han L,Zhao J,Zhang X,et al.Enhanced siRNA delivery and silencing goldchitosan nanosystem with surface charge-reversal polymer assembly and good biocompatibility[J].ACS Nano,2012,6(8):7340-7351.
[9]Lee S K,Han M S,Asokan S,et al.Effective gene silencing by multilayered siRNA-coated gold nanoparticles[J]. Small,2011,7(3):364-370.
[10]Troiber C,Kasper J C,Milani S,et al.Comparison of four different particle sizing methods for siRNA polyplex characterization[J].Pharm.Biopharm.,2013,84(2):255-264.
[11]Xue H Y,Wong H L.Solid lipid-PEI hybrid nanocarrier:An integrated approach to provide extended,targeted,and safer siRNA therapy of prostate cancer in an all-in-one manner[J].ACS Nano,2011,5(4):7034-7047.
[12]Park J S,Yang H N,Woo D G,et al.Chondrogenesis of human mesenchymal stem cells mediated by the combination of SOX trio SOX5,6,and 9 genes complexed with PEI-modified PLGA nanoparticles[J].Biomaterials,2011,32(14): 3679-3688.
[13]TrosdeIlarduya C,Sun Y,Düzgünes N.Gene delivery by lipoplexes and polyplexes[J].Eur.J.Pharm.Sci.,2010,40 (3):159-170.
[14]Lee Y,Miyata K,Oba M,et al.Charge-conversion ternary polyplex with endosome disruption moiety:A technique for efficient and safe gene delivery[J].Angew.Chem.Int.Ed.,2008,47(28):5163-5166.
[15]Tsai L R,Chen M H,Chien C T,et al.A single-monomer derived linear-like PEI-co-PEG for siRNA delivery and silencing[J].Biomaterials,2011,32(4):3647-3653.
[16]Tang G P,Guo H Y,Alexis F,et al.Low molecular weight polyelhylenimines linked by β-cyclodextrin for gene transfer into the nervoussystem[J].J.Gene Med.,2006,8(6):736-744.
[17]Goula D,Remy J S,Erbacher P,et al.Size,diffusibilitv and tmnsfection performance of linear PEI/DNA complexes in the mouse central nervous system[J].Gene Ther.,1998,5(5):712-717.
[18]Vicennati P,Giuliano A,Ortaggi G,et al.Polyethylenimine in medicinal chemistry[J].Curr.Med.Chem.,2008,15 (27):2826-2839.
[19]Wu H Y,Chu H C,Kuo T J,et al.Seed-mediated synthesis of high aspect ratio gold nanorods with nitric acid[J]. Chem.Mater.,2005,17(25):6447-6451.
[20]Ye X C,Jin L H,Caglayan H,et al.Improved size-tunable synthesis of monodisperse gold nanorods through the use of aromatic additives[J].ACS Nano,2012,6(3):2804-2817.
[21]Perez-Juste J,Liz-Marzan L M,Carnie S D,et al.Electric-field-directed growth for gold nanorods[J].Adv.Funct.Mater.,2004,14(3):571-579.
[22]Kim F,Song J H,Yang P D.Photochemical synthesis of gold nano-rods[J].Am.Chem.Soc.,2002,124(48):14316-14317.
[23]Zhou H Y,Zhou R,X B,et al.Preparation and cytotoxicity of high-aspect-ratio gold nanorods at single cell level[J]. Chin.J.Anal.Chem.(分析化学),2012,40(12):1807-1815(in Chinese).
[24]Justin C,Meenakshi V,Wang Y Y,et al.Replacement of cetyltrimethylammoniumbromide bilayer on gold nanorod by alkanethiol crosslinker for enhanced plasmon resonance sensitivity[J].Biosens.Bioelectron.,2013,49:525-530.
[25]Nikoobakht B,El-Sayed M A.Preparation and growth mechanism of gold nanorods(NRs)using seed-mediated growth method[J].Chem.Mater.,2003,15(10):1957-1962.
[26]Pe'rez-Juste J,Pastoriza-Santos I,Liz-Marzań L M,et al.Gold nanorods:Synthesis,character-ization and applications [J].Coordin.Chem.Rev.,2005,249(23):1870-1901.

王倩(1990-),女,吉林长春人,硕士研究生,2013年于长春理工大学获得学士学位,主要从事纳米光子学与生物光子学的研究。
E-mail:wangqian1990mail@163.com

刘丽炜(1979-),女,吉林长春人,教授,博士生导师,2013年于长春理工大学获得博士学位,主要从事纳米光子学与生物光子学的研究。
E-mail:liulw@cust.edu.cn
Synthesization and Toxicity of Low-molecular-weight PEI/Gold Nanords Nanosystem
WANG Qian,LIU Li-wei*,ZHU Ling-xi,ZOU Peng,HU Si-yi,BU Cheng-fei
(International Joint Research Center for Nanophotonics and Biophotonics,School of Science, Changchun University of Science and Technology,Changchun 130022,China) *Corresponding Author,E-mail:liulw@cust.edu.cn
Based on the gold nanorods modified by 11-mercaptopropanic acid(MUA)as the skeleton,the low molecular weight polyethylenimine PEI was conjugated to the surface of GNRs/MUA to form GNRs/MUA/PEI nanocomplexes.Firstly,surface modification of gold nanorods was carried out by using MUA to reduce the toxicity of gold nanorods caused by CTAB surfactants,and then further modified by low molecular weight PEI.The large surface area of gold nanorods allows them to carry more genes,which can simultaneously reduce the toxicity of cationic polymer and improve the transfection efficiency of the whole system.GNRs/MUA/PEI were characterized by transmission electron microscopy(TEM),UV-Vis absorption spectra,and Zeta potential.The results show that MUA and PEI are conjugated to GNRs successfully which cause charge reversal on the surface of GNRs,and the optical properties of GNRs are well preserved.In vitro cytotoxic effects of GNRs/MUA/PEI (1.8 kDa)are quantified by MTT assay,and the results suggest that the cell viability is above 75% at the concentration of 300 μg/mL,much higher than the commercialized PEI(25 kDa).
gold nanorods;polyethylenimine;nonviral vectors;cytotoxicity
O482.31
:ADOI:10.3788/fgxb20153611.1271
1000-7032(2015)11-1271-07
2015-05-25;
:2015-09-28
国家自然科学基金(11204020);吉林省国际纳米光子学与生物光子学重点实验室支撑项目(20140622009JC);总装备部预研基金(62201070711)资助项目

