乳腺浸润性导管癌组织中Mfn2的表达变化及临床意义
谢艳丽,焦俊琴,刘月平,马力(河北医科大学第四医院,石家庄 050011)
乳腺浸润性导管癌组织中Mfn2的表达变化及临床意义
谢艳丽,焦俊琴,刘月平,马力(河北医科大学第四医院,石家庄 050011)
摘要:目的观察乳腺浸润性导管癌组织中线粒体融合蛋白2(Mfn2)的表达变化,并探讨其临床意义。方法采用免疫组化法检测116例份乳腺浸润性导管癌组织(观察组)、10例份正常乳腺导管上皮组织(对照组)Mfn2,分析Mfn2表达与乳腺浸润性导管癌临床病理参数的相关性。结果观察组及对照组Mfn2阳性率分别为44.82%(52/116)、90.00%(9/10),两组比较,P<0.05。Mfn2表达与乳腺浸润性导管癌淋巴结转移、组织学分级、TNM分期、雌激素受体、孕激素受体、人表皮生长因子受体-2有关(P均<0.05)。结论 乳腺浸润性导管癌组织中Mfn2的表达降低,其可能在乳腺浸润性导管癌的发生、发展过程中起作用。
关键词:乳腺肿瘤;乳腺浸润性导管癌;线粒体融合蛋白2
线粒体融合蛋白2(Mfn2)是一种增殖抑制基因,具有抗细胞增殖的作用,定位于线粒体外膜,在线粒体融合过程中发挥着重要作用,参与调节线粒体功能和形态学的改变。Chen等[1]研究认为,Mfn2可以在多种肿瘤细胞系中抑制细胞的生长和增殖。同时,也有越来越多的研究[2~4]证实Mfn2对哺乳类动物细胞有保护作用。目前,关于Mfn2在乳腺癌组织特别是在乳腺浸润性导管癌组织中表达情况的报道相对较少。2014年1~6月,我们观察了乳腺浸润性导管癌组织中Mfn2的表达变化,并探讨其临床意义。
1资料与方法
1.1临床资料原发性乳腺浸润性导管癌患者116例,年龄24~76岁,中位年龄47岁;其中≤30岁11例,>30、≤60岁70例,>60岁35例。所有患者均经病理证实,且术前均未行放、化疗及内分泌治疗。淋巴结转移0个63例,1~3个37例,≥4个16例;组织学分级Ⅰ级6例,Ⅱ级63例,Ⅲ级47例;雌激素受体(ER)阴性39例,阳性77例;孕激素受体(PR)阴性56例,阳性60例;人表皮生长因子受体-2(HER2)阴性70例,阳性46例。手术留取癌组织116例份(观察组),另取癌旁(自距原发癌灶>5 cm处)正常乳腺导管上皮组织10例份(对照组)。
1.2主要试剂Mfn2单克隆抗体(小鼠抗人)Santa Cruz公司产品,二抗为通用型试剂盒。
1.3组织Mfn2检测将标本置于10%甲醛固定18~24 h,脱水后石蜡包埋,制备4 μm厚连续组织切片。按试剂盒说明书进行免疫组化SP法染色,抗原修复采用高压法,抗体稀释度为1∶100。每次染色均同步设阳性和阴性对照。结果判定标准:Mfn2阳性表达定位于细胞质,均呈棕黄色或棕褐色颗粒样分布。光学显微镜下观察,根据棕黄色阳性信号的强弱和面积判断结果,阳性细胞率<10%为阴性表达,10%~50%为阳性表达,>50%为强阳性表达。结果判断:①按阳性细胞百分率计分:阳性细胞率<10%计0分,10%~50%计1分,>50%计2分;②按染色强弱计分:淡黄色计0分,黄色计1分,棕黄色计2分。两项计分相加得0~1分为阴性、≥2分为阳性。
1.4统计学方法采用SPSS13.0统计软件。两组间比较采用χ2检验,相关性分析采用Spearman相关性分析法。P≤0.05为差异有统计学意义。
2结果
2.1各组Mfn2阳性率比较观察组及对照组Mfn2阳性率分别为44.82%(52/116)、90.00%(9/10),两组比较,P<0.05。
2.2Mfn2表达与乳腺浸润性导管癌临床病理参数的关系Mfn2表达与乳腺浸润性导管癌淋巴结转移、组织学分级、TNM分期、ER、PR、HER2有关(P均<0.05)。
3讨论
乳腺浸润性导管癌是一类起源于乳腺导管上皮的恶性肿瘤,是最常见的乳腺癌病理类型,约占所有乳腺癌的70%左右。乳腺浸润性导管癌的流行病学特征与乳腺癌总体一致,属于生物学行为较差的病理类型。浸润性导管癌在40岁以下妇女中少见,但年轻妇女与老年妇女的肿瘤分类比例相同。由于浸润性导管癌在乳腺癌中最为多见,并且患者的预后往往欠佳,因此深入探讨其生物学行为的影响因素有着重要意义。
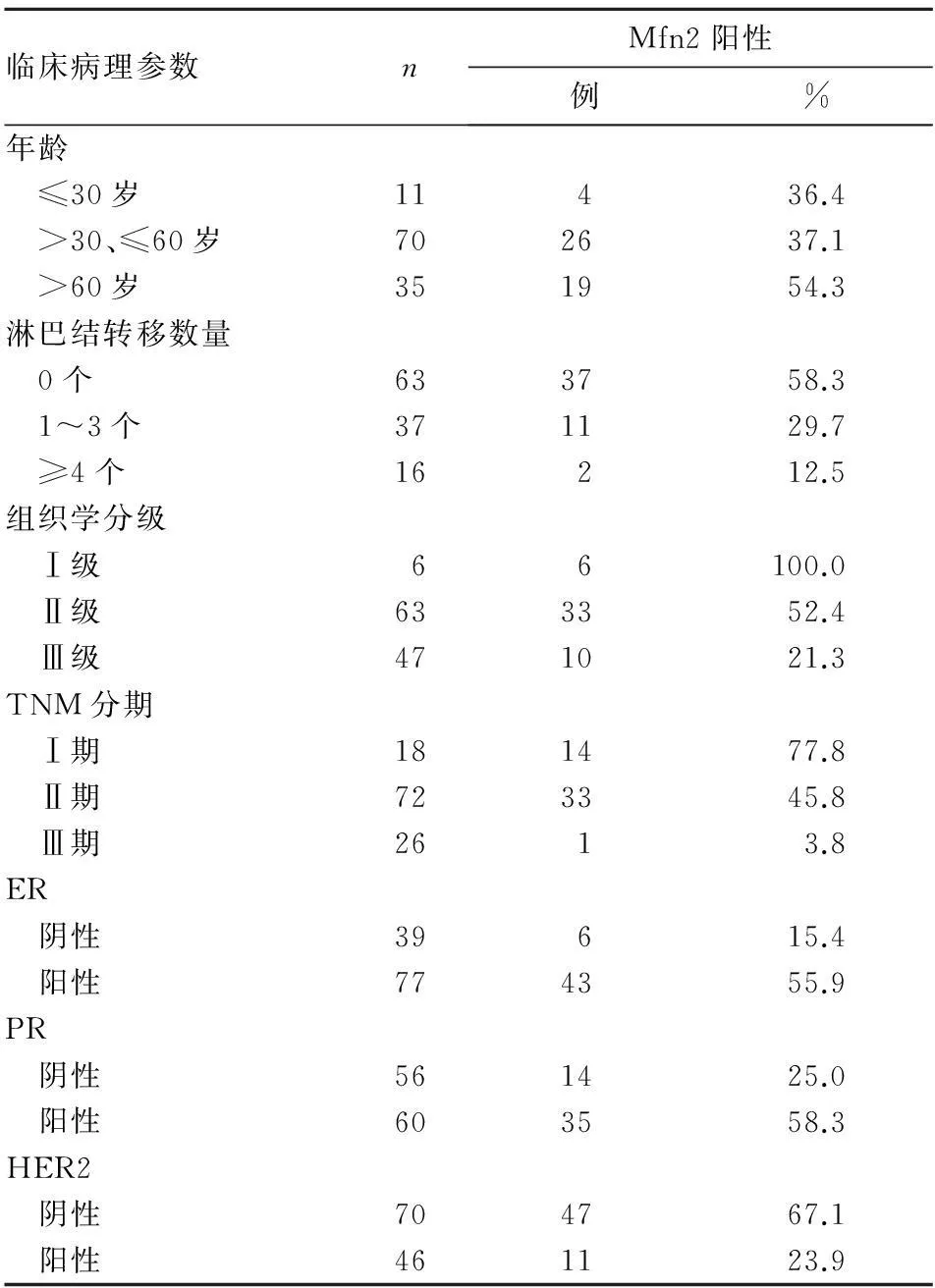
表1 Mfn2表达与乳腺浸润性导管癌临床病理
文献报道,人Mfn2基因定位于1p36.3位置上。目前研究[1,5,6]显示,过表达的Mfn2可以引起血管平滑肌细胞的增殖抑制、抑制肿瘤细胞系的增殖,在活体可抑制血管内膜形成,并可与α-肌动蛋白和微管蛋白共同定位于胞质。同时Mfn2还能促进线粒体融合,调节丙酮酸、葡萄糖和脂肪酸的氧化。因此在需能较高的细胞中,Mfn2表达水平较高[7]。Mfn2已被证实参与了抑制细胞增殖和促进细胞凋亡的过程,同时可以抑制多种恶性肿瘤细胞的生物学活性,提示Mfn2可能在人类恶性肿瘤的发生发展过程中发挥重要作用[1,8~10]。本研究显示,观察组Mfn2阳性率低于对照组,提示Mfn2的异常表达在乳腺上皮细胞发生癌变的过程中可能起着一定的作用,对乳腺良恶性肿瘤的鉴别有一定的参考价值。
近年来有学者研究发现,Mfn2的表达下调与多种恶性肿瘤患者的不良预后有关[11,12]。Mfn2与恶性肿瘤发生、发展的关系研究,特别是其与恶性肿瘤细胞增殖和凋亡的研究逐渐成为热点[13~15]。Mfn2参与恶性肿瘤发生、发展的具体机制目前尚不十分清楚,有研究表明可能与其能够促进凋亡基因(Bax)蛋白表达增多,从而活化线粒体凋亡途径有关。在凋亡诱导因素的作用下,胞质中非活性的Bax蛋白发生构型变化,从细胞质移位到线粒体膜上与Bcl-2结合,形成异源二聚体来抑制Bcl-2的活性,从而导致了线粒体膜上通透性转换孔的持续性开放,致使线粒体跨膜压下降,引起细胞色素C释放到细胞质中;这些被释放到细胞质中的细胞色素C与凋亡诱导因子、Caspase-3酶原结合形成凋亡复合物,进而生成有活性的Caspase-3来触发细胞凋亡。我们的前期工作证实,ERβ/Mfn2通路参与介导了雌激素作用下乳腺癌细胞生物学行为的变化,即ERβ可以通过影响Mfn2的表达抑制E2诱导的乳腺癌细胞MCF-7的增殖和转移。本研究显示,Mfn2表达与乳腺浸润性导管癌淋巴结转移、组织学分级、TNM分期、ER、PR、HER2有关,提示Mfn2可能与乳腺癌的进展过程有密切的关系。也有学者认为,Mfn2的表达下调与恶性肿瘤患者的预后无明显相关;这可能与各实验研究所采用的试剂、检测方法、病例数差别等原因有关。
总之,乳腺浸润性导管癌组织中Mfn2的表达降低,其可能在乳腺浸润性导管癌的发生、发展过程中起作用。
参考文献:
[1] Chen KH, Guo X, Ma D, et al. Dysregulation of HSG triggers vascular proliferative disorders[J]. Nat Cell Biol, 2004,6(9):872-883.
[2] Neuspiel M, Zunino R, Gangaraju S, et al. Activated mitofusin 2 signals mitochondrial fusion, interferes with Bax activation, and reduces susceptibility to radical induced depolarization[J]. J Biol Chem, 2005,280(26):25060-25070.
[3] Santel A, Frank S, Gaume B, et al. Mitofusin-1 protein is a generally expressed mediator of mitochondrial fusion in mammalian cells[J]. J Cell Sci, 2003,116(Pt 13):2763-2774.
[4] Sugioka R, Shimizu S, Tsujimoto Y. Fzo1, a protein involved in mitochondrial fusion, inhibits apoptosis[J]. J Biol Chem, 2004,279(50):52726-52734.
[5] Jiang GJ, Han M, Zheng B, et al. Hyperplasia suppressor gene associates with smooth muscle alpha-acfin and is involved in the redifferentiation of vascular smooth muscle ceHs[J]. Heart Vessels, 2006,21(5):315-320.
[6] Jiang GJ, Pan L, Huang XY, et al. Expression of HSG is essential for mouse blastoeyst formation[J]. Biochem Biophys Res Commun, 2005,335(2):351-355.
[7] Soriano FX, Hess M, Bach D, et al. Evidence for amitochondrial regulatory pathway defined by peroxisome proliferator-activated re ceptor-gamma coaetivator-1 alpha, estrogenwrelated receptor-alpha, and mitofusin2[J]. Diabetes, 2006,55(6):1783-1791.
[8] Wang W, Zhou D, Wei J, et al. Hepatitis B virus X protein inhibits p53-mediated upregulation of mitofusin-2 in hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2012,421(2):355-360.
[9] Jin B, Fu G, Pan H, et al. Anti-tumour efficacy of mitofusin-2 in urinary bladder carcinoma[J]. Med Oncol, 2011,28(Suppl 1):373-380.
[10] Rehman J, Zhang HJ, Toth PT, et al. Inhibition of mitochondrial fission prevents cell cycle progression in lung cancer[J]. FASEB J, 2012,26(5):2175-2186.
[11] 丁焕然,姜广建,马小兵,等.肺癌组织中HSG、p21和PCNA的表达及意义[J].临床与实验病理学杂志,2009,25(2):147-150.
[12] 章骏,赵怡,王群,等.乳腺癌组织中HSG 和EGFR 基因mRNA表达与其临床病理因素的相关性研究[J].实用癌症杂志,2014,29(6):629-632.
[13] Zhang GE, Jin HL, Lin XK, et al. Anti-tumor effects of mfn2 in gastric cancer[J]. Int J Mol Sci, 2013,14(7):13005-13021.
[14] Wang W, Lu J, Zhu F, et al. Pro-apoptotic and anti-proliferative effects of mitofusin-2 via Bax signaling in hepatocellular carcinoma cells[J]. Med Oncol, 2012,29(1):70-76.
[15] Cheng X, Zhou D, Wei J, et al. Cell-cycle arrest at G2/M and proliferation inhibition by adenovirus-expressed mitofusin-2 gene in human colorectal cancer cell lines[J]. Neoplasma, 2013,60(6):620-626.
Expression changes of Mfn2 in infiltrating ductal carcinoma of breast and the clinical significance
XIEYan-li,JIAOJun-qin,LIUYue-ping,MALi
(TheFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China)
Abstract:ObjectiveTo observe the expression changes of mitofusin 2 (Mfn2) in infiltrating ductal carcinoma of breast and to investigate its clinical significance. MethodsThe immunohistochemical SP method was used to assess the expression of Mfn2 in 116 cases of infiltrating ductal carcinoma of breast (observation group) and 10 cases of normal breast ductal epithelial tissues (control group). The relationships between Mfn2 expression and the clinicopathological parameters of breast infiltrating ductal carcinoma patients were analyzed. ResultsThe positive expression rates of Mfn2 in the observation and control groups were 44.82% (52/116) and 90.00% (9/10), respectively (all P<0.05). The Mfn2 expression was related with lymph node metastasis, histological grade, TNM staging, estrogen receptor, progesterone receptor and epidermal growth factor receptor-2 of breast infiltrating ductal carcinoma (all P<0.05). ConclusionThe Mfn2 expression is decreased in the breast infiltrating ductal carcinoma tissues, which may play an important role in the occurrence and development of infiltrating ductal carcinoma of breast
Key words:breast neoplasms; infiltrating ductal carcinoma of breast; mitofusin 2
(收稿日期:2014-11-02)
通信作者简介:马力(1975-),男,博士,硕士生导师,主任医师,主要研究方向为乳腺肿瘤的基础和临床研究。E-mail:mali1021@126.com
作者简介:第一谢艳丽(1977-),女,在职硕士研究生在读,主要研究方向为乳腺肿瘤的基础和临床研究。E-mail:13831120102@163.com
基金项目:河北省医学科学研究重点课题计划项目(ZL20140021)。
中图分类号:R737.9
文献标志码:A
文章编号:1002-266X(2015)11-0018-03
doi:10.3969/j.issn.1002-266X.2015.11.006

