藏红花酸预处理对心肌缺血再灌注损伤大鼠心肌的保护作用及机制探讨
孙经武,王艳艳,房灿,樊维娜(滨州医学院烟台附属医院,山东烟台 6400;咸阳市中心医院)
藏红花酸预处理对心肌缺血再灌注损伤大鼠心肌的保护作用及机制探讨
孙经武1,王艳艳1,房灿1,樊维娜2(1滨州医学院烟台附属医院,山东烟台 264100;2咸阳市中心医院)
摘要:目的观察藏红花酸预处理对心肌缺血再灌注损伤大鼠心肌的保护作用,并探讨其可能机制。方法 30只健康雄性Wistar大鼠随机分为3组,C组大鼠先连续灌服0.5%羟甲基纤维素钠(CMC-Na)1周,10 mL/(kg·d),7 d后开胸,只穿线不结扎冠状动脉;B组大鼠先连续灌服0.5%CMC-Na 1周,10 mL/(kg·d),7 d后开胸结扎冠状动脉前降支45 min,再灌注180 min,建立心肌缺血再灌注损伤模型;A组大鼠造模前1周连续给予0.5%藏红花酸50 mg/(kg·d)灌胃,余处理同B组。采用HE染色法观察大鼠心肌形态学改变,黄嘌呤氧化酶法检测血清超氧化物歧化酶(SOD)活性,硫代巴比妥酸法检测血清丙二醛(MDA)含量,硝酸还原酶法检测血清NO,比色法检测血清内皮型一氧化氮合酶(eNOS)、诱导型一氧化氮合酶(iNOS),RT-PCR法检测心肌组织eNOS、iNOS mRNA。结果 C组大鼠心肌细胞排列整齐,无炎性细胞浸润及及损伤、水肿等表现;与C组比较,B组大鼠心肌纤维排列紊乱,有断裂,间质增宽、水肿,心肌纤维间可见大量炎性细胞浸润;而A组改变程度较B组轻。与C组比较,A组血清MDA含量升高,B组血清SOD活性降低、MDA含量升高;与B组比较,A组SOD活性增加、MDA含量降低(P均<0.01)。与C组比较,A组血清eNOS水平降低,心肌组织iNOS、eNOS mRNA升高;B组血清NO、eNOS水平降低,心肌组织iNOS、eNOS mRNA升高(P<0.05或0.01)。与B组比较,A组血清NO、eNOS 及心肌组织eNOS mRNA升高,血清iNOS及心肌组织iNOS mRNA降低(P<0.05或0.01)。结论藏红花酸预处理可减轻心肌缺血再灌注损伤大鼠心肌形态学改变及心肌损伤,其机制可能与抑制iNOS表达、增加eNOS表达从而增加NO活性有关。
关键词:藏红花酸;心肌缺血再灌注损伤;内皮型一氧化氮合酶;诱导型一氧化氮合酶
急性心肌梗死在心血管疾病中属于高发病率和高病死率的一员,以往临床多采用溶栓或急诊经皮冠状动脉介入治疗,虽然这些治疗方法已被大大改善,但患者的治疗效果并不理想,缺血再灌注损伤是影响患者康复的最重要因素之一[1]。藏红花酸作为藏红花提取物的主要活性成分,已经被证实可以减轻缺血损伤引起的氧化应激[2]、炎症反应[3]及细胞凋亡[4]。本研究观察了藏红花酸预处理对心肌缺血再灌注损伤大鼠心肌的保护作用,并探讨其可能机制。
1材料与方法
1.1药品及试剂藏红花酸提取物购自济南浩化实业有限责任公司,为砖红色粉末,使用前以0.5%羧甲基纤维素钠(0.5%CMC-Na)制成0.5%的悬浮液,剂量50 mg/kg。超氧化物歧化酶(SOD)、丙二醛(MDA)、NO及内皮型一氧化氮合酶(eNOS)、诱导型一氧化氮合酶(iNOS)试剂盒购自南京建成生物工程研究所,HE所需相关试剂如伊红、苏木精、盐酸酒精分化液等由本实验室自行配制而成。羧甲基纤维素钠(CMC-Na)购于Sigma公司;TRIzol试剂、逆转录试剂盒、荧光定量检测试剂盒购于大连宝生物工程有限公司;引物设计与合成由上海生工生物工程有限公司完成。
1.2实验动物分组及预处理30只健康成年Wistar大鼠,均为雄性,体质量(220±20)g,购自山东大学实验动物中心。所有大鼠随机分为A、B、C组各10只。C组大鼠先灌服0.5%CMC-Na 1周,10 mL/(kg·d),7 d后开胸,只穿线不结扎冠状动脉;B组大鼠先灌服0.5%CMC-Na 1周,10 mL/(kg·d),7 d后开胸结扎冠状动脉前降支45 min,再灌注180 min,建立心肌缺血再灌注损伤模型;A组大鼠造模前1周给予0.5%藏红花酸50 mg/(kg·d)灌胃,余处理同B组。
1.3大鼠心肌缺血再灌注模型制备 A、B组大鼠均制备模型。大鼠术前禁食6 h。20%乌拉坦按8 mL/kg对大鼠实施腹腔注射麻醉,仰卧位固定,打开电脑及Medlab信号采集系统,连接心电图(右上肢红色,左下肢黄色,右下肢黑色)记录Ⅱ导联心电图。气管插管连接小动物呼吸机(潮气量8 mL/kg,频率65次/min,吸呼比为1∶2)。在胸骨左缘剪开胸部皮肤,剪断第4肋并分离肋间肌,刺破胸膜进入胸腔,暴露心脏,剪开心包膜,将心脏挤出胸腔,于左心耳与肺动脉圆锥交界处下约3~4 cm处穿线,结扎冠状动脉左前降支,同时将一根直径2 mm的聚乙烯管置于结扎线与冠状动脉之间,拉紧结扎线使管压迫冠状动脉引起冠脉闭塞,造成急性心肌缺血模型,观察心电图,以出现ST段显著抬高为结扎成功标志。在缺血45 min后,取出聚乙烯管及再灌注,以心脏表面颜色转红、抬高的ST段下降在1/2以上为再灌注成功标志,再灌注180 min。C组的动物手术过程与A、B组相同,但只穿线不结扎冠状动脉。
1.4心肌组织形态学观察采用苏木精—伊红染色方法对心肌组织进行染色,采用Image-proplus信号采集系统观察心肌组织形态学改变。
1.5血清SOD活性、MDA含量检测根据说明书方法操作,采用硫代巴比妥酸法测定MDA含量,黄嘌呤氧化酶法测定SOD活力。
1.6血清NO、eNOS、iNOS水平检测根据说明书方法操作,采用硝酸还原酶法测定NO,比色法测定eNOS、iNOS。
1.7心肌组织eNOS、iNOS mRNA检测①引物设计与合成:eNOS、iNOS、β-actin的cDNA序列从Genebank中获得。eNOS上游引物序列:5′-GGTGGACAACATCGCTCTG-3′,下游引物序列:5′-AGACAGCCAGGAGAAATCAAAC- 3′;iNOS上游引物序列:5′-TTGCTACAGGGTTTCATCCAG-3′,下游引物序
列:5′-ATGTTGTTGTCCAGTTCATCG-3′;β-actin上游引物序列:5′-GAAGTGTGACGTTGACATCCG-3′,下游引物序列:5′-TGCTGATCCACATCTGCTGGA-3′。②RNA提取与逆转录:用TRIzol一步法提取RNA,测定RNA的浓度和纯度;逆转录按试剂盒说明书操作。③SYBRGreen实时定量PCR:按SYBR Premix Ex TaqTM的 RT-PCR试剂盒说明书操作,扩增条件为95 ℃、30 s,95 ℃、5 s,60 ℃、34 s,40个循环。用2-ΔΔCt方法分析各组mRNA的差异。
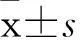
2结果
2.1各组大鼠心肌组织形态学变化C组大鼠心肌细胞排列整齐,无炎性细胞浸润及及损伤、水肿等表现;与C组比较,B组心肌纤维排列紊乱,有断裂,间质增宽、水肿,心肌纤维间可见大量炎性细胞浸润;而A组心肌纤维排列紊乱,可见变性坏死灶,但程度较B组轻。
2.2各组大鼠血清SOD活性、MDA含量比较结果见表1。
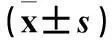
表1 各组大鼠血清SOD活性、MDA含量比较
注:与C组比较,*P<0.01;与B组比较,△P<0.01。
2.3各组大鼠血清NO、eNOS、iNOS及心肌组织eNOS、iNOS mRNA水平比较结果见表2。
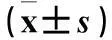
表2 各组大鼠血清NO、eNOS、iNOS及心肌组织eNOS、iNOS mRNA水平比较
注:与C组比较,*P<0.05,△P<0.01;与B组比较,#P<0.05,▲P<0.01。
3讨论
近年来,缺血性心脏疾病已成为导致死亡的主要原因之一;通过纤维蛋白溶解或血管成形术的早期冠状动脉再灌注已经成为此病的主要治疗方法,并被广泛应用到减轻缺血性损伤[5]。然而再灌注诱导激活一个名为再灌注损伤的有害级联反应,其中氧化应激作为一个启动脂质过氧化、DNA及蛋白质损伤的主要贡献者发挥作用[6~8]。因此,开发减少氧化应激、提高再灌注治疗心脏益处的辅助治疗措施很有必要[9]。
藏红花酸是藏红花提取物的主要活性成分之一,在中国传统医学特别是藏医学中发挥重要作用,其属类胡萝卜素物质,具有多不饱和共轭烯酸结构,既往的相关研究已经证实其对脑、肺、肾、肝的缺血再灌注损伤有保护作用,其机制可能涉及抑制氧化应激炎症反应、细胞凋亡等方面。但尚未有藏红花酸对心肌缺血再灌注损伤相关作用的研究,故本研究通过建立大鼠心肌缺血再灌注损伤模型,进一步揭示藏红花酸在大鼠心肌缺血再灌注损伤中的保护作用机制。本研究显示,与C组比较,B组心肌纤维排列紊乱,有断裂,间质增宽、水肿,心肌纤维间可见大量炎细胞浸润;而A组改变程度较B组轻。缺血再灌注后,氧自由基生成增多,其体现在血清SOD活性和MDA含量。SOD是细胞内源性的氧自由基清除剂,其可清除体内过多的氧自由基对心肌的损害,使心肌免于氧自由基的损伤。MDA是细胞膜脂质自由基和脂质过氧化物断裂形成小分子物质,其活性增加可说明脂质过氧化反应增强,心肌组织受心肌缺血再灌注的损伤重。故SOD活性及MDA含量可反映心肌缺血再灌注损伤的轻重[10]。本研究还发现,与C组比较,A组血清MDA含量升高,B组血清SOD活性降低、MDA含量升高;与B组比较,A组血清SOD活性增加、MDA含量降低。间接说明藏红花酸预处理可以减轻心肌缺血再灌注损伤。
生理情况下NO由eNOS催化合成,其可调节心脏的收缩与舒张功能,在体内亦可以实现从单个心肌细胞到完整心脏的耗氧量储备,亦可调节内皮细胞的功能[11]。然而,在病理情况下,如糖尿病和心肌缺血再灌注时,炎症反应会促使iNOS表达增加进而引起其合成的NO增加,对心脏功能产生不利影响[12]。此外,在IR或缺氧复氧的情况下,大量的NO与超氧化物自由基反应形成过氧亚硝酸盐,它的氧代亚硝化反应可能会增加它的有害影响[13]。心肌缺血再灌注后内皮功能失调和炎症过程的激活同时存在,内皮功能失调表现为eNOS活性降低,其产生的有益的NO减少,而炎症过程激活后,进而引起iNOS激活,使其产生的NO增加,从而对心脏产生毒性作用。与C组比较,A组血清eNOS水平降低,心肌组织iNOS、eNOS mRNA升高;B组血清NO、eNOS水平降低,心肌组织iNOS、eNOS mRNA升高。与B组比较,A组血清NO、eNOS及心肌组织eNOS mRNA升高,血清iNOS及心肌组织iNOS mRNA降低。说明藏红花酸预处理可以通过抑制iNOS表达、促进eNOS表达进而增加NO表达释放来发挥心肌保护作用。
总之,藏红花酸预处理可以减轻心肌缺血再灌注损伤后大鼠心肌组织的形态学损伤,减少氧自由基的生成,对心肌有保护作用,其机制可能与抑制iNOS表达、增加eNOS表达从而增加NO活性有关。
参考文献:
[1] Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013,123(1):92-100.
[2] Yoshino F, Yoshida A, Umigai N, et al. Crocetin reduces the oxidative stress induced reactive oxygen species in the stroke-prone spontaneously hypertensive rats (SHRSPs) brain [J]. J Clin Biochem Nutr, 2011,49(3):182-187.
[3] Nam KN, Park YM, Jung HJ, et al. Anti-inflammatory effects of crocin and crocetin in rat brain microglial cells[J]. Eur J Pharmacol, 2010,648(1-3):110-116.
[4] Yang R, Vernon K, Thomas A, et al. Crocetin reduces activation of hepatic apoptotic pathways and improves survival in experimentalhemorrhagic shock [J]. JPEN J Parenter Enteral Nutr, 2011,35(1):107-113.
[5] Schwartz LL, Kloner RA, Arai AE, et al. New horizons in cardioprotection: recommendations from the 2010 national heart, lung, and blood institute workshop[J]. Circulation, 2011,124(10):1172-1179.
[6] Pei H, Qu Y, Lu X, et al. Cardiac derived adiponectin induced by long-term insulin treatment ameliorates myocardial ischemia/reperfusion injury in type 1 diabetic mice via AMPK signaling [J]. Basic Res Cardiol, 2013,108(1):322.
[7] Hariharan N, Zhai P, Sadoshima J. Oxidative stress stimulates autophagic flux during ischemia/reperfusion [J]. Antioxid Redox Signal, 2011,14(11):2179-2190.
[8] Tao L, Gao E, Jiao X, et al. Adiponectin cardioprotection after myocardial ischemia/reperfusion involves the reduction of oxidative/nitrative stress[J]. Circulation, 2007,115(11):1408-1416.
[9] Pei H, Jia M, Sun L, et al. A hypothesis: edaravone exert cardioprotection partly via modulation of adiponectin[J]. Med Hypotheses, 2012,79(2):141-142.
[10] Sauerl HH, Allenl SJ, Laine GA. Impact of crystalloid HTK and St. Thomas, cardioplegia on myocardial fluid balance and postcardioplegic stunning[J]. Cardiovasc Engin, 2003,8(1):58-65.
[11] Shah AM, MacCarthy PA. Paracrine and autocrine effects of nitric oxide on myocardial function[J]. Pharmacol Ther, 2000,86(1):49-86.
[12] Song D, Kuo KH, Yao R, et al. Inducible nitric oxide synthase depresses cardiac contractile function in zucker diabetic fatty rats[J]. Eur J Pharmacol, 2008,579(1-3):253-259.
[13] Li H, Forstermann U. Nitric oxide in the pathogenesis of vascular disease[J]. J Pathol, 2009,190(3):244-254.
(收稿日期:2014-11-20)
基金项目:烟台市科技发展计划项目(2012018)。
中图分类号:R542.2
文献标志码:A
文章编号:1002-266X(2015)11-0029-03
doi:10.3969/j.issn.1002-266X.2015.11.010

