腹腔镜联合荷包空肠穿刺造瘘术在食管癌术后营养中的应用
李昆昆 马 铮 谭群友 郭 伟 龚太乾 王如文 梅龙勇
(第三军医大学附属大坪医院野战外科研究所胸外科,重庆 400042)
·技术改进·
腹腔镜联合荷包空肠穿刺造瘘术在食管癌术后营养中的应用
李昆昆 马 铮*谭群友 郭 伟 龚太乾 王如文 梅龙勇
(第三军医大学附属大坪医院野战外科研究所胸外科,重庆 400042)
目的 探讨自行设计的空肠-腹壁联合荷包技术在微创食管癌手术同期行腹腔镜空肠穿刺造瘘术的可行性,及造瘘管在术后营养支持中的应用价值。 方法 腹腔镜下采用穿刺技术完成腹壁肌层-肠壁浆肌层联合荷包缝合,于缝合环线中置入F9空肠造瘘管,收紧缝线,皮下打结。 结果 24例均在腹腔镜下完成,平均操作时间8 min(4~20 min)。术中穿刺针贯穿肠壁1例,造瘘管脱落2例,造瘘管堵塞1例,手术并发症发生率16.7%(4/24)。术后营养支持中仅1例不能耐受,拔除造瘘管;其余患者带管至完成第1次或第2次化疗,进食量达平时量70%以上后拔除,平均保留时间为28 d(8~56 d)。2例腹胀,腹痛2例,无肠坏死、肠梗阻、肠扭转、腹膜炎等并发症,经调整治疗后缓解。 结论 腹腔镜联合荷包空肠穿刺造瘘术操作简便、安全有效,能提供早期、长时的肠内营养支持,对食管癌术后营养支持有重要应用价值。
联合荷包; 空肠穿刺造瘘术; 腹腔镜; 食管癌切除; 营养支持
随着手术的进步及抗癌药物的研发,食管癌的治疗已经取得了很大进步,但是术后并发症严重影响患者康复及生活质量[1]。食管癌患者由于进食困难、术前新辅助放化疗的副反应、食管重建、术后放化疗等原因,均会导致营养摄入不足,造成不同程度营养不良[2],增加术后并发症的发生,延长术后恢复时间,降低生活质量[3,4]。Mazaki等[5]通过meta分析证实早期、适宜的肠内营养支持能够减少术后并发症发生,缩短住院时间。2013年5月~2014年4月我科采用自行设计的空肠-腹壁联合荷包缝合技术行腹腔镜下空肠造瘘术24例,具有操作简便、安全有效的优势,现报道如下。
1 临床资料与方法
1.1 一般资料
本组24例,男20例,女4例。年龄44~75岁,平均60.4岁。主要症状:剑突下烧灼感2例,胸骨后不适1例,上腹部不适1例,胸背部疼痛2例,呕吐1例,轻度吞咽困难8例,中度吞咽困难9例。肿瘤部位:颈段1例,上段4例,中段15例,下段4例。病理类型:鳞癌23例,腺癌1例。TNM分期:Ⅰ期5例,Ⅱ期10例,Ⅲ期9例。
病例选择标准:全身情况良好,有较好的心肺功能储备,TNM分期Ⅰ~Ⅲ期,同意行食管癌切除重建、空肠造瘘术及签署相关知情同意书。
1.2 方法
穿刺套件为福瑞可空肠造瘘装置[Freka fine needle/catheter jejunostomy set,型号:YZB/GEM 3492-2010,批文号:国食药监械(进)字2010第2663484号],见图1。全麻下常规建立人工气腹(8 mm Hg),取脐上1.5 cm为腹腔镜观察孔,左侧平脐上2 cm腹直肌外缘为辅助操作孔1.0 cm,右侧平脐上2 cm及肋弓下缘腹直肌外缘为主操作孔1.5、1.0 cm,分别置入trocar。完成腹腔内胃游离后,选择距屈氏韧带40 cm处为空肠穿刺点(图2a),扩大左侧辅助孔至10 mm达皮下,荷包线直针分别由穿刺孔左下方及右下方0.5 cm处从皮下穿刺进入腹腔,在腹腔镜引导下围绕拟定空肠穿刺点于游离缘再次沿肠壁长轴行浆肌层穿刺2~3 cm(图2a,b),两针平行间隔1.0 cm,穿刺针出肠壁后再由穿刺孔左上方及右上方0.5 cm处由腹腔向皮下穿出,完成联合荷包缝合。福瑞可肠壁穿刺器经腹壁原穿刺孔进入腹腔后,于肠壁荷包线中间穿刺空肠壁进入肠腔,置入造瘘管(图3),荷包线于皮下收紧打结,使肠壁与腹壁紧密贴合固定,引导造瘘管进入远端空肠约30 cm,确定通畅后缝合皮肤切口2针并将造瘘管固定于腹壁上(图4)。继续完成腹腔内管胃成形或其他操作。
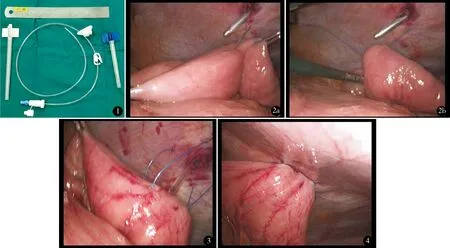
图1 穿刺套件 图2 荷包线从穿刺点左下方穿刺进入腹腔,并穿过空肠浆肌层(a),从左上方穿出(b) 图3 穿刺器通过腹壁及空肠穿刺点进入 图4 置入造瘘管后荷包线收紧,皮下打结肠管,置入造瘘管
2 结果
2.1 术中情况
24例均顺利通过腹腔镜下联合荷包空肠穿刺术置入F9造瘘管,操作时间4~20 min,平均8 min。术中穿刺针贯穿肠壁1例,术中及时发现,1号丝线连续缝合修补。
2.2 联合荷包空肠穿刺术后营养支持
术后第1天经空肠造瘘管泵入葡萄糖氯化钠250 ml,若无渗漏、腹胀、腹泻以及腹膜炎等不良反应,术后第2天开始肠内营养支持,采用营养泵持续匀速泵入。初始速度为30 ml/h,并逐渐增加速度至80~120 ml/h,同时根据患者耐受程度微调。每日营养量初如量为500 kcal/500 ml,逐日增加至1500~2000 kcal/1500~2000 ml。营养支持相关并发症:2例腹胀,给予减慢泵入速度、鼓励下床活动、胃肠动力药物后缓解;1例术后第8天时因不能耐受,拔除造瘘管后改为经口进食并辅助部分肠外营养支持,其余23例均带管至完成第1次或第2次化疗,进食量达平时量70%以上后拔除。平均带管时间28 d(8~56 d)。
2.3 术后并发症
造瘘术相关并发症:术后造瘘管脱落2例,其中1例发生在术后14 d,及时顺利再置入并继续完成肠内营养;1例术后第8天患者拒绝再次置入,改静脉营养。造瘘管堵塞1例,经过变动体位、20%碳酸氢钠反复冲洗后通畅。造瘘管周围渗漏1例,经氧化锌局部换药好转。腹痛2例,分别于术后第6、15天出现,经全消化道钡餐、血常规等检查,无肠坏死、梗阻、扭转、腹膜炎、疝等并发症,药物解痉、物理治疗后好转。
3 讨论
对于消化道手术,尤其是食管癌手术,患者的营养状态与术后并发症(如吻合口漏、感染、ARDS、MOF)、死亡率等密切相关[3,6]。营养支持作为围手术期管理的重要组成部分,受到越来越多人的重视。传统术后鼻肠管营养具有鼻窦炎、鼻衄、鼻咽部疼痛致患者耐受性差、易移位失效、保留时间短、增加感染机会,严重者可以引起肺部及颅内损伤,从而导致术后营养支持效能降低[7,8]。肠造瘘置管具有耐受性好、可长时留管、适于腔镜手术等优势,尤其是发生术后并发症或术后后续放化疗出现严重呕吐、腹泻等副反应时,可以不需要肠外营养的支持。
Fenton等[9]报道151例食管癌或食管高级别瘤变施行食管切除手术,其中143例采用空肠置管术(feeding jejunostomy tubes,FJT),并发症26例(18.2%),包括肠梗阻3例(2.1%),营养管阻塞或脱管5例(3.6%),皮肤或皮下感染18例(12.8%)。空肠穿刺造瘘术(needle catheter jejunostomy,NCJ)自1973年由Delany提出来后经过长期发展,由于创伤小,手术简便逐渐取代FJT[10]。Sica等[11]报道262例空肠穿刺造瘘术,严重并发症4例(1.5%),包括肠梗阻1例、腹膜炎1例、肠瘘1例、切口裂开1例,均需要再次手术治疗。空肠穿刺造瘘术对食管癌患者术后长期营养支持有重要意义,同时可以减少其他营养支持途径的并发症[7~9,11]。
目前,常规腔镜下空肠穿刺造瘘术多采用置管后,肠壁行荷包缝合收紧肠壁减少肠液外渗,同时将肠壁与腹壁间断缝合3~5针固定,使肠壁与相应腹壁紧贴粘连,减少后期肠液渗漏、腹膜炎、腹腔感染风险。由于腔镜下缝合打结技术需要较长时间的镜下训练,不易掌握,同时镜下缝合组织少,常常仅带腹膜层,易于撕脱,造成出血、漏针、肠液外渗等并发症;而且间断缝合的针间间隙亦成为肠液渗漏的空隙,或造成局部脓肿形成[12]。
本组采用腹腔镜下联合荷包技术行空肠穿刺造瘘24例,平均操作时间8 min,不需要镜下缝合打结,易于学习与掌握。初期1例术中出现穿刺针贯穿肠壁外(术中检查发现同期修补)。术后瘘管脱落2例;造瘘管堵塞1例;无肠漏、肠坏死、梗阻、扭转,无腹膜炎、疝等并发症发生。术后第1天通过空肠造瘘管泵入葡萄糖氯化钠250 ml,术后第2天即可开始给肠内营养液,第3天即可增加至1500~2000 kcal/24 h,速度由患者根据自己有无腹胀情况自行控制,术后营养状态完全适应手术恢复所需,本组平均保留时间为28 d。本研究经造瘘管肠内营养能够在禁食状态下替代经口进食补充术后恢复所需营养,减少术后肠外营养的量及时间,降低患者费用及术后感染等肠外营养支持的风险。
我们体会该技术较传统肠壁单独荷包缝合有以下优点:①采用联合荷包技术使肠壁与腹壁可紧密贴合,无传统荷包缝合方式之间隙或脱针风险,最大程度减少肠液沿造瘘管渗入肠腔导致肠漏、腹膜炎的可能;②肠管沿长轴上下两端保留0.5 cm无缝线间隙,保证荷包内肠壁血供,避免肠壁环形荷包过紧使局部肠壁缺血坏死可能;③该技术无须掌握腔镜下缝合打结技术,减少肠内缝线,缩短手术时间。术后常规加强造瘘管护理,避免使用浓稠、含颗粒状营养液,每天可用温水冲洗管腔,保持引流管通畅。另外,由于NCJ可长期携带,要充分告知家庭护理。
综上,腹腔镜联合荷包NCJ无须复杂的腔镜下缝合打结,具有操作简便、有效、费用低廉、易于掌握等特点,值得推广,其在食管癌微创外科中的临床意义有待进一步开展大样本对照研究。
1 Viklund P, Lindblad M, Lagergren J. Influence of surgery related factors on quality of life after esophageal or cardiacancer resection. World J Surg,2005,29(7):841-848.
2 Kight CE. Nutrition considerations in esophagectomy patients. Nutr Clin Pract,2008,23(5):521-528.
3 Marin FA, Lamõnica-Garcia VC, Henry MA, et al. Grade of esophageal cancer and nutritional status impact on post surgery outcomes. Arq Gastroenterol,2010,47(4):348-353.
4 Ryan AM, Hearty A, Prichard RS, et al. Association of hypoalbuminemia on the first postoperative day and complications following esophagectomy. J Gastrointest Surg,2007,11(10):1355-1360.
5 Mazaki T, Ebisawa K. Enteral versus parenteral nutrition after gastrointestinal surgery: a systematic review and meta-analysis of randomized controlled trials in the English literature. J Gastrointest Surg,2008,12(4):739-755.
6 陈保富,朱成楚,马德华,等.胸、腹腔镜联合手术治疗食管癌.中国微创外科杂志,2009,9(8):707-711.
7 Torres Júnior LG, de Vasconcellos Santos FA, Correia MI. Randomized clinical trial: Nasoenteric tube or jejunostomy as a route for nutrition after major upper gastrointestinal operations. World J Surg,2014,38(9):2241-2246.
8 Prabhakaran S, Doraiswamy VA, Nagaraja V, et al. Nasoenteric tube complications. Scand J Surg,2012,101(3):147-155.
9 Fenton JR, Bergeron EJ, Coello M, et al. Feeding jejunostomy tubes placed during esophagectomy: are they necessary? Ann Thorac Surg,2011,92(2):504-511.
10 Delany HM, Carnevale NJ, Garvey JW. Jejunostomy by a needle catheter technique. Surgery,1973,73(5):786-790.
11 Sica GS, Sujendran V, Wheeler J, et al. Needle catheter jejunostomy at esophagectomy for cancer. J Surg Oncol,2005,91(4):276-279.
12 Senkal M, Koch J, Hummel T, et al. Laparoscopic needle catheter jejunostomy modification of the technique and outcome results. Surg Endosc,2004,18(2):307-309.
(修回日期:2015-01-23)
(责任编辑:李贺琼)
Application of Laparoscopic Jejunostomy with Purse Suture in Postoperative Nutritional Support Following Esophagectomy
LiKunkun,MaZheng,TanQunyou,etal.
DepartmentofThoracicSurgery,DapingHospitalandInstituteofCombatSurgeryofThirdMilitaryMedicalUniversity,Chongqing400042,China
MaZheng,E-mail:alex891@foxmail.com
Objective To explore the feasibility and clinical significance of a self-designed jenunum-abdominal wall purse suture technique in radical esophagectomy combined with laparoscopic jejunostomy. Methods A laparoscopic combined purse suture was performed to link the abdominal wall with the intestinal seromuscular layer under puncture techniques. In the central area of the purse suture, a F9needle catheter was placed properly into the intestinal lumina for at least 30 cm, and then the purse suture was fastened and knotted underneath the belly skin. Results The laparoscopic procedure was completed in all the 24 patients, with a mean performance time of 8 min (4-20 min). The ratio of surgical-related complications was 16.7% (4/24). Except 1 patient was given catheter removal due to intolerance to enteral nutrition support, all the patients received planned postoperative enteral nutrition support. The tube was maintained for an average of 28 days (8-56 days) until the accomplishment of the first or second chemotherapy as well as 70% of the intake of diet amount. The complication associated with the nutrition support was abdominal distension in 2 cases. No intestinal necrosis, intestinal obstruction, intestinal twist, or peritonitis occurred. Conclusion Laparoscopic jejunostomy with purse suture is a technically feasible, safe, and effective way for nutritional support in the early phase after esophagectomy.
Purse suture; Jejunostomy; Laparoscopy; Esophagectomy; Nutrition
R735.1
B
1009-6604(2015)04-0355-03
10.3969/j.issn.1009-6604.2015.04.021
2014-08-18)
*通讯作者,E-mail:alex891@foxmail.com

