小白菊内酯对人前列腺癌细胞PC-3凋亡作用的机制探讨
艾俊(曲靖市第一人民医院肿瘤外科,云南曲靖 655000)
小白菊内酯对人前列腺癌细胞PC-3凋亡作用的机制探讨
艾俊
(曲靖市第一人民医院肿瘤外科,云南曲靖 655000)
摘要目的:探讨小白菊内酯诱导人前列腺癌细胞PC-3凋亡的作用及其机制。方法:体外培养人前列腺癌细胞PC-3,用不同浓度(0、10、20、40μmol·L-1)小白菊内酯作用PC-3细胞24、48、72 h后,采用CCK8法观察PC-3细胞在增殖方面的变化,采用流式细胞术检测小白菊内酯对PC-3细胞凋亡的影响,采用RT-PCR技术检测PC-3细胞bax、bcl-2的m RNA表达水平。结果:经小白菊内酯处理后,CCK8检测显示PC-3细胞增殖率显著下降(P<0.05),流式细胞术检测显示PC-3细胞凋亡率显著升高(P<0.05),RT-PCR检测显示PC-3细胞bax m RNA表达水平增高(P<0.05)、bcl-2 m RNA表达水平降低(P<0.05)。结论:小白菊内酯通过诱导凋亡能抑制人前列腺癌细胞PC-3的增殖,这可能与其上调bax和降低bcl-2 m RNA表达有关。
关键词:小白菊内酯;PC-3细胞;凋亡;Bcl-2 mRNA;Bax m RNA
前列腺癌为侵袭性腺癌,生物学特点为前列腺功能障碍和随着时间发展而进行的继发性转移[1,2]。在全球范围内,前列腺癌是男性癌症死亡相关的第六大病因,其发病率在美国已经攀至第二名[3,4]。近年来,我国前列腺癌的发病率和病死率也在呈上升趋势[5]。该病早期可采用手术治疗,晚期通常采用包括外科手术、放射疗法、激素疗法和化学疗法,或几种方法的组合治疗。但是这些传统方法有着很大弊端,激素阻断治疗随着治疗时间的延长,肿瘤往往会转变为激素抵抗型前列腺癌,而大多数现有的化疗则会出现显著的副作用,如尿失禁和勃起功能障碍等[6,7]。因此,发展新的治疗策略,从分子靶点上寻找一种高效低毒的抗前列腺癌药物对提高晚期前列腺癌患者的生存率和改善患者症状具有重大意义。
小白菊内酯是从菊科植物中提取的一种倍半萜内酯化合物,主要用于治疗偏头痛、风湿病及炎症[8]。近年来研究发现,小白菊内酯具有较强的抗肿瘤活性,在体外可抑制多种肿瘤细胞株的生长增殖,比如肝癌[9]、卵巢癌[10]、乳腺癌[11]和胆管癌[12]等。但小白菊内酯对人前列腺癌细胞PC-3的作用还未见报道,因此,本研究拟通过体外实验,观察不同浓度小白菊内酯作用于人前列腺癌PC-3细胞株后细胞增殖、凋亡的情况,并观察PC-3细胞bax、bcl-2 mRNA表达水平的变化,初步探讨其可能的作用机制,为小白菊内酯临床治疗前列腺癌提供理论依据。
1 材料与方法
1.1 材料
PC-3细胞株(中科院上海细胞生物研究所),小白菊内酯(美国Sigma公司),RPMI1640培养基、胎牛血清(美国Gibco公司),酶标仪(美国Thermo Fisher Scientific公司)。流式细胞仪(美国Couler公司),CCK8试剂盒、V-FITC凋亡检测试剂盒(上海碧云天研究所)。
1.2 方法
1.2.1 细胞培养
PC-3细胞接种于含10%胎牛血清(FBS)和100 U·ml-1青霉素、100 U·ml-1链霉素的RPMI-1640培养基中,置于37℃,5%CO2培养箱内培养,取对数生长期细胞用于实验。
1.2.2 药物配制
小白菊内酯用DMSO溶解配制成浓度为100 mmol·L-1的药液,置于4℃冰箱避光保存,用时以含10%胎牛血清的RPMI-1640培养基稀释后使用。
1.2.3 PC-3细胞增殖活性测定
采用CCK8法测定PC-3细胞增殖抑制情况。收集对数生长期PC-3细胞,消化、计数,按每孔5×103个细胞接种于96孔板中,每孔加入细胞悬液100μl,置于37℃,5%CO2培养箱内预培养24 h。之后向实验组每孔加入10μl含不同浓度小白菊内酯的RPMI-1640培养基使得实验组的终浓度分别为10、20、40μmol·L-1,另设对照组(不含小白菊内酯),每组设4个副孔以确保实验准确性。分别使药物作用24、48、72 h后,在避光条件下每孔加入10μl CCK8溶液。放回培养箱继续孵育2 h 后,取出培养板用酶标仪测每组的吸光值(A4 5 0),实验独立重复3次。
1.2.4 PC-3细胞凋亡率测定
采用流式细胞术检测PC-3细胞凋亡率。消化、收集PC-3细胞,按每孔1×106个细胞的密度接种于6孔板。待细胞完全贴壁后换液,加入含不同浓度小白菊内酯(10、20、40μmol·L-1)的完全培养基,另设对照组(加入等体积完全培养基),每组设5个副孔。继续培养48 h后收集各组细胞,以4℃的PBS溶液洗涤3次,用Annexin V-FITC及碘化丙啶(PI) (50μg·ml-1)避光室温染色15 min后,流式细胞仪检测PC-3细胞凋亡率。
1.2.5 PC-3细胞bax、bcl-2 m RNA表达测定
采用逆转录聚合酶链式反应(RT-PCR)检测PC-3细胞bax、bcl-2 m RNA表达。将10、20、40μmol·L-1浓度的小白菊内酯处理PC-3细胞48 h,用Trizol法收集PC-3细胞总RNA,之后逆转录为cDNA。然后用PCR法检测bax、bcl-2 m RNA表达水平,以β-actin为内参。PCR引物序列如下: β-actin上游引物:5'-CTACAATGAGCTGCGTGTGG-3';下游引物:5'-TAGCTCTTCTCCAGG GAGGA-3',扩增片段长度450 bp;Bax上游引物:5'-TGCTTCAGGGTTTCATCCAG-3';下游引物:5'-GGCGGCAATCATCCTCTG-3',扩增片段长度169bp;Bcl-2扩增上游引物::5'-GCTCTGAACAGATCATGAAGACAG-3';下游引物:5'-CAATCCAAAGTGGACCTGAGG-3',扩增片段长度746 bp。反应条件:95oC预变性4 min,94oC 30 s,52oC30 s,72oC 60 s,循环30次;72oC 10 min,4oC holding。取出扩增产物,利用1.5%的琼脂糖凝胶电泳检测PCR扩增结果,通过凝胶分析系统记录分析,计算目的基因与内参(β-actin)扩增条带光强度的比值,即得出目的基因m RNA相对表达的高低。
1.3 统计学分析
运用SPSS18.0统计软件进行单因素方差分析,实验数据以平均值±标准差(±SD)表示,P<0.05被认为结果具有统计学意义。
2 结果
2.1 小白菊内酯抑制PC-3细胞的增殖
通过CCK8实验结果发现,高浓度小白菊内酯对PC-3细胞的增殖有着明显抑制作用,图1所示,相比对照组,实验组随小白菊内酯浓度增加和作用时间的延长,PC-3细胞增殖能力受到显著抑制。
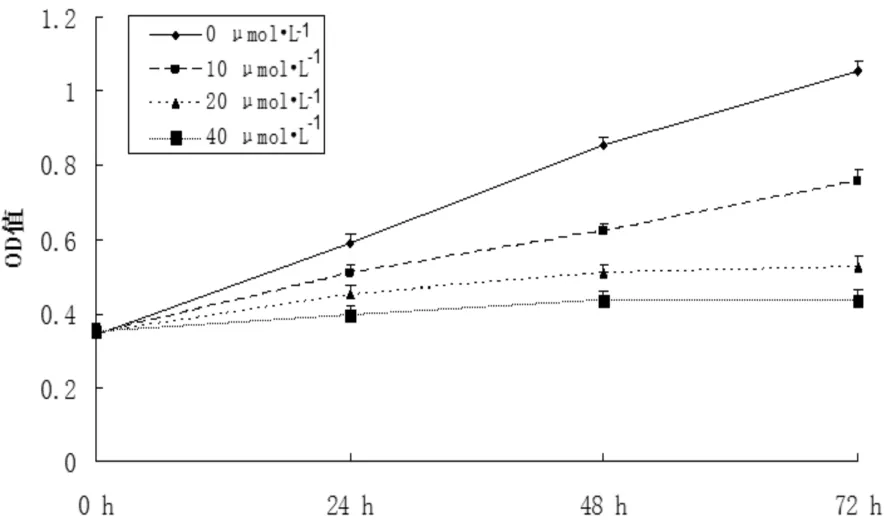
图1 各浓度小白菊内酯孵育PC-3细胞24、48、72h后的增殖情况
2.2 小白菊内酯促进PC-3细胞的凋亡
经不同浓度小白菊内酯孵育PC-3细胞48 h后,使用流式细胞仪测定细胞凋亡率,结果显示:小白菊内酯处理组(10、20、40μmol·L-1)PC-3细胞发生不同程度的凋亡,相比对照组细胞凋亡率均明显升高,且随药物浓度的增加,凋亡率明显上升,呈剂量依赖性关系,各实验组间差异具有统计学意义(P< 0.05),见图2。

图2 各浓度小白菊内酯孵育PC-3细胞48h后检测其细胞凋亡率注:与对照组比较,*P<0.05
2.3 小白菊内酯上调bax m RNA、降低bcl-2 m RNA表达
经不同浓度小白菊内酯孵育PC-3细胞48 h后,采用RTPCR检测PC-3细胞的bax m RNA、bcl-2 m RNA表达,结果显示:相比对照组,小白菊内酯组(10、20、40μmol·L-1)的PC-3细胞bax m RNA表达水平随药物浓度增高显著上升(见图3A),而bcl-2 m RNA表达水平随药物浓度增高明显降低(见图3B),两者都呈剂量依赖性,各药物组间差异具有统计学意义(P <0.05)。

图3 (A)不同浓度小白菊内酯处理PC-3细胞48h 后bax/β-actin的比值;(B)不同浓度小白菊内酯处理PC-3细胞48h后bcl-2/β-actin的比值
3 讨论
近年来,从植物中提取新的抗肿瘤药物已成为研究的热点[13]。小白菊内酯是野甘菊中的主要成分,在西方国家用于治疗偏头痛、皮肤感染等疾病[14,15]。此外还有研究发现,小白菊内酯具有较强的抗肿瘤活性,在体外可抑制多种肿瘤细胞株的生长增殖[9,10,11,12]。因此,小白菊内酯作为一种植物来源的抗肿瘤药物,研究其对人前列腺癌细胞PC-3凋亡的作用及其机制对其临床应用有着较为现实的意义。
CCK-8法是一种操作简便、灵敏度高、步骤少,结果准确可靠,重复性好的细胞活性检测方法[16]。本研究发现,使用CCK-8法检测经小白菊内酯孵育后的PC-3细胞增殖活性随着药物浓度和时间的增加显著降低,并且流式细胞仪检测显示小白菊内酯处理组PC-3细胞发生不同程度凋亡现象,药物浓度越高,凋亡率越高,呈剂量依赖性关系,这提示了小白菊内酯抑制细胞增殖活性与诱导细胞凋亡有关。
凋亡,又称程序性死亡,是由基因调控细胞衰老、维持机体正常运行的重要机制,由一系列细胞内外信号通路精密调控,各种凋亡信号通过信号传导通路传至细胞内,激活靶基因产生效应,引起凋亡[17],因此,细胞凋亡的失调常常会导致肿瘤的发生。已有的研究结果表明,线粒体是细胞凋亡的主要执行者, 而bcl-2家族成员与线粒体介导的凋亡途径密切相关[18,19]。Bax和bcl-2基因都是bcl-2家族的主要成员,bax基因虽与bcl-2基因具有21%的同源性,作用却相反,其表达产物与BCL-2蛋白结合并抑制其抗凋亡作用,进而促进细胞的凋亡[20],而bcl-2基因是目前公认的抗凋亡基因,通过抑制多种形式的细胞凋亡过程致细胞数目增加,对肿瘤细胞的增殖起促进作用[17]。因此,bax m RNA表达增高可促进细胞的凋亡,bcl-2 m RNA表达水平的下降可诱导细胞凋亡。在本研究中,随着小白菊内酯浓度的升高,PC-3细胞凋亡率明显升高,促凋亡因子bax m RNA的表达明显增高,抗凋亡因子bcl-2 m RNA的表达明显下降。因此得出结论:小白菊内酯通过上调bax mRNA的表达及降低bcl-2 m RNA的表达来诱导前列腺癌细胞PC-3的凋亡,并呈一定的剂量依赖性。
4 结论
综上所述,小白菊内酯对前列腺癌PC-3细胞的增殖起显著抑制作用,其机制可能与其诱导PC-3细胞凋亡及上调bax m RNA和降低bcl-2 m RNA的表达相关,具体机制有待进一步研究。
参考文献
1 Aparicio A,Logothetis CJ,Maity SN.Understanding the lethal variant of prostate cancer:power of examining extremes[J].Cancer Discov,2011,1(6):466-468.
2 Paller CJ,Antonarakis ES.Management of biochemically recurrent prostate cancer after local therapy:evolving standards of care and new directions[J].Clin Adv Hematol Oncol,2013,11(1):14-23.
3 Baade PD,Youlden DR,Krnjacki LJ.International epidemiology of prostate cancer:geographical distribution and secular trends[J].Mol Nutr Food Res,2009,53(2):171-184.
4 Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
5 Effi AB,Koffi KE,Aman NA,et al.Descriptive epidemiology of cancers in Cote d'Ivoire[J].Bull Cancer,2013,100(2):119-125.
6 Fuessel S,Meye A,Schmitz M,et al.Vaccination of hormone-refractory prostate cancer patients with peptide cocktail-loaded dendritic cells:results of a phase I clinical trial[J].Prostate,2006,66 (8):811-821.
7 Yip K,Alonzi R.Carbogen gas and radiotherapy outcomes in prostate cancer[J].Ther Adv Urol,2013,5(1):25-34.
8 Mathema VB,Koh YS,Thakuri BC,et al.Parthenolide,a sesquiterpene lactone,expresses multiple anticancer and anti-inflammatory activities[J].Inflammation,2012,35(2):560-565.
9 Sun J,Zhang C,Bao YL,et al.Parthenolide-induced apoptosis,autophagy and suppression of proliferation in HepG2 cells[J].Asian Pac J Cancer Prev,2014,15(12):4897-4902.
10 Kwak SW,Park ES,Lee CS.Parthenolide induces apoptosis by activating the mitochondrial and death receptor pathways and inhibits FAK-mediated cell invasion[J].Mol Cell Biochem,2014,385(1): 133-144.
11 Li CJ,Guo SF,Shi TM.Culture supernatants of breast cancer cell line MDA-MB-231 treated with parthenolide inhibit the proliferation,migration,and lumen formation capacity of human umbilical vein endothelial ceils[J].Chin Med J(Engl),2012,125(12):2195 -2199.
12 Yun BR,Lee MJ,Kim JH,et al.Enhancement of parthenolide-induced apoptosis by a PKC-alpha inhibition through heme oxygenase-1 blockage in cholangiocarcinoma cells[J].Exp Mol Med,2010,42 (11):787-797.
13 韩琨景,乔艳荣,孙抒,等.小白菊内酯对人肝癌细胞HepG-2增殖、凋亡、迁移的影响及机制探讨[J].山东医药,2014,54(19):15-18.
14 Kim JH,Liu L,Lee SO,et al.Suseeptibility of cholangiocarcinoma cells to parthenolide-induced apoptosis[J].Cancer Res,2005,65 (14):6312-6320.
15 Park JH,Liu L,Kim IH,et al.Identification of the genes involved in enhanced fentinide-induced apoptosis by parthenolide in human hepatoma cells[J].Cancer Res,2005,65(7):2804-2814.
16 熊建文,肖化,张镇西.MTT法和CCK-8法检测细胞活性之测试条件比较[J].激光生物学报,2007,16(5):559-562.
17 顾万,赵新阁,张幸.芒柄花黄素通过调节Bax和Bcl-2蛋白表达诱导SKOV3细胞凋亡[J].四川生理科学杂志,2014,36(2):60-62.
18 Röthlin MA,Schöb O,Weber M.Laparoscopic gastro-and hepaticojejunostomy for palliation of pancreatic cancer:a case controlled study[J].Surg Endosc,1999,13(11):1065-1069.
19 Jimenez RE,Warshaw AL,Rattner DW,et al.Impact of laparoscopic staging in the treatment of pancreatic cancer[J].Arch Surg, 2000,135(4):409-415.
20 于冰,孙志君.凋亡相关基因Bcl-2、Bax、Bad与乳腺癌[J].中国普外基础与临床杂志,2003,14(6):739-742.
Study on the possible mechanism of parthenolide on apoptosis ofhuman prostate cancer cells PC-3
Ai Jun
(Department of Surgical Oncology,The First People Hospital of Qujing,Yunnan Qujing 655000)
Abstract Objective:To explore the underlying mechanism responsible for parthenolide-induced apoptosis on human prostate cancer cell PC-3 in vitro.Methods:Human prostate cancer cell PC-3 were cultured in virto.Different concentrations of parthenolide (0,10,20 and 40μmol·L-1)were added to PC-3 cell.The inhibitory effect of parthenolide on PC-3 cell was determined by CCK8 assay,while apoptosis was analyzed by flow cytometry.Next,the m RNA levels of bax and bcl-2 were tested by RT-PCR.Results: After parthenolide treatment,CCK8 test indicated parthenolide could inhibit the proliferation of PC-3 cell(P<0.05).The increased apoptotic rates by parthenolide was found in PC-3 cell by flow cytometry(P<0.05).The results from RT-PCR suggested that parthenolide treatment contributed to the reduced bcl-2 mRNA level and the elevated bax m RNA expression in PC-3 cell.Conclusions: Parthenolide could significantly inhibit the proliferation of human prostate cancer cell PC-3 by induction of apoptosis,which may be associated with activating bax m RNA expression and inhibiting bcl-2 m RNA expression.
(收稿日期:2015-10-29)
作者简介:艾俊,男,主治医师,主要从事肿瘤药理的研究,Email:ynqjha @163.com。

