ret和ednrb在先天性巨结肠症及巨结肠类源病肠壁表达的研究
张怡先张利兵闫焕钟麟(.成都市妇女儿童中心医院外一科,四川成都 60000; 2.四川大学华西附属第一医院小儿外科,四川成都 6004)
ret和ednrb在先天性巨结肠症及巨结肠类源病肠壁表达的研究
张怡先1张利兵1闫焕1钟麟2△
(1.成都市妇女儿童中心医院外一科,四川成都 610000; 2.四川大学华西附属第一医院小儿外科,四川成都 610041)
摘要目的:通过探讨ret、ednrb基因在先天性巨结肠症(Hirschsprung disease,HD)及巨结肠类缘病(Hirschsprung allied disease,HAD)患者肠壁的表达分布情况,旨在进一步了解HD与HAD发病机制的异同,为HD与HAD的诊断及治疗提供新的研究方向。同时通过常规HE染色与免疫组化标记时HD与HAD诊断的比较,深入了解免疫组化标记技术在HD和HAD诊断中的临床价值。方法:复习巨结肠术后病例HE切片,结合光镜下肠壁的形态特征,初步诊断分组。应用蛋白基因产物9.5(Protein gene product 9.5,PGP9.5)和神经元特异性烯醇化酶(Neuron specific enolase,NSE)免疫组化技术对经HE染色病理初步诊断为HD, HAD和不明确组的病变肠段再次诊断分组。HD肠段分别取狭窄段和扩张段与10例正常结肠行RET抗体、EDNRB抗体免疫组化染色,比较RET和EDNRB的染色结果和分布特点。结果:HE染色8例诊断不明确者,经免疫组化标记后诊断明确;RET在HD狭窄段中表达较HAD和正常对照组减少(P<0.05);EDNRB在HD狭窄段中表达较HAD和正常对照组减少(P<0.05);HD 和HAD扩张段与正常组的RET与EDNRB表达差异无统计学意义(P>0.05)。结论:免疫组化染色有助于HD和HAD的诊断; RET和EDNRB在HD狭窄段中表达有异常,提示RET和EDNRB与HD的发生可能有关。
关键词:先天性巨结肠症;巨结肠同源病;蛋白基因产物9.5;神经元特异性烯醇化酶;受体型酪氨酸激酶基因;内皮素B受体基因;免疫组化
1886年丹麦医生Harald Hirschsprung首先报告2例有便秘症状患儿,尸检见有巨结肠,故将该病称为先天性巨结肠症(Hirschsprung disease,HD)。1920年Valla指出该病的基本病理改变为扩大结肠远端痉挛肠管的肌间及粘膜下神经丛内缺乏神经节细胞。后来人们发现有的病例具有典型HD临床表现但肠壁神经节细胞存在,因而逐渐认识到可能存在其他各种不同的肠神经系统异常,于是提出巨结肠类缘病(Hirschsprung allied disease,HAD)的概念。HAD包括肠神经元性发育异常(Intestinal neuronal dysplasia,IND),神经节细胞减少症(Hypoganglionosis,HP),肠神经发育不良。HD和HAD统称为肠神经元异常(Intestinal dysganglionoses,IDs)。
HD为小儿常见疾病,其发病率约为1:5000,男女比例为3 -4:1。对HD的病因学研究已有近百年的历史,但至今尚未完全清楚。对于该病病因和发病机制的研究仍然是国内外学者关注的课题。受体型酪氨酸激酶(Receptor tyrosine kinases gene,ret)基因定位于染色体10q11.2区域[1],Ret基因编码的RET蛋白为114个残基跨膜蛋白,有一个富含半光氨酸激酶的细胞区。激活RET受体需要和它的配体结合形成复合体,胶质细胞源性神经营养因子(Glial cell line-derived neurotrophic factor,GDNF)和胶质细胞源性神经营养因子受体(GDNF family receptor alpha-1,GFRα1)结合形成的RET配体。ret基因和gefα1基因在肠神经系统要进入消化道时表达,而GDNF则当肠神经系统迁移至食管时在胃中表达[2]。ret、gdnf或gfrα1突变的小鼠,肠神经系统将不能定植于从食管开始的大部分消化道,这种肠神经元的缺失可能是由于神经细胞凋亡或移植的失败[2]。Schuchardt[3]等敲除斑马鱼和小鼠ret基因后,其肠道出现肠神经节细胞缺失。Shepherd[4]通过对ret基因突变的小鼠研究发现,ret纯合子突变的小鼠出生后很快死亡,解剖发现其全消化道神经节细胞缺失。实验证实gdnf基因杂合突变的小鼠大约有50%出现肠神经元的减少[5],推测是由于肠神经元增殖减少和肠神经元迁移推迟引起[6]。体内实验研究发现GDNF是一个启动肠神经系统的化学信号,推测GDNG可能启动RET和GFRα1表达,促使肠神经系统迁移到消化道中。综上所述,推测GDNF-RET-GFRα1信号通路对肠神经系统的存活、增殖和迁移有重要作用。研究发现另一个对肠神经系统的发育有重要影响的途径是血管内皮素途径(EDN3-EDNRB途径)。血管内皮素3(Endothelin gene3,edn 3)基因属于哺乳动物中已知血管内皮素(Endothelin gene,edn)基因家族中的成员。edn3基因编码238个氨基酸的前体物质,定位于人染色体20q13.2-13.3。EDN3对后肠神经细胞定植有重要作用,它的作用机制现在仍存在争论。其中一种主要的观点是EDN3通过抑制肠神经前体细胞的分化,促进肠神经前体细胞增殖来保持肠神经前体细胞库的数量。EDN3失活将使细胞增殖减少和前体细胞过早的分化,最后导致没有足够的祖细胞到后肠[7]。EDN3促进肠神经系统的增殖得到很多科研小组支持[8]。Nandor[9]敲除鸡的edn3基因也得到了后肠肠神经元缺失的模型。ednrb基因位于13q22,约24 kb,含7个外显子和6个内含子,其编码产物为具有442个氨基酸的蛋白质,该基因被认为是仅次于ret基因的HD重要易感基因[10],内皮素B受体基因(Endothelin B receptor gene,ednrb)属于G蛋白偶联受体,与配体结合被激活后,诱导钙离子内流入细胞,在胚胎发育期间,调节神经嵴细胞与肠间充质细胞的相互作用,使神经嵴细胞可以正常发育、分化和迁移。而且表达EDNRB的内皮细胞参与内皮素激活一氧化氮合酶的过程,EDNRB在脑、肾、肺和心脏的血管内皮细胞存在表现。最近发现其也存在结肠内,尤其是在肌间神经丛、粘膜下层及粘膜下的血管组织内。EDN3与EDNRB结合,组成EDN3-EDNRB内皮素信号传导通路[11]。同样为肠神经元异常的HAD的基因学研究目前还不是很多。本研究通过探讨ret、ednrb基因在HD及HAD患者肠壁的表达分布情况,旨在进一步了解HD与HAD发病机制的异同,为HD与HAD的诊断和防治提供新的研究方向。同时通过常规HE染色与免疫组化标记时HA及HAD诊断的比较深入了解免疫组化标记技术在HD和HAD疾病诊断中的临床价值。
1 材料与方法
1.1 病史资料的收集
调阅四川大学华西医院1997年1月~2010年1月原始病例,记录姓名,性别,年龄,临床表现及各种术前检查资料,手术记录,病理报告等。
1.1.1 一般资料
1997年1月~2007年1月术前诊断为HD而行巨结肠根治术病例230例,随机选取40例,复习HE切片,并进行初步分组,其中HD组16例,HAD组16例,不确定组8例。均取狭窄段、扩张段术后石蜡标本连续切片行NSE、PGP9.5、RET和EDNRB免疫组织化学染色。
1.1.2 材料
来源于四川大学华西医院1997年1月-2007年1月行巨结肠根治手术的术后石蜡标本40例为实验组,10例尸检(解剖未发现消化道畸形或病变)的结肠标本为对照组。
首先对术前诊断为巨结肠的术后HE染色切片重新读片。初步选取诊断HD明确组16例,HAD组16例,另再选取镜下形态学特征不典型不能确诊为HD或HAD的有8例,归为不确定组。同时,选取尸检(解剖未发现消化道畸形或病变)10例的结肠标本行免疫组织化学染色作为对照组。
1.2.1 免疫组化染色SP法
蒸馏水冲洗,PBS浸泡5 min。3% H2O2室温孵育5~10 min,以消除内源性过氧化物酶的活性,PBS冲洗,2 min ×3次。5~10%正常山羊血清封闭,室温孵育10 min。倾去血清,勿洗,滴加适当比例稀释的一抗,4℃过夜。PBS冲洗,2 min×3次。滴加适当比例稀释的生物素标记二抗(1%BSAPBS稀释),37℃孵育10~30 min,室温孵育10~20 min。PBS冲洗,2 min×3次。滴加适当比例稀释的辣根酶标记链霉卵白素(PBS稀释),37℃孵育10~30 min。PBS冲洗,2 min×3次。显色剂显色(DAB)。自来水充分冲洗,复染,脱水透明、封片。
1.2.2 结果判断及分析
光镜下观察肌间神经丛的IGCs发育情况,四种免疫组化染色以肠肌间神经丛和黏膜下神经丛出现棕黄色或棕褐色为阳性,根据染色结果,作HE、NSE、PGP9.5、RET和EDNRB五个指标的染色效果分析。RS Image成像系统照相,在RET和EDNRB切片中肠肌间神经丛,分别10×和40×随机存盘,每张切片在40×倍显微镜下随机取5个视野,记数分析指标:肌间神经丛RET和EDNRB蛋白免疫反应阳性细胞数和神经丛的数目,以个/丛为单位计数。
1.3 数据统计和分析
用SPSS13.0统计软件单因素方差分析对肠肌间神经丛表达RET和EDNRB的密度进行分析比较,检验水准α为0.05。
2 结果
2.1 常规HE染色与免疫组化标记对HD及HAD诊断的比较
分别对HD组和HAD组狭窄段肠管进行常规HE,结果先天性巨结肠肌间神经丛内未见神经节细胞,NID增生的神经丛和神经节细胞明显增多,且大多呈未成熟状态,神经节细胞减少症神经丛面积减小,丛内神经节细胞减少,神经节细胞大小基本正常见图1。

图1 正常对照组、HD组和HAD组狭窄段肠管HE染色(40×)A:先天性巨结肠;B:NID;C:神经节细胞减少症
正常对照组、HD组和HAD组免疫组化标记NSE的染色,结果正常对照组的正常肠壁可见神经丛内神经节细胞胞浆中表达为棕褐色,神经纤维表达为棕褐色细波纹,施旺细胞及周围细胞阴性HD组可见增生的肌间神经丛纤维表达为棕褐色,未见神经丛内有神经节细胞,NID增生的肠肌间神经丛成串珠养排列,可见神经纤维明显增生,神经节细胞增多,肠神经节细胞减少症可见神经丛面积减少,神经节细胞数量减少,大小正常见图2。
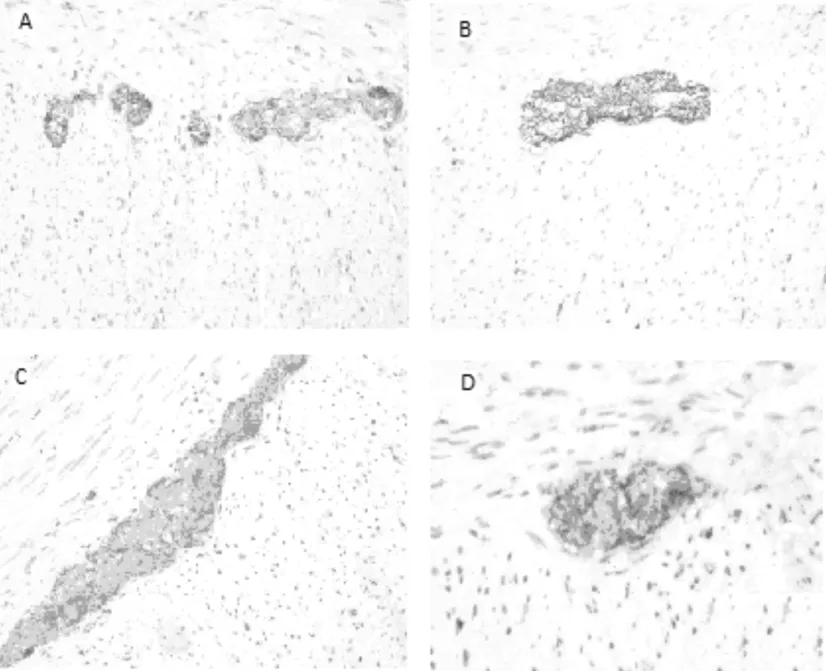
图2 正常对照组,HD组和HAD组狭窄段肠管NSE染色(40×)A:正常对照组;B:HD;C:NID;D:肠神经节细胞减少症
正常对照组、HD组和HAD组免疫组化标记PGP9.5的染色,正常对照组肠壁肌间神经丛中成熟的神经节细胞的胞浆和核中表达为棕黄色细颗粒,胞浆颗粒清晰,细胞核淡染、核仁明显,HD肌间神经丛见不到神经节细胞,NID肌间神经丛中未成熟的神经节细胞表达为胞浆胞核皆浓染、结构不清、无明显核仁,肠神经节细胞减少症神经丛面积明显减少,可见神经节细胞大小明显改变见图3。

图3 正常对照组,HD组和HAD组狭窄段肠管PGP9.5染色(40×)A:正常对照组;B:HD;C:NID;D:肠神经节细胞减少症
重复复习HE切片时诊断HD和HAD各16例,有8例切片HD和HAD的特征不很典型,归为不明确组。经PGP9.5 和NSE染色发现HD为21例,HAD为19例,其中IND16例, HP3例见表1。
2.2 正常对照组、HD组和HAD组的RET各段免疫组化标记分布特点
每张切片在20×10倍显微镜下随机取5个视野,光镜下记数,分析指标:肌间神经丛RET蛋白免疫反应阳性细胞数和神经丛的数目,以个/丛为单位计数,每张切片数3次,取平均数,用SPSS13.0软件对所得数据进行方差分析。
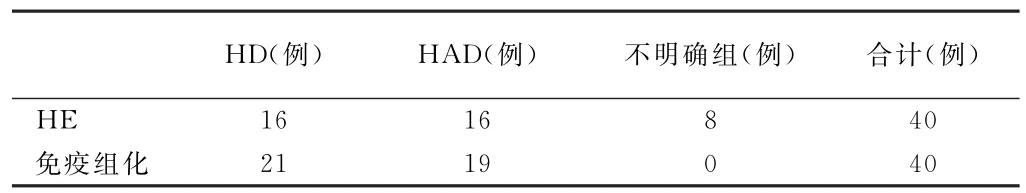
表1 40例常规HE染色与免疫组化标记诊断HD和HAD的结果
2.2.1 正常对照组、HD组和HAD组狭窄段RET免疫组化标记分布特点
分别对正常对照组、HD组和HAD组狭窄段肠管进行RET标记的免疫组化染色,了解其分布特点,结果正常对照组肠组织肌间神经丛明显,成团状,丛中间纵横连接成网络状的神经纤维,淡黄,RET阳性神经节细胞分散于其中。HD肠组织肌间神经节和神经丛,无RET阳性的神经节细胞,仅见到增粗的网状神经纤维成淡黄色。IND肠组织间神经丛增生,神经节细胞减少。肠神经节细胞减少症的肌间神经丛明显减少,可见RET阳性神经节细胞分散于其中见图4。并进行了各组狭窄段神经丛细胞RET表达密度的比较,RET在HD狭窄段中表达较HAD和正常对照组减少(P<0.05)见图5。

图4 正常对照组、HD组和HAD组狭窄段RET免疫组化染色(40×)A:正常对照组;B:HD;C:NID;D:肠神经节细胞减少症

图5 各组狭窄段神经丛细胞RET表达密度比较注:与正常组相比,*P<0.05
2.2.2 正常对照组、HD组和HAD组的RET扩张段免疫组化标记分布特点
对HD、HAD和正常组进行扩张段神经丛细胞RET表达密度的比较,HD和HAD扩张段与正常组的RET表达差异无统计学意义(P>0.05)见图6。
2.2.3 正常对照组、HD组和HAD组的狭窄段的EDNRB免疫组化标记分布特点
分别对对照组、HD组和HAD组狭窄段肠管进行EDNRB标记的免疫组化染色,了解其分布特点,结果正常对照组与HD 和HAD各组切片上RET与EDNRB免疫组化染色的描述,正常对照组EDNRB阳性神经节细胞分散。HD组EDNRB阳性的细胞数量较少,IND肠组织肌间巨大神经节图中间神经丛增生,神经节细胞减少。肠神经节细胞减少症的神经丛面积减小,EDNRB阳性神经节细胞分散于其中见图7。并进行了各组狭窄段神经丛细胞EDNRB表达密度的比较,EDNRB在HD狭窄段中表达较HAD和正常对照组减少(P<0.05)见图8。
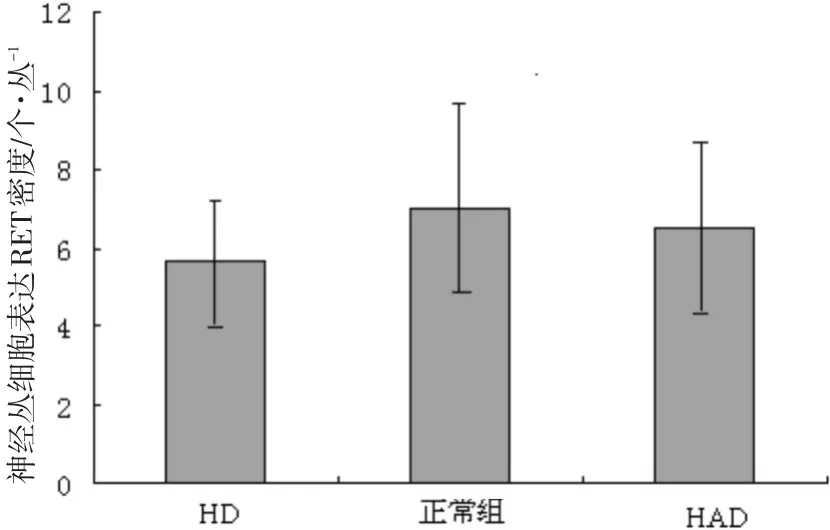
图6 各组扩张段神经丛细胞RET表达密度比较

图7 正常对照组、HD组和HAD组狭窄段EDNRB免疫组化染色(40×)A:正常对照组;B:HD;C:NID;D:肠神经节细胞减少症
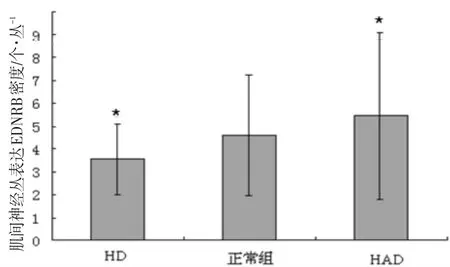
图8 各组狭窄段神经丛细胞EDNRB表达密度注:与正常组相比,*P<0.05
2.4 正常对照组、HD组和HAD组的扩张段的EDNRB免疫组化标记分布特点
对HD、HAD和正常对照组进行扩张段神经丛细胞RET表达密度的比较,HD和HAD扩张段与正常组的EDNRB表达差异无统计学意(P>0.05)见图9。
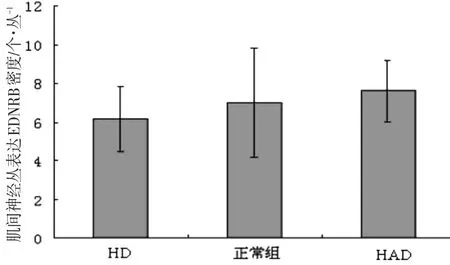
图9 各组扩张段神经丛细胞EDNRB表达密度
用SPSS13.0对结果进行单因素方差分析,HD与HAD和正常组狭窄段的RET和EDNRB表达都有统计学意义(P< 0.05),相反,HD与HAD和正常对照组扩张段的RET和EDNRB表达差异无统计学意(P>0.05)。
3 讨论
对于深入探讨HD的发病机制产生了重要影响。从Valla的发现后,人们又发现有患者具有的典型HD临床表现但肠壁间神经节细胞存在,因而逐渐认识到可有存在其他各种不同肠神经系统异常,于是提出了HAD的概念。一般认为,HD确诊关键是观察狭窄段(即病变结肠)神经节细胞的有无。HAD在诊断分类上则一直存在争论。国内现主要将HAD分类为IND、HP、肠神经发育不良。HAD和HD统称为IDs。
3.1 HD和HAD的诊断
HD诊断的金标准为病理诊断。现在国内多采取的是单纯的HE染色诊断,这样的诊断方法虽对于有经验的病理医师诊断典型的HD是可行的,但也存在一定的局限性。HE染色神经节细胞的形态与胶质细胞、雪旺细胞不易鉴别,加上炎症细胞的影响,使神经节细胞不易明确观察到[13],在一些不太典型的情况下就需进行免疫组化染色以协助诊断。本实验从现在常用的免疫组化方法中选取了PGP9.5和NSE协助诊断。PGP9.5是一种对粘膜肌层和固有层中异常胆碱能神经染色的神经元标志物,存在于中枢和外周神经系统的各个水平及神经内分泌细胞中,表现为黄褐色团块状的神经丛中散在分布深褐色神经节细胞,在神经胶质中细胞不表达。虽然PGP9.5的表达特异性好,但PGP9.5在肠神经节细胞(intestinal ganglion cell,IGCs)的表达有所不同。PGP9.5在IGCs的胞浆和胞核表达为棕黄色细颗粒,成熟的节细胞中胞浆颗粒清晰,细胞核淡染,核仁明显。未成熟的节细胞胞浆、胞核皆深染,结构不清,无明显核仁。神经丛内其他细胞和丛周围细胞阴性。NSE是一种糖酵解酶,在神经母细胞分化为成熟的神经细胞后,NSE也由非神经元特异性烯醇化酶转变而来。因此可作为神经元发育成熟的标志物,用标记的抗NSE抗体与标本中NSE结合,可显示肠神经组织。有学者的研究表明,作为神经节细胞的标志物,NSE免疫组织化学技术能使神经组织清晰可见,即使新生儿粘膜下层发育不够成熟的神经节细胞也容易辨认。神经组织的特异性着色,能够避免出现HE染色时与炎性细胞、巨噬细胞、淋巴滤泡相混淆的问题,提高诊断HD的准确率。NSE在节细胞胞浆中表达为棕褐色,神经纤维表达为棕褐色细波纹,施旺细胞及周围细胞中表达为阴性[14]。
本研究先用HE染色对巨结肠术后病例进行诊断,发现在肠肌间神经丛中有一些未成熟的肠肌间神经节细胞与胶质细胞不能很好区分,造成有8例患者诊断困难。在行PGP9.5和NSE后,能判断出肠肌间神经节细胞与胶质细胞,故能明确诊断。所以,在HD和HAD的诊断中,应适当的增加免疫组化染色。而PGP9.5和NSE的免疫组化技术是一种可靠的方法,在各种肠神经系统发育异常疾病的形态学研究和临床诊断中有重要的临床意义。
3.2 RET在HD和HAD的肠壁表达情况
ret基因定位于染色体10q11.2区域[1],ret基因编码的RET蛋白为114个残基跨膜蛋白,有一个富含半光氨酸激酶的细胞区。激活RET受体需要和它的配体结合形成复合体,而RET配体是由GDNF和GFRα1结合形成的。ret基因和gfrα1基因在肠神经系统要进入消化道时表达,而gdnf则当肠神经系统迁移至食管时在胃中表达[2]。ret、gdnf或gfrα1突变的小鼠,肠神经系统将不能存在于从食管开始的大部分消化道,这种肠神经元的缺失可能是由于神经细胞凋亡或移植的失败[3]。Schuchardt[4]等敲除斑马鱼和小鼠ret基因后,发现其肠道出现肠神经节细胞缺失。Shepherd[5]通过对ret基因突变的小鼠研究发现,ret纯合子突变的小鼠出生后很快死亡,解剖发现其全消化道神经节细胞缺失。实验证实gdnf基因杂合突变的小鼠大约有50%出现肠神经元的减少[6],推测可能由于肠神经元增殖减少和肠神经元迁移推迟引起[7]。体内实验研究发现GDNF是一个启动肠神经系统的化学信号,推测GDNF可能启动RET和GFRα1表达,促使肠神经系统迁移到消化道中。综上所述,推测GDNF-RET-GFRα1信号通路对肠神经系统的存活、增殖和迁移有重要作用。
本研究观察RET在HD和HAD患者肠壁表达分布情况,并与正常结肠对照,发现RET在部分HD患者的狭窄段的肠肌间神经节细胞表达异常,而在HD的扩张段及HAD的各段的RET表达差异无明显统计学意义。可以初步推测ret基因对肠神经系统的表达有影响,可能引起肠神经节细胞的缺失。而ret基因可能对于HAD的肠神经变化影响不是很明显。
3.3 EDNRB在HD和HAD的肠壁表达情况
研究证实另一个对肠神经系统的发育有重要影响的途径是血管内皮素途径(EDN3-EDNRB途径)。edn3基因属于哺乳动物中已知edn基因家族中的成员。edn3基因编码238个氨基酸的前体物质,定位于人染色体20q13.2-13.3。EDN3对后肠神经细胞定植有重要作用,它的作用机制现在仍存在争论。其中一种主要的观点是EDN3通过抑制肠神经前体细胞的分化,促进肠神经前体细胞增殖来保持肠神经前体细胞库的数量。EDN3失活将使细胞增殖减少和前体细胞过早的分化,最后导致没有足够的祖细胞到后肠[8]。EDN3促进肠神经系统的增殖得到很多科研小组支持[9]。Nandor[10]敲除鸡edn3基因也得到了后肠肠神经元缺失的模型。ednrb基因位于13q22,约24 kb,含7个外显子和6个内含子,其编码产物为具有442个氨基酸的蛋白质,该基因被认为是仅次于ret基因的HD重要易感基因[11],EDNRB属于G蛋白偶联受体,与配体结合被激活后,诱导钙离子内流入细胞,在胚胎发育期间,调节神经嵴细胞与肠间充质细胞的相互作用,使神经嵴细胞可以正常发育、分化和迁移。而且表达EDNRB的内皮细胞参与内皮素激活一氧化氮合酶的过程,EDNRB在脑、肾、肺和心脏的血管内皮细胞表达。最近发现其也存在结肠内,尤其是在肌间神经丛、粘膜下层及粘膜下的血管组织内。EDN3 与EDNRB结合,组成EDN3-EDNRB内皮素信号传导通路[12]。
本研究观察EDNRB在HD和HAD患者肠壁表达分布情况,与正常结肠对照,发现EDNRB在部分HD患者的狭窄段的肠肌间神经节细胞表达异常,而在HD的扩张段及HAD的各段的EDNRB表达差异无明显统计学意义。可以初步推测ednrb基因对肠神经系统的表达有影响,可能引起肠神经节细胞的缺失。而ednrb基因可能对于HAD的肠神经变化影响不是很明显。
综上所述,RET和EDNRB在HD狭窄段中表达有异常,是狭窄段中神经节细胞缺失的一个因素,推测RET和EDNRB 与HD的发生有一定关系。RET和EDNRB在HAD的肠壁表达未见明显异常,提示与HAD的发病关系不是很密切。HD 和HAD虽同为肠神经系统异常,但RET和EDNRB的表达却不相同,提示其在发病机制上也可能存在各自的特点。目前还发现了不少HD的易感基因,也许可以在这些易感基因中找到与HAD发生相关的基因。RET和EDNRB在HD和HAD患者肠壁表达上的差异,也许可以作为它们诊断新的方向。
参考文献
1 Lyonnet S,Bolino A,Pelet A,et al.A gene for hirschsprung disease maps to the proximal long arm of chromosome 10[J].Nat Genet,1993,4(4):346-350.
2 Taraviras S,Marcos-Gutierrez CV,Durbec P,et al.Signaling by the RET receptor tyrosine kinase and its role in the development of the mammalian enteric nervous system[J].Development,1999,126 (12):2785-2797.
3 Schuchardt A,D'Agati V,Larsson-Blomberg L.Defects in the kidney andenteric nervous system of mice lacking the tyrosine kinase receptor RET[J].Nature,1994,367(6461):380-383.
4 Shepherd IT,Pietsch J,Elworthy S.Roles for GFRα1 receptors in zebrafish enteric nervous system development[J].Development, 2004,131(1):241-249.
5 Shen L,Pichel JG,Mayeli T,et al.Gdnf haploinsufficiency causes Hirschsprung-like intestinal obstruction and early-onset lethality in mice[J].Am J Hum Genet,2002,70(2):435-447.
6 Gianino S,Grider JR,Cresswell J,et al.GDNF availability determines enteric neuron number by controlling precursor proliferation [J].Development,2003,130(10):2187-2198.
7 Gershon MD.Endothelin and the development of the enteric nervous system[J].Clin Exp Pharmacol Physiol,1999,26(12):985-988.
8 Stone JG,Spirling LI,Richardson MK.The neural crest population responding to endothelin-3 in vitro includes multipotent cells[J].J Cell Sci,1997,110(14):1673-1682.
9 Nagy N,Goldstein AM.Endothelin-3 regulates neural crest cell proliferation and differentiation in the hindgut enteric nervous system [J].Dev Biol,2006,293(1):203-217.
10 周妙妮,李继承,丁世萍.中国人散发性先天性巨结肠症内皮素受体B基因的研究[J].中华小儿外科杂志,2005,26(7):350-353.
11 熊晓峰,钟麟.先天性巨结肠症致病基因的研究进展[J].临床小儿外科杂志,2003,2(3):204-206.
13 杨小进,林传友,胡道松,等.外周蛋白和组织蛋白酶D在先天性巨结肠症中的表达[J].中华小儿外科杂志,2004,25(3):261-263.
14 张燕敏,王忠荣.免疫组化方法在诊断肠神经异常性疾病中的应用进展[J].临床小儿外科杂志,2007,6(1):54-56.
Expression of ret and ednrb in intestinal wall of Hirschsprung's disease and Hirschsprung's allied disease patients
Zhang Yi-xian1,Zhang Li-bing1,Yan Huan1,Zhong Lin2△
(1.Surgical Department,Chengdu Women and Children’s Central Hospital,Sichuan Chengdu 610000; 2.Pediatric Surgical Department,West China Hospital,Sichuan University,Sichuan Chengdu 610041)
Abstract Objective:Through comparing the expression of ret and ednrb gene in the intestinal wall of patients with Hirschsprung’s disease and Hirschsprung’s allied disease,to investigate the differences between HD and HAD’s pathogenesy and indicate the potential direction of HD and HAD’s diagnosis and treatment.Meanwhile,to collect further information of the value of the immunohistochemistry in diagnosis of HD and HAD.Methods:Reviewed the HE slides of the patients who suffered the resection of megacolon under the inverted light microscope,diagnosed primarily and divided into groups by character of intestine wall.The PGP9.5 and NSE immunohistochemistry assays were used to diagnose the cases secondly.The expression of ret and ednrbin gene in each group was detected by the immunohistochemistry assay.Results:Eight cases which were indeterminately diagnosed by HE,definitively diagnosed by immunohistochemistry.Ret was low expressed in HD stegnosis,compared with HAD and control groups (P<0.05).Ednrbwas low expressed in HD stegnosis,compared with HAD and Control groups(P<0.05).No expression difference of ret and ednrbin gene between HD and HAD extensive intestine and normal intestine.Conclusion:The immunohistochemistry assay could assist the diagnosis of HD and HAD.The abnormal expression ret and ednrbin gene in HD stegnosis,indicated those two genes may have the potential relationship with occurrence of HD.
Key Words:Hirschsprung’s disease;Hirschsprung’s allied disease;PGP9.5;NSE;RET;EDNRB;Immunohistochemistry
(收稿日期:2015-10-12)
通讯作者:△钟麟,男,主任医师,主要从事小儿外科临床诊治工作, Email:zhonglin123@163.com。
作者简介:张怡先,女,住院医师,主要从事小儿外科临床诊治工作, Email:hxxianxian@163.com。

