火鸡疱疹病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立及应用
刘杉杉,孙 伟,闫敏鑫,黄秀芬,姜 良,何 诚,李永清*
(1.北京市农林科学院畜牧兽医研究所,畜禽疾病防控技术北京市重点实验室,北京 100097;2.中国农业大学动物医学院,北京 100193)
火鸡疱疹病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立及应用
刘杉杉1,2,孙 伟1,闫敏鑫1,黄秀芬1,姜 良1,何 诚2,李永清1*
(1.北京市农林科学院畜牧兽医研究所,畜禽疾病防控技术北京市重点实验室,北京 100097;2.中国农业大学动物医学院,北京 100193)
针对火鸡疱疹病毒(HVT)特异性的sorf1区基因序列设计引物,建立检测HVT的SYBR Green Ⅰ实时荧光定量PCR方法,并对其特异性、敏感性和重复性进行检测。结果表明,建立的实时荧光定量 PCR方法标准曲线的循环阈值(Ct)与模板拷贝数呈良好线性关系(r2=0.99),熔解曲线分析显示该PCR扩增具有良好的特异性、敏感性和重复性,试验表明该方法最低检测浓度为7×101拷贝/μL。利用该方法对野生型HVT和rHVT-pmpD-N在体内和体外的复制特性进行检测,结果表明重组后的HVT与野生型HVT的增殖速度基本一致。本试验建立的检测方法能够快速检测HVT,准确率高,特异性好,具有较高的灵敏度和稳定性,为监测HVT体内和体外的病毒含量和复制情况提供了一种有效的手段。
火鸡疱疹病毒;SYBR Green Ⅰ;实时荧光定量PCR;sorf1
马立克病(Marek' disease, MD)是一种由马立克病病毒(Marek' disease virus, MDV)引起的鸡淋巴组织增生性传染病[1]。根据血清学特性将MDV分为3个血清型,Ⅰ型为具有致瘤性的MDV,Ⅱ型为天然无致瘤MDV,Ⅲ型为火鸡疱疹病毒(Herpesvirus of turkey, HVT)。鸡是MDV最重要的天然宿主,商品化鸡群感染以T细胞淋巴瘤和严重的免疫抑制为特点。20世纪70年代,从家养火鸡中分离到一种自然发生的非致病性的MDV毒株即HVT,并用作疫苗来预防MDV感染,取得了良好效果。此后,HVT疫苗及以HVT为载体的多价疫苗得了到广泛使用和研究[2-7]。这些疫苗在一定程度上可以有效地控制MD的流行,阻止临床症状的发展,抑制肿瘤的形成,并可以减少淋巴器官中病毒粒子的数量,但不能抑制MDV的感染及其在鸡体内的复制[8]。
HVT能够导致鸡胚成纤维细胞(chicken embryo fibroblast,CEF)发生病变,体外通常采用蚀斑技术对HVT疫苗免疫效力和增殖情况进行检测[9],但该方法准确性低,重复性差,易受许多因素的影响,如鸡胚、外界病原、pH、琼脂覆盖量和病毒稀释液等,而且试验操作繁琐、周期性长,很难应用于大量样品的检测。HVT的体内定量检测主要是通过实时荧光定量PCR检测方法[10],Susan等建立的探针法荧光定量PCR方法省时省力,可以实现快速检测的目的,但是探针的合成比较昂贵,设计难度大。
HVT基因组为双链DNA,基因组结构与其他α疱疹病毒类似,由一个长独特区(UL)及其两侧的末端长重复序列(TRL)/内部重复序列(IRL),和一个短独特区(US)及其两测的末端短重复序列(TRS)/内部短重复序列(IRS)所组成。HVT与MDV-1都包含有76个基因同源物,大部分位于UL和US区,其中sorf1基因为HVT所特有,可用于对HVT进行检测。
目前,尚缺乏一种快速、简捷检测HVT疫苗中活病毒的含量,并可准确定量其增殖情况的方法[11]。本试验通过构建HVT的重组质粒标准品,利用SYBR Green Ⅰ特异性结合到DNA分子上的特性,建立一种实时荧光定量 PCR检测方法,为检测体内外HVT的病毒含量和增殖提供有效手段。
1 材料与方法
1.1 材料
1.1.1 病毒 HVT-BAC细胞毒,即将HVT的完整基因组构建在BAC载体上,由英国动物健康研究所Venugopal Nair教授赠送;rHVT-pmpD-N细胞毒,是将鹦鹉热衣原体CB7的pmpD-N基因插入HVT-BAC中获得的重组毒,由本实验室构建。
1.1.2 主要试剂 pMD○R18-T Simple载体为TaKaRa公司产品;ExTaqDNA聚合酶为宝生物工程(大连)有限公司产品;DNA提取试剂盒、质粒小量抽提试剂盒、胶回收试剂盒为Qiagen公司产品;iTaqTMUniversal SYBR○RGreen Supermix试剂盒为Bio-Rad公司产品。
1.1.3 主要仪器和设备 PCR仪(MT Mini)、数码凝胶图像处理仪为Bio-Rad公司产品;超纯水系统(Milli-Q Integral)为Millipore公司产品;微量紫外分光光度计(Nanodrop 2000)为Gene公司产品;Bio-Rad iQ 5荧光定量PCR仪为Bio-Rad公司产品。
1.2 方法
1.2.1 荧光定量PCR引物的设计 根据GenBank登录的HVT FC126毒株(AF282130)的sorf1区序列,应用Primer 5.0和DNAStar设计引物。引物如下:sorf1 F(上游引物):5′-AGTCTCGAGCGTGGACAGAT-3′;sorf1 R(下游引物):5′-CCAAACGTCCGTAGACGAAT-3′。预期扩增片段为175 bp。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 标准品的制备及鉴定 从HVT-BAC细胞毒中提取DNA,具体操作过程参照Qiagen公司DNA提取试剂盒步骤进行。以提取的HVT-BAC基因组DNA为模板进行PCR扩增,反应体系为25 μL:ddH2O 15 μL,10×ExTaqbuffer 2.5 μL,dNTP 3 μL,上游引物(10 μmol/L)1 μL,下游引物 (10 μmol/L)1 μL,DNA模板2 μL,ExTaqDNA polymerase 0.5 μL。反应条件为:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 10 s,进行30个循环;72 ℃ 7 min,4 ℃结束反应。
扩增结束后,取5 μL扩增产物与1 μL 6×DNA Loading buffer混合,加入20 g/L琼脂糖凝胶孔中,同时加入DNA Ladder 2000作为Marker,紫外分析仪进行观察。
将扩增出的PCR产物进行胶回收后与pMD○R18-T Simple载体进行连接,转化TOP10感受态细胞。PCR鉴定为阳性的单菌落送上海生工生物工程技术服务有限公司测序,并采用DNA Star软件将测序结果与目的序列进行比对。
将测序正确的菌液,小量提取质粒。将提取后的含有sorf1基因的重组质粒命名为p-sorf1。紫外分光光度计Nanodrop 2000测定质粒的浓度和纯度,并参考以下公式计算基因的拷贝数:单位体积质粒拷贝数(拷贝/μL)=6.02×1023(ng/μL×10-9)/碱基数×660。将已经计算好拷贝数的阳性质粒p-sorf1做梯度稀释,即浓度分别为:7×107、7×106、7×105、7×104、7×103、7×102、7×101拷贝/μL,作为标准品。
1.2.3 优化反应体系 在同一浓度模板的反应体系中,采用正交试验法分别对引物浓度和退火温度进行优化。
1.2.4 制作标准曲线 以上述10倍梯度稀释的重组质粒标准品作为模板,利用优化的反应条件,进行real-time PCR扩增,并进行标准曲线的绘制。
1.2.5 敏感性试验 将重组质粒10倍梯度稀释,分别以7×107、7×106、7×105、7×104、7×103、7×102、7×101、7×100拷贝/μL为模板,利用优化的反应条件进行荧光定量,以检测结果阳性的最高稀释度的质粒浓度作为检测下限。
1.2.6 重复性试验 将重组质粒分别做3次稀释,选取7×107、7×106、7×105、7×104、7×103、7×102、7×101拷贝/μL重组质粒作为模板,进行重复性试验,并对各个浓度标准品的阈值(Ct值)进行统计学分析。
1.2.7 试验样本检测 将构建好的rHVT-pmpD-N和野生型HVT以400 PFU同时分别接种CEF细胞,收集感染后12、24、48、72、96、120 h的细胞。提取DNA,并进行含量测定。测定后将含量统一稀释到1 ng/μL,对不同时间段的病毒含量进行检测。同时将收集的不同时间的细胞进行蚀斑检测。
将35只1日龄SPF鸡随机分成3组,对照组10只,以1.3×105/只剂量背部皮下接种CEF细胞。试验组一10只,相同部位按照剂量为8 000 PFU/只接种野生型HVT。试验组二15只,同一部位以8 000 PFU/只剂量接种rHVT-pmpD-N。所有鸡只,每周采用肝素钠抗凝采血,每只鸡1 mL,共采集5次,分别进行淋巴细胞的分离。试剂盒提取DNA后,经含量测定后,均稀释到到15 ng/μL,利用建立的方法对不同时间段的病毒含量进行检测。
为了证实该方法的特异性,本试验采用Qiagen公司DNA提取试剂盒,从MDV CVI988/Rispens病毒株及其细菌人工染色体感染的细胞中提取DNA,利用此方法对提取的DNA进行检测。
2 结果
2.1 标准品的制备及鉴定
普通PCR反应体系扩增后,经20 g/L的琼脂糖凝胶电泳检测发现,可扩增出约175 bp的特异性条带,与目的片段大小一致(图1)。
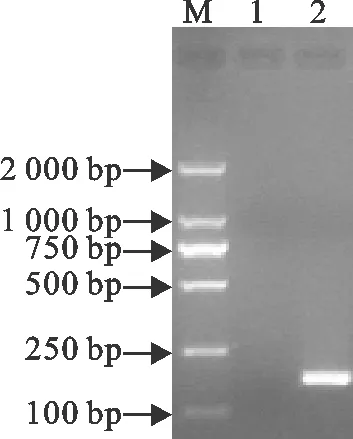
M. DNA标准DL 2 000; 1.阴性对照; 2. sorf1基因的PCR产物
M. DNA Maker DL 2 000; 1. Negative control; 2. PCR product of gene sorf1
图1 sorf1基因PCR产物电泳图
Fig.1 Electrophoresis of PCR product of sorf1 gene
扩增产物经胶回收后,克隆于pMD○R18-T Simple载体中,得到的重组质粒送上海生工生物工程技术服务有限公司测序,结果表明与GenBank上HVT FC126毒株(AF282130)的sorf1区序列的基因片段序列同源性为100%,表明成功获得目的基因片段。
提取的质粒DNA经紫外分光光度计测定后,浓度为245.3 ng/μL,OD260 nm/OD280 nm比值为1.89,符合纯度要求。经计算该阳性重组质粒的拷贝数为7.8×1010拷贝/μL。
2.2 反应体系的优化结果
根据动力学曲线和扩增效率判定优化的结果,最终确定反应体系为20 μL,即iTaqTMUniversal SYBR○RGreen Supermix 10 μL,上游引物(3 μmol/L)1 μL,下游引物(3 μmol/L)1 μL,质粒p-sorf1 5 μL,ddH2O 3 μL。最佳反应条件为:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 30 s,40个循环;4 ℃结束反应。
2.3 Real-time PCR标准品的制备及标准曲线的建立
将p-sorf1重组质粒做梯度稀释制备标准品,稀释浓度分别为7×107、7×106、7×105、7×104、7×103、7×102、7×101、7×100拷贝/μL,以各个浓度的质粒作为模板,进行real-time PCR扩增,并绘制标准曲线。试验结果显示,可以获得较为理想的标准曲线(图2);熔解曲线表明产物的Tm值非常均一(图3),说明扩增的效率一致;Ct值和标准阳性模板拷贝数的对数间有良好的线性关系(R2为0.99)(图4),且扩增效率理想(经计算扩增效率为81.7%)(图4),表明标准曲线能够准确反映目的产物的扩增。
2.4 敏感性及特异性分析
将重组质粒10倍梯度稀释,分别以7×107、7×106、7×105、7×104、7×103、7×102、7×101、7×100拷贝/μL为模板,利用优化的反应条件进行荧光定量,检测结果阳性的最高稀释度的质粒浓度为7×101拷贝/μL(图2),而标准PCR的检测敏感性为7×102拷贝/μL,real-time PCR比常规PCR的敏感性提高10倍。利用此方法对MDV CVI988/Rispens 株的病毒DNA 及其细菌人工染色体进行了检测,结果均为阴性,说明该方法可以用于对HVT和CVI988病毒鉴别。
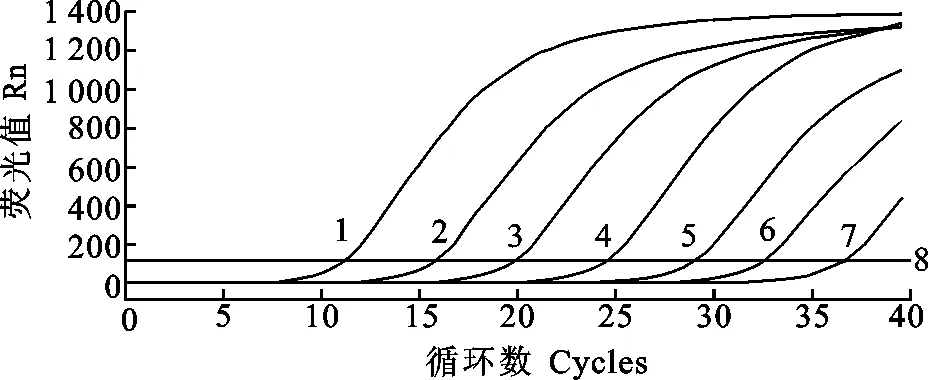
1.7×107拷贝/μL;2.7×106拷贝/μL;3.7×105拷贝/μL;4.7×104拷贝/μL;5.7×103拷贝/μL;6.7×102拷贝 /μL;7.7×101拷贝/μL;8.阴性对照
1.7×107copies/μL;2.7×106copies/μL;3.7×105copies /μL;4.7×104copies/μL;5.7×103copies/μL;6.7×102copies/μL;7.7×101copies/μL;8.Negative control
图2 p-sorf1重组质粒real-time PCR扩增曲线
Fig.2 Amplification curve of SYBR Green Ⅰ real-time PCR for detection of p-sorf1
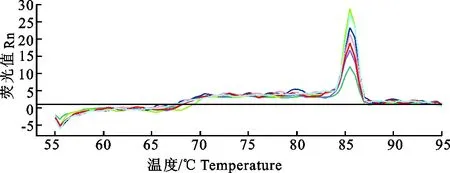
图3 p-sorf1重组质粒real-time PCR熔解曲线导数图Fig.3 Melt curve derivative plot of SYBR Green Ⅰ real-time PCR for detection of p-sorf1
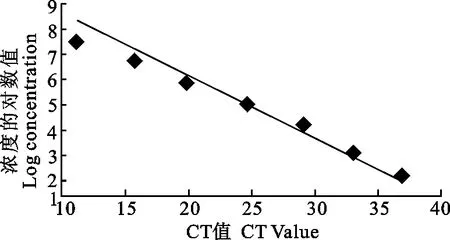
图4 p-sorf1的标准曲线Fig.4 Real-time PCR standard curve of p-sorf1
2.5 重复性分析
将重组质粒分别做3次稀释,选取7×107、7×106、7×105、7×104、7×103、7×102、7×101拷贝/μL重组质粒作为模板,结果见表1。由表1可知,Ct值的变异系数为0.16%~1.44%,说明无论质粒浓度高低,都能获得较好的重复性。
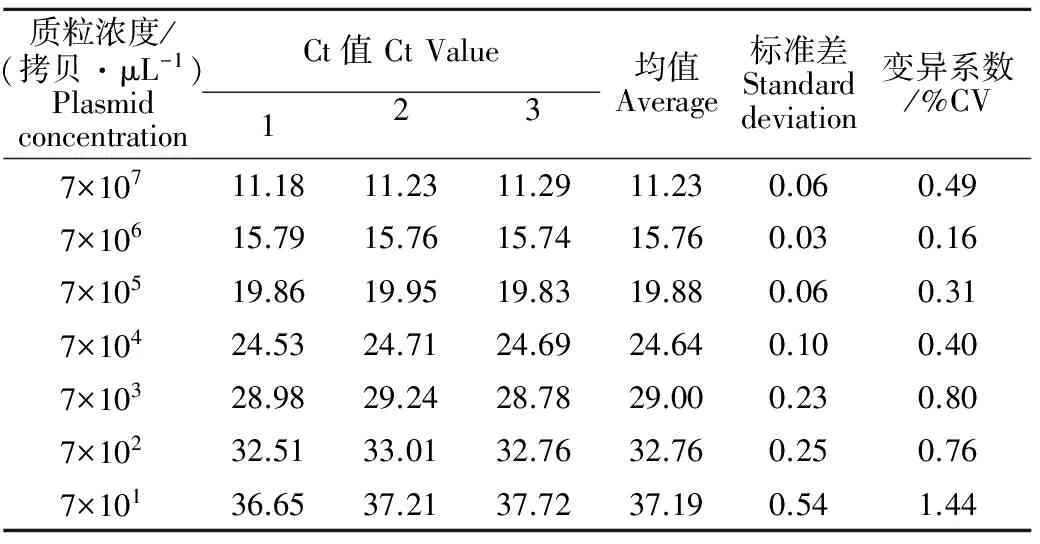
表1 p-sorf1重组质粒real-time PCR重复性试验数据分析Table 1 The Ct analysis of reproducibility for p-sorf1 real-time PCR
2.6 试验样品的分析
将rHVT-CMV-pmpD和野生型HVT以400 PFU同时分别接种CEF细胞,收集感染后12、24、48、72、96、120 h的细胞,并提取细胞DNA,采用本试验建立的方法对不同时间段的病毒含量进行检测。图5A结果显示,rHVT-CMV-pmpD和野生型HVT的增殖速度相近,感染48 h后时病毒含量出现明显升高,感染后72 h~96 h为对数增长期,直到感染后120 h都在一直升高。同时,采用蚀斑法进行检测,图5B结果表明,rHVT-CMV-pmpD和野生型HVT的增殖速度相近,48 h时开始有明显升高,经过72 h~96 h的对数增长期后,开始出现下降。
以1日龄SPF鸡为动物模型,分别接种CEF细胞、rHVT-CMV-pmpD和野生型HVT后不同时间测定HVT的含量。图6检测结果表明,接种后3周才能检测到HVT,直到第5周一直缓慢上升,但是二者各个时间段的病毒拷贝数没有显著性差异。
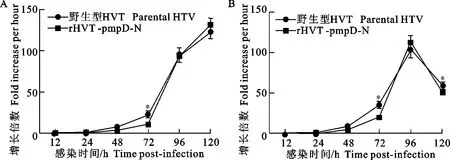
A.采用定量方法; B.采用蚀斑方法(*表示差异显著)
A. Assay by real-time PCR; B. Assay by plaque (* Mean significant difference)
图5 rHVT-pmpD-N和野生型HVT的体外一步生长曲线
Fig.5 One-step growth curves of rHVT-pmpD-N and parental HVTinvitro
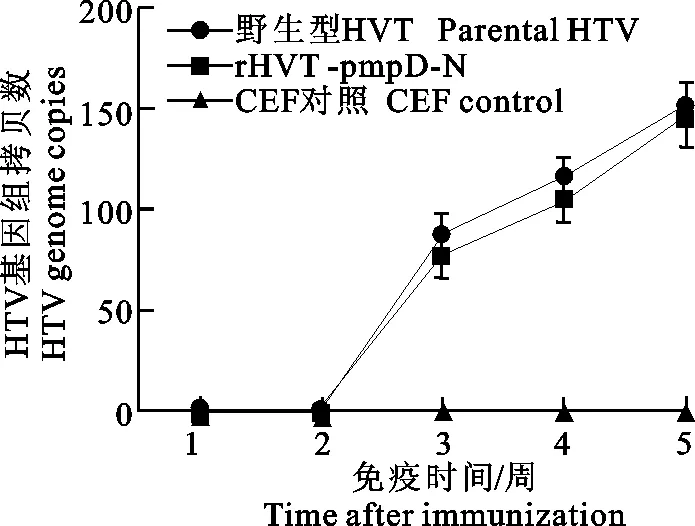
图6 rHVT-pmpD-N和野生型HVT的体内一步生长曲线Fig.6 One-step growth curves of rHVT-pmpD-N and parental HVT in vivo
3 讨论
Real-time PCR是在PCR扩增过程中,通过引入荧光信号对PCR反应进程进行实时检测,已经用于多种病毒的检测,均取得了良好的效果[12-13]。根据real-time PCR化学发光原理可分为两大类,一类为探针类,如TaqMan探针,其原理为通过与靶序列特异性杂交的探针指示扩增产物的增加;另一类为非探针类,如SYBR Green Ⅰ,其原理为利用荧光染料来指示产物的增加。核酸探针特异性好,但是合成成本高、设计难度大,非核酸探针的染料对DNA的识别不具有特异性,非特异性产物如引物二聚体也可与之结合,从而影响定量的准确性,但是可通过优化反应体系和引物设计的改变减少引物二聚体的出现。
HVT基因组为双链DNA,G+C含量为47.5%。共包含有75个ORF,其中67个ORF 存在于包括MDV-1和MDV-2在内的所有的α疱疹病毒中。sorf1基因为HVT所特有的,与编码调节细胞凋亡的Bcl家族中NR-13基因类似。因此,本试验采用sorf1区基因序列进行引物设计,进行特异性扩增,只能获得HVT目的基因,而非MDV Ⅰ、Ⅱ基因,所以能够特异性地检测HVT及HVT载体疫苗。
本试验建立的SYBR Green Ⅰ real-time PCR特异性好,灵敏度高,较标准PCR检测提高1个数量级别。定量试验中,只出现单一峰值,表明引物设计合理,并未出现染料的非特异性结合。通过条件优化,最终获得了较为理想的标准曲线,循环阈值(Ct值)和标准阳性模板起始拷贝数的对数间呈现良好的线性关系,相关系数为0.99(理想值应大于0.98,其值越接近1表明线性关系越好),扩增效率为81.7%(扩增效率应在0.8~1.2之间,以接近1为最佳)。并且具有良好的重复性和敏感性,可以用于后续的定量检测。一步生长曲线表明,无论在体内还是体外,构建的rHVT-pmpD-N与野生型HVT相比,增殖速度没有发生改变。
综上所述,本试验建立的基于SYBR Green Ⅰ 检测HVT的real-time PCR方法,可实现体内外定性和定量检测HVT及重组HVT,灵敏度高、特异性好、操作简便,对监控HVT的体内体外含量和增殖情况具有一定的实用价值。
[1] 崔 宁, 苏 帅, 李久庆, 等. 抗Ⅰ型马立克氏病毒sorf2蛋白的多克隆抗体制备及其特异性鉴定[J].微生物学报,2013,53(3):284-292.
[2] Soejoedono R D, Murtini S, Palya V, et al. Efficacy of a recombinant HVT-H5 vaccine against challenge with two genetically divergent Indonesian HPAI H5N1 strains[J].Avian Dis,2012,56(4 Suppl):923-927.
[3] Gao H, Cui H, Cui X, et al. Expression of HA of HPAI H5N1 virus at US2 gene insertion site of turkey herpesvirus induced better protection than that at US10 gene insertion site[J].PLoS One,2011,6(7):e22549.
[4] Li Y, Reddy K, Reid S M, et al. Recombinant herpesvirus of turkeys as a vector-based vaccine against highly pathogenic
H7N1 avian influenza and Marek's disease[J].Vaccine,2011,29(46):8257-8266.
[5] 王 友, 尤永君, 徐兆强,等.马立克病毒二价活疫苗效价检测实验[J].中国动物保健,2013,15(8):16-20.
[6] Esaki M, Noland L, Eddins T, et al. Safety and efficacy of a turkey herpesvirus vector laryngotracheitis vaccine for chickens[J].Avian Dis,2013,57(2):192-198.
[7] Esaki M, Godoy A, Rosenberger J K, et al. Protection and antibody response caused by turkey herpesvirus vector Newcastle disease vaccine[J].Avian Dis,2013,57(4):750-755.
[8] Abdul-Careem M F, Hunter B D, Sarson A J, et al. Host responses are induced in feathers of chickens infected with Marek's disease virus[J].Virology,2008,370(2):p.323-332.
[9] Geerligs H, Quanz S, Suurland B, et al. Efficacy and safety of cell associated vaccines against Marek's disease virus grown in a continuous cell line from chickens[J].Vaccine,2008,26(44):5595-5600.
[10] Wu C, Gan J, Jin Q, et al. Revaccination with Marek's disease vaccines induces productive infection and superior immunity[J].Clin Vac Immunol,2009,16(2):184-193.
[11] Walkden-Brown S W, Islam A F, Groves P J, et al. Development, application, and results of routine monitoring of Marek's disease virus in broiler house dust using real-time quantitative PCR[J].Avian Dis,2013,57(2 Suppl):544-554.
[12] 胡 骑, 信爱国, 李华春. O型口蹄疫病毒Real-time PCR检测方法的建立[J].动物医学进展,2014,35(1):50-53.
[13] 孙 洁, 卢体康, 曾少灵, 等. 鸡传染性法氏囊病病毒RT-PCR检测方法的建立与应用[J].动物医学进展, 2013,34(12):6-10.
Establishment and Application of SYBR Green Ⅰ Real-time PCR Assays for Detecting HVT
LIU Shan-shan1,2,SUN Wei1,YAN Min-xin1,HUANG Xiu-fen1,JIANG Liang1,HE Cheng2,LI Yong-qing1
(1.InstituteofAnimalHusbandryandVeterinaryMedicine,BeijingAcademyofAgriculturalandForestrySciences,Beijing,100097,China; 2.CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing,100193,China)
The purpose of this study was to develop a real-time PCR assay to detect and quantify herpesvirus of turkey(HVT)invivoandinvitrotargeting the unique sorf1 gene of the virus. This assay was carried out using a LingtCycler instrument and the product was monitored constinuously with the fluorescent double-stranded DNA binding dye SYBR Green Ⅰ. The duplicate character of wild HVT and recombinant HVT-pmpD-N(rHVT-pmpD-N)was detected using this method. Standard curve was established and the correlation index was 0.99. The result showed that SYBR Green Ⅰ real-time PCR had a minimum detection limit of 7×101copies/μL which was 10 times higher in sensitivity than standard PCR. SYBR Green Ⅰ real-time PCR assay also showed a similar replication rate between wild HVT and rHVT-pmpD-N. It was concluded that this could be an effective, economic and reliable method for rapid detection of wild HVT and recombinant HVT.
Herpesvirus of turkey;SYBR Green Ⅰ;real-time PCR;sorf1
2014-05-29
国家自然科学基金项目(31372420);北京市科技计划项目(Z121100001212001)
刘杉杉(1986-),女,山东烟台人,博士研究生,主要从事禽病疫苗和检测方法的研究。*
S852.659.1;Q789
:A
:1007-5038(2015)02-0016-05