乙酰唑胺对慢性癫痫大鼠海马NF-κB p65、IL-1β、IL-6 及TNF-α 表达的影响
余 涵 ,陈 丽,马 猛,周玉波,王林杰,罗亚楠,朱晓琴,雷水生
癫痫(Epilepsy)是一种常见的以脑部神经元同步化异常放电所致的以中枢神经系统功能失常为特征的慢性临床综合征,其中约有30%~40%的癫痫为药物难以控制的顽固性癫痫[1]。IL-1β、IL-6 和TNF-α 是具有广泛生物学作用的细胞因子,参与细胞免疫调节作用。大量临床和基础研究显示,细胞因子参与慢性癫痫的发病过程[2]。AQP4 是脑内与水的通透性有关的最重要的转运蛋白,并与癫痫发病的电生理学机制及难治性癫痫脑损伤机制等密切相关[3]。最近研究发现AQP4 缺失可以明显减轻脂多糖(LPS)诱导的促炎反应[4],提示AQP4 表达可能参与炎性因子的调控作用,然而在癫痫发作过程中AQP4 与炎性因子的关系不明确,本课题组前期研究已证实乙酰唑胺能通过抑制AQP4 的表达从而抑制癫痫发作(文章已录用),因此本研究采用AQP4 抑制剂乙酰唑胺抑制AQP4 的表达,旨在探讨在慢性癫痫发作过程中AQP4 与炎性因子间的调控关系以及乙酰唑胺抑制癫痫发作的其它可能机制。
1 材料与方法
1.1 主要试剂及动物 乙酰唑胺购自Sigma公司;戊四氮购自Sigma 公司;Trizol 购自Invitrogen公司;引物合成由上海Invitrogen 生物工程公司完成;RT-qPCR 试剂盒购自Takara 公司;ELISA 试剂盒购自深圳欣博盛公司;NF-κB p65 购于Abcam 公司;二抗购自北京中杉金桥公司;ECL 发光液购自凯基生物技术公司。
1.2 实验分组 选用成年健康(Sprague-Dawley,SD)大鼠(广州医科大学实验动物中心提供),体重(240 ±30)g,雌雄不拘,实验室常规条件下喂养。按实验要求随机分为3 组:对照组、致痫组、乙酰唑胺干预组。
1.3 慢性动物模型制备及评定标准 体重为(240 ±30)g 成年SD 大鼠50 只,(1)对照组(n=10)腹腔注射等量生理盐水;(2)致痫组(n=20)腹腔注射戊四氮亚剂量35 mg/kg;(3)乙酰唑胺干预组(n=20)腹腔注射乙酰唑胺35 mg/kg,30 min 后再注射上述剂量PTZ,连续注射28 d。每次注射均在上午8:00~10:00 进行。每次注射后1 h 内观察并记录痫性发作潜伏期和发作强度等行为学变化。癫痫发作强度按Racine 癫痫发作分级标准评价[5]:0 级:无抽搐反应;Ⅰ级:口周及面部肌肉抽搐;Ⅱ级:节律性点头样发作或甩尾;Ⅲ级:头部抽搐及前肢阵挛发作;Ⅳ级:直立,全身强直阵挛发作;Ⅴ级:惊厥致摔倒,全身强直阵挛发作伴失张力发作。凡至少连续出现5 d Ⅱ级以上的发作即认为慢性点燃成功[6]。
1.4 荧光定量PCR(RT-qPCR)检测IL-1β、IL-6、TNF-α mRNA 的表达 称取50 mg 海马,溶于500 μlTrizol,逆转录合成cDNA;β-actin 的引物序列:上游5'-GGAGATTACTGCCCGGCTCCTA-3’,下游5'-GACTCATCGTACTCCTGCTTGCTG-3’,扩增片段长度为150 bp。IL-1β 的引物序列:上游5'-CTGTACTCGTGGGATGATG-3’,下游5'-ACAGTGCATCATCGCTGTTC-3’,扩增片段长度为210 bp。IL-6的引物序列:上游5'-CAGTTGCCTTCTTGGGACT -3’,下游5'-TCTGACAGTGCATCATCGCT-3’,扩增片段长度为224 bp。TNF-α 的引物序列:上游5'-AGATGTGGAACTGGCAGAGG-3’,下游5'-GAGCCCATTTGGGAACTTCT -3’,扩增片段长度为181 bp。qPCR 反应条件为95 ℃30 s,95 ℃5 s,60 ℃34 s,共40 个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s。实验数据使用IL-1β、IL-6、TNF-α 和β-actin RNA 循环阈值(Ct)之差(△Ct)计算得到相关基因的表达情况。计算对比的样本间基因表达的差异(△△Ct),表达差异的倍数RQ 为2-△△Ct,以对照组的RQ 值为1,各组是相对于1 的变化倍数。
1.5 免疫蛋白印迹(Western blot)检测NF-κB p65 蛋白表达 取50 mg 海马组织加入蛋白裂解液,匀浆收集上清。蛋白定量后,以40 μg/孔上样,经10% SDS-PAGE 垂直电泳后电转移至PVDF 膜上,5% 脱脂奶粉室温封闭1 h,然后加入NF-κB p65兔抗大鼠单克隆抗体(1∶ 2000)和β-actin 兔抗大鼠单克隆抗体(1∶ 2000)4 ℃孵育过夜,辣根过氧化物酶标记山羊抗兔IgG(1∶ 5000)室温孵育1 h,ECL显色利用Gene Gnome 成像分析系统检测蛋白条带。使用Image-J 软件测定各条带的灰度值,以β-actin作为内参标准化NF-κB p65 蛋白的表达水平。
1.6 ELISA 检测海马和血清内IL-1β、IL-6、TNF-α 的表达 取50 mg 海马组织加入蛋白裂解液,匀浆收集上清。IL-1β、IL-6、TNF-α 含量严格按照ELISA 试剂盒说明书的步骤进行操作,以空白调零,450 nm 波长下检测光密度值,制作标准曲线,按照标准曲线算出各表达量。
1.7 统计学处理 实验数据采用SPSS 19.0统计软件进行处理,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析(ANOVA),以P <0.05 表示差异有统计学意义,P <0.001为差别有显著统计学意义。
2 结果
2.1 大鼠行为学观察 戊四氮注射后,首先为I 级发作,表现为全身颤抖、竖毛、嘴和面部肌肉抽搐反应,随着用药时间的延长,癫痫发作程度也加重,从活动减少、咀嚼、节律性点头(Ⅱ级)到头颈上仰、前肢阵挛发作(Ⅲ级)甚至出现明显出现直立竖尾、以尾拍击地面、全身强直阵挛发作甚至直立并摔倒(Ⅳ、Ⅴ级)。对照组未见癫痫发作。
2.2 海马组织中IL-1β、IL-6、TNF-α mRNA 的表达 RT-qPCR 结果显示脑组织IL-1β、IL-6、TNFα mRNA 的表达:致痫组均显著高于对照组和乙酰唑胺干预组(P <0.001 或P <0.05);乙酰唑胺干预组IL-1β、IL-6、TNF-α mRNA 表达有所下降但仍高于对照组(P <0.05)(见表1)。
2.3 海马组织中IL-1β、IL-6、TNF-α 蛋白的表达 ELISA 结果显示脑组织IL-1β、IL-6 和TNF-α蛋白的表达变化:IL-1β、IL-6 和TNF-α 在对照组中也有表达,致痫组中的含量显著高于对照组(P <0.001);癫痫模型大鼠用乙酰唑胺处理后IL-1β、IL-6、TNF-α 蛋白的含量低于致痫组(P <0.05),但仍高于对照组(P <0.05)(见表2)。
2.4 Western blot 检测各组NF-κB p65 蛋白表达情况 Western blot 结果显示:NF-κB/p65 蛋白在各组表达相对灰度值比值分别为(0.2192 ±0.0254)、(0.4741 ±0.0206)、(0.3561 ±0.0229)。致痫组与对照组相比NF-κB p65 蛋白表达量显著增加(P <0.001),致痫组NF-κB p65 蛋白表达要高于乙酰唑胺干预组(P <0.05),乙酰唑胺干预组与对照组相比明显降低(P <0.05)(见图1)。
表1 大鼠海马组织IL-1β、IL-6、TNF-α mRNA 的表达()

表1 大鼠海马组织IL-1β、IL-6、TNF-α mRNA 的表达()
致痫组、乙酰唑胺干预组与对照组比较* P <0.05,**P <0.001;乙酰唑胺干预组与致痫组比较#P <0.05
表2 大鼠海马组织IL-1β、IL-6 和TNF-α 蛋白的含量()(pg/ml)

表2 大鼠海马组织IL-1β、IL-6 和TNF-α 蛋白的含量()(pg/ml)
致痫组、乙酰唑胺干预组与对照组比较* P <0.05,**P <0.001;乙酰唑胺干预组与致痫组比较#P <0.05
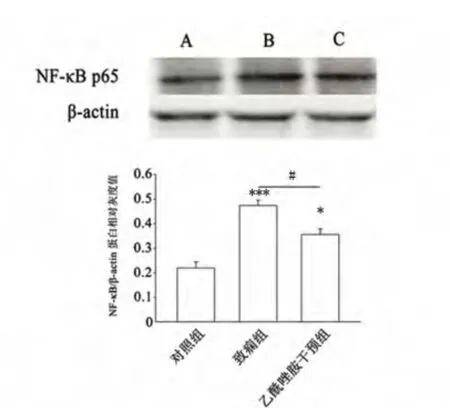
图1 Western blot 检测NF-κB p65 蛋白在大鼠海马组织中的表达
3 讨论
目前大多数学者认为,神经免疫调节网络失衡是癫痫发病的重要原因[7]。大量临床和基础研究也证实,炎性因子与炎症反应参与了癫痫的发病过程[8,9]。本课题前期实验研究发现大鼠侧脑室注射IL-1β 出现中度癫痫发作[10]。Gomez 等[11]发现药物长春西汀和卡马西平抗癫痫作用可能与减少大鼠海马内炎性因子IL-1β、TNF-α 表达有关。慢性癫痫反复发作致使脑内炎症持续性存在,脑组织发生病理改变,特别是脑内对癫痫发作敏感区域如海马等。
NF-κB 以二聚体的形式存在,是体内重要的信号调控蛋白。NF-κB 能通过与免疫球蛋白κ 轻链基因的增强子κB 序列特异性的结合,参与多种炎性因子基因的转录和调控,并与细胞因子、炎症介质的产生和释放有关[12]。p50/p65 异源二聚体是该家族成员中发挥主要作用的因子,广泛存在于神经元中。Crespel[13]利用合并海马硬化的颞叶癫痫患者术后病理切片进行免疫组化发现,胶质细胞和大脑锥体细胞NF-κB p65 过度表达,并推测癫痫形成过程可能是由NF-κB 介导的炎症反应过程。研究表明NFκB 信号通路参与了神经元兴奋和神经胶质疤痕的形成、神经元的调亡及突触可塑性变化等,过度激活将引起机体的炎症反应,诱发癫痫发作[14]。
AQP4 在正常脑组织中呈极性分布,主要表达在血管周围的星形胶质细胞终末足突,而靠近神经元侧的终末足突表达较少[15],在脑脊液的形成与吸收、渗透压调节、脑水肿形成等病理生理过程中发挥重要作用[16]。颞叶癫痫致海马硬化的患者手术所取的海马标本检测发现AQP4 mRNA 和蛋白表达量明显增加[17]。最近有研究显示AQP4 缺失可以明显减轻脂多糖(LPS)诱导的促炎反应,AQP4 敲除小鼠可降低炎症因子IL-1β、IL-6 和TNF-α 的表达[18]。大量研究表明星形胶质细胞可通过释放炎性因子,直接改变神经元的兴奋性[19],这些研究提示AQP4与炎性因子表达可能有密切联系。
本课题组前期在戊四氮诱导慢性致痫大鼠中应用乙酰唑胺,发现能够抑制AQP4 的表达,并且延长了慢性癫痫点燃潜伏期,具有抑制癫痫发作的效应。在本实验中RT-qPCR 以及ELISA 结果显示大鼠海马组织以及血清中IL-1β、IL-6、TNF-α 在致痫组的表达均明显高于对照组(P <0.001);Western blot 结果显示海马NF-κB p65 含量与对照组相比升高,差异有统计学意义(P <0.01)。本研究中戊四氮诱导大鼠慢性癫痫发作后,海马组织匀浆液中IL-1β、IL-6、TNF-α 的水平均升高,表明免疫细胞处于活化状态。本实验中RT-qPCR 和ELISA 结果显示乙酰唑胺干预组IL-1β、IL-6、TNF-α 的表达量与致痫组相比降低,差异有统计学意义(P <0.05),但依然高于对照组(P <0.05)。同样Western blot 结果显示乙酰唑胺干预组AQP4 和NF-κB p65 的表达量与慢性致痫组相比也降低,但依然高于对照组(P <0.05)。我们观察到用乙酰唑胺预处理后,海马促炎因子IL-1β、IL-6、TNF-α 表达量以及NF-κB p65 也下降。表明AQP4 的选择性抑制剂乙酰唑胺也能够抑制NF-κB 信号传导通路激活,使NF-κB p65 的活化程度下降,其下游所调控的IL-1β、TNF-α等炎症基因的转录下降,相应因子合成减少,炎症反应减轻,而在待发表的文章中我们已证实AQP4 选择性抑制剂乙酰唑胺预处理后能够明显延长戊四氮致慢性癫痫大鼠发作潜伏期。因此乙酰唑胺可能通过减轻炎症反应抑制癫痫发作。
结合前期研究,戊四氮致痫后AQP4 表达增加,而AQP4 与脑内水平衡维持密切相关。神经网络间过多的水经星形胶质细胞上AQP4 通道及时的转运到血管前区域,以维持神经网络细胞间正常的间隙和渗透压。癫痫发作后靠近神经元一侧的星形胶质细胞突触上AQP4 表达增加,而靠近血管前一侧表达量减少,使得水在神经网络间的转运紊乱,导致星形胶质细胞水肿性损伤。AQP4 选择性抑制剂能够抑制AQP4 和炎性因子的表达,进而抑制癫痫发作。其机制可能与乙酰唑胺抑制AQP4 表达、改善星形胶质细胞水肿损伤、减轻炎性因子的表达有关。也有研究发现双氯芬酸钠能够增强炎性因子及星形胶质细胞膜上AQP4 的表达[20]。Ito[21]等人研究发现经侧脑室穿刺注射IL-1β 后能够引起AQP4 的表达上调。既往研究表明炎性因子IL-1β、IL-6、TNF-α 在癫痫发作后6 h 快速升高[22],并且大量研究表明慢性炎性因子持续性表达可能参与了癫痫自发性发作过程[23]。我们推测癫痫发作后星形胶质细胞分泌炎性因子IL-1β、IL-6、TNF-α,引起神经退行性变,血脑屏障破坏甚至导致脑水肿,这些病理改变同时维持了炎性因子信号表达,使得癫痫脑内持续性炎症刺激,导致神经元变性、兴奋性增高以及血脑屏障破坏,最终导致癫痫反复发作。有研究证实星形胶质细胞对整个癫痫形成过程中维持炎性活化状态有重要作用。
综上所述,可能是在癫痫发作早期,炎性因子大量表达刺激星形胶质细胞膜上AQP4 表达增加,致使星形胶质细胞水肿性损伤激活NF-κB 等信号分子促进炎性因子的分泌,使癫痫状态下慢性炎症持续存在。然而本实验没有抑制炎性因子表达来研究炎性因子表达对AQP4 的调控作用。因此,需进一步研究AQP4 与炎症因子在癫痫反复发作过程中的关系,为控制癫痫发作和预防复发提供新的思路。
[1]Kwan P,Brodie MJ.Early identification of refractory epilepsy[J].N Engl J Med,2000,342(5):314-319.
[2]Vezzani A,Aronica E,Mazarati A,et al.Epilepsy and brain inflammation[J].Exp Neurol,2013,244:11-21.
[3]Alvestad S,Hammer J,Hoddevik EH,et al.Mislocalization of AQP4 precedes chronic seizures in the kainate model of temporal lobe epilepsy[J].Epilepsy Res,2013,105(1/2):30-41.
[4]Li L,Zhang H,Varrin-Doyer M,et al.Proinflammatory role of aquaporin-4 in autoimmune neuroinflammation[J].FASEB J,2011,25(5):1556-1566.
[5]Mcnamara JO.Kindling:an animal model of complex partial epilepsy[J].Ann Neurol,1984,16:72-76.
[6]Dhir A.Pentylenetetrazol (PTZ)kindling model of epilepsy[J].Curr Protoc Neurosci,2012,9:9-37.
[7]Billiau AD,Wouters CH,Lagae LG.Epilepsy and the immune system:is there a link[J].Eur J Paediatr Neurol,2005,9(1):29-42.
[8]Uludag IF,Duksal T,Tiftikcioglu BI,et al.IL-1beta,IL-6 and IL1Ra levels in temporal lobe epilepsy[J].Seizure,2015,26:22-25.
[9]Shimada T,Takemiya T,Sugiura H,et al.Role of inflammatory mediators in the pathogenesis of epilepsy[J].Mediators Inflamm,2014,2014:901-902.
[10]朱晓琴,雷水生,李正莉,等.IL-1β、IL-6 致痫对大鼠脑电的影响[J].咸宁学院学报(医学版),2007,3:203-207.
[11]Gomez CD,Buijs RM,Sitges M.The anti-seizure drugs vinpocetine and carbamazepine,but not valproic acid,reduce inflammatory IL-1beta and TNF-alpha expression in rat hippocampus[J].J Neurochem,2014,130(6):770-779.
[12]Pasparakis M.Regulation of tissue homeostasis by NF-kappaB signalling:implications for inflammatory diseases[J].Nat Rev Immunol,2009,9(11):778-788.
[13]Crespel A,Coubes P,Rousset MC,et al.Inflammatory reactions in human medial temporal lobe epilepsy with hippocampal sclerosis[J].Brain Res,2002,952(2):159-169.
[14]Das A,Wallace GT,Holmes C,et al.Hippocampal tissue of patients with refractory temporal lobe epilepsy is associated with astrocyte activation,inflammation,and altered expression of channels and receptors[J].Neuroscience,2012,220:237-246.
[15]Binder DK,Papadopoulos MC,Haggie PM,et al.In vivo measurement of brain extracellular space diffusion by cortical surface photobleaching[J].J Neurosci,2004,24(37):8049-8056.
[16]Medici V,Frassoni C,Tassi L,et al.Aquaporin 4 expression in control and epileptic human cerebral cortex[J].Brain Res,2011,1367:330-339.
[17]Lee T S,Eid T,Mane S,et al.Aquaporin-4 is increased in the sclerotic hippocampus in human temporal lobe epilepsy[J].Acta Neuropathol,2004,108(6):493-502.
[18]Ikeshima-Kataoka H,Abe Y,Abe T,et al.Immunological function of aquaporin-4 in stab-wounded mouse brain in concert with a pro-inflammatory cytokine inducer,osteopontin[J].Mol Cell Neurosci,2013,56:65-75.
[19]Wetherington J,Serrano G,Dingledine R.Astrocytes in the epileptic brain[J].Neuron,2008,58(2):168-178.
[20]Asai H,Kakita H,Aoyama M,et al.Diclofenac enhances proinflammatory cytokine-induced aquaporin-4 expression in cultured astrocyte[J].Cell Mol Neurobiol,2013,33(3):393-400.
[21]Ito H,Yamamoto N,Arima H,et al.Interleukin-1beta induces the expression of aquaporin-4 through a nuclear factor-kappaB pathway in rat astrocytes[J].J Neurochem,2006,99(1):107-118.
[22]肖 倩,赵永波.癫痫与炎性因子[J].中国神经免疫学和神经病学杂志,2011,1:48-50.
[23]Vezzani A,Balosso S,Ravizza T.The role of cytokines in the pathophysiology of epilepsy[J].Brain Behav Immun,2008,22(6):797-803.

