腺苷预处理对局灶性脑缺血再灌注损伤大鼠脑内Wnt1 表达的影响
尉 娜,赵建华,李 娟,谭 军
缺血性脑血管疾病是严重危害人们身体健康的常见病、多发病,脑缺血后神经细胞的不可逆性损害是临床难以取得满意疗效的主要原因,通过缺血预处理能对大脑具有保护作用,为研究内源性神经保护机制和神经保护治疗方法提供了新的研究方向。本实验中我们选用腺苷作为预处理的药物,通过对大鼠脑缺血再灌注模型进行腺苷预处理,观察Wnt1 蛋白的表达情况,来探讨腺苷预处理对局灶性脑缺血再灌注大鼠内源性神经干细胞增殖影响的机制,从而为腺苷应用于临床治疗脑血管疾病奠定理论基础。
1 材料和方法
1.1 实验动物及分组 健康SD 大鼠224 只(雄性,体重250~300 g)由新乡医学院实验动物中心提供。随机分为假手术组(F 组)、腺苷预处理后假手术组(AF 组)、缺血再灌注组(IR 组)、和腺苷预处理组(AP 组)共4 组,每组根据再灌注时间随机分为1 d、3 d、7 d、14 d、21 d 5 个亚组。F 组和IR组大鼠术前3d 开始每天腹腔注射生理盐水2 ml;AF 和AP 组大鼠术前3 d 开始每天腹腔注射腺苷注射液,剂量为1.5 mg/kg,生理盐水稀释到2 ml。
1.2 主要试剂 腺苷注射液(沈阳光大制药有限公司,批准文号:国药准字H20030320、规格:6 mg/2 ml),兔抗大鼠Wnt1 蛋白抗体(1∶ 100)、即用型SABC 免疫组化试剂盒、DAB 显色试剂盒(武汉博士德生物工程有限公司),Nikon MODEL YS100显微镜(Nikon),照相显微镜HPIAS-2000 显微图像定量分析系统(郑州太阳电子科技公司)。
1.3 实验方法
1.3.1 大鼠局灶性脑缺血再灌注模型的建立本实验采用尼龙线栓塞法制备大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型[1,2],阻断MCA 2 h 后,轻轻向外抽拉尼龙线至颈外动脉主干,大脑动脉Willis 环和MCA 已恢复血供,保持体温至清醒。大鼠术后单笼饲养,自由饮水和进食,并给予抗生素及补液治疗。
1.3.2 神经功能缺失评分 各组大鼠处死取材前均应用Zea Longa[3]的5 分制法对大鼠进行神经功能缺失评分,求其平均值作为该大鼠神经功能得分。评分标准:0 分:没有神经功能的缺损症状;1分:对侧前上肢不能伸展完全;2 分:行走时上肢不能伸展完全;3 分:行走时向病灶对侧倾倒;4 分:陷入意识丧失状态。实验纳入标准为1~3 分,排除标准为0 分或4 分。
1.3.3 Western blotting 检测Wnt1 蛋白的表达
1.3.3.1 检测Wnt1 蛋白浓度 分别取各组大鼠5 只,10%水合氯醛溶液腹腔注射麻醉后,立即冰上断头取右侧海马按1∶ 9 加入匀浆缓冲液,冰上裂解、匀浆。4 ℃低温离心机15000 r/min,离心30 min。取 上 清 分 装 至EP 管 中,每 管50 μl,-80 ℃冰箱保存。按照BCA 蛋白浓度的测定试剂盒说明书进行。应用酶标仪检测所得样品,根据所得的标准曲线来计算样品的浓度值。
1.3.3.2 Wnt1 蛋白免疫印迹 将所得样品与缓冲液按体积比4∶ 1 混匀,于100 ℃沸水中加热5 min,取出后行30 s 的低速离心,静置备用。取出胶板上的加样梳,组装电泳装置,加入电泳缓冲液,加样电泳,浓缩胶范围内电压60 V,跑至分离胶后电压改为120 V,待与所需的目的及内参蛋白相应位置的Marker 完全跑开时停止电泳。按照电转仪的阳极-3 层滤纸-PVDF 膜-胶-3 层滤纸-电转仪的阴极顺序放置,保证55 min 的条件转目的蛋白所在的膜(0.45 μm);以2 mA/cm2,90 min 的条件转内参蛋白所在的膜(0.45 μm)。蛋白转移至PVDF 膜后,用含5%脱脂奶粉的TBST 缓冲液室温封闭1 h。加入兔抗大鼠Wnt1 蛋白抗体(1∶ 100),或兔抗鼠β-actin 抗体(1∶ 2000)4 ℃孵育过夜。回收一抗,取出PVDF 膜,TBST 溶液洗膜3 次,每次5 min。在室温下相应加入山羊抗兔IgG 抗体孵育2 h,TBST溶液洗膜3 次,每次5min。随后用超敏ECL 化学发光试剂显色,凝胶成像分析系统摄像分析。
1.4 统计学处理 使用SPSS 13.0 统计软件对实验数据进行统计学分析。数据均以均数±标准差()表示,数值变量资料的组间比较采用单因素方差分析(one-way ANOVA),两两比较采用最小显著差(LSD)t 检验,P <0.05 表示差异具有统计学意义。
2 结果
2.1 神经功能缺失评分结果 对各组不同再灌注时间点大鼠进行神经功能缺失行为学评分。F、AF 组大鼠评分为0 分。IR、AP 组大鼠均有不同程度神经功能缺失症状,AP 组大鼠相应时间点的神经功能评分均较IR 组低,相比较差异具有统计学意义(P <0.05)。结果同时发现,IR、AP 组均随着再灌注时间的延长,神经功能评分呈逐渐降低趋势,推测可能与大鼠自我修复能力有关(见表1)。
2.2 Wnt1 蛋白免疫印迹结果 结果发现,F、AF 组Wnt1 几乎不表达;IR、AP 组Wnt1 蛋白随着缺血再灌注时间的延长,表达均逐渐增加,于再灌注7 d 时达到最高峰。与前两组相比,IR、AP 组Wnt1表达的增加比较明显(P <0.01),且AP 组比IR 组表达增强(P <0.05)(见表2)(见图1~图3)。
表1 各组不同再灌注时间点大鼠神经功能缺失评分()

表1 各组不同再灌注时间点大鼠神经功能缺失评分()
与IR 组比较* P <0.05
表2 局灶性脑缺血对大鼠海马Wnt1 表达的影响()

表2 局灶性脑缺血对大鼠海马Wnt1 表达的影响()
与F 组、AF 组比较* P <0.01;与IR 组相比较#P <0.05

图1 不同时间点IR 组大鼠Wnt1 蛋白免疫印迹结果。β-actin为内对照
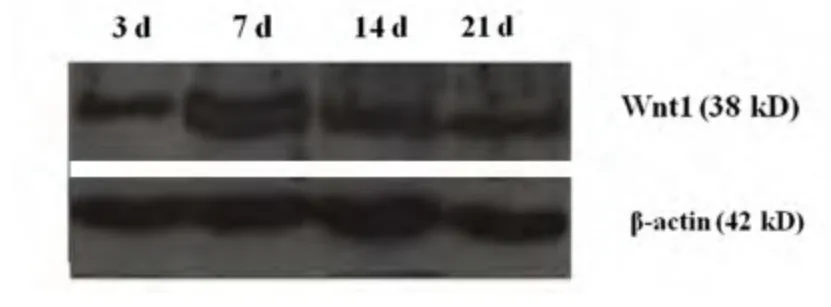
图2 不同时间点AP 组大鼠Wnt1 蛋白免疫印迹结果。β-actin 为内对照
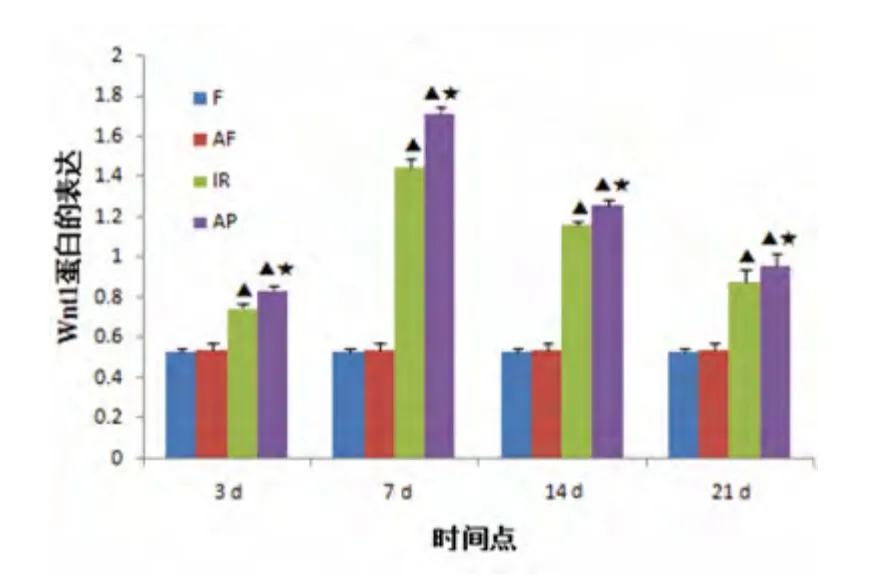
图3 不同时间点各组局灶性脑缺血再灌注大鼠Wnt1 蛋白表达与F 组、AF 组相比▲P <0.01;与IR 组相比★P <0.05
3 讨论
随着老龄化时代的到来,脑血管疾病是当今人类的三大死因之一,在我国居于首位,尤以缺血缺氧性脑血管病最常见[1],其高发病率、高致残率及高死亡率给患者、家庭及社会带来了极大的痛苦和负担。虽然目前人们对其病理机制进行了深入研究发现,其病理过程是一个多因素、多机制,涉及复杂的时间和空间的级联反应[2,3],但有效的治疗手段还没有取得突破性进展。脑缺血损伤后神经元的死亡不可避免,如何替补受损神经元进而恢复脑功能是目前治疗难点和热点。
Anderson[4]等于1989 年首次证实了神经干细胞(neural stem cells,NSCs)的存在,NSCs 是一种原始细胞,具有自我更新潜能及多方向分化的能力,于是如何激活NSCs 进而利用NSCs 生物潜能达到治疗作用成了学者们研究的热点。成年的哺乳动物NSCs,大部分存在于脑室下区(subventricular zone,SVZ)和颗粒下层(subgranular zone,SGZ)[5,6]。NSCs 进行自我更新和多方向分化的潜能(干性的维持)的机制非常复杂,目前其确切的机制仍不清楚。总体来说,NSCs 的干性维持受到内源因子调控,常见因子包括Wnt、Notch、Hes 等信号通路及转录因子,同时它也受到外源性信号调控,常见外源信号是围绕在NSCs 周边的细胞因子、基质细胞等所谓的微环境[7~13]。
Wnt 蛋白是成体干细胞的外源性调控因子,是控制动物胚胎发育、细胞命运及组织器官形态形成的重要信号通路之一[14]。当Wnt 信号途径激活时,Wnt 蛋白通过自分泌或旁分泌作用与位于细胞膜上的受体相结合,激活细胞内信号通路,调节靶基因的表达[15]。近年来,Wnt 信号通路调控NSCs 增殖、分化的作用越来越受到广泛的关注。邢雪松[16]等发现在大鼠脑缺血再灌注时Wnt1 的时间依赖性表达与NSCs 的增殖过程相吻合。Chen BY[17]等研究表明,应用Wnt 信号通路特异性阻断剂IWR1 后,BDNF 对NSCs 增殖、分化的促进作用受到显著抑制。这些均说明NSCs 的增殖与Wnt 信号通路有着重要的联系。本课题组先前研究证明,缺血再灌注损伤后会引起脑内内源性神经干细胞增殖,在腺苷预处理干预后其增殖明显增加。本试验发现:假手术组与腺苷预处理后假手术组大鼠脑组织Wnt1 蛋白表达极低;缺血再灌注组与腺苷预处理组Wnt1 蛋白的表达随着缺血再灌注时间的延长,均明显增加(P <0.01),腺苷预处理组与缺血再灌注组比较,差异具有显著性(P <0.05)。参照Nestin 免疫组化结果,Wnt1 测定的时间窗与内源性NSCs 增殖相一致,说明Wnt 信号通路分子在内源性NSCs 增殖过程中起着重要调控作用。推测腺苷可能通过激活Wnt 信号通路从而促进内源性NSCs 增殖。
腺苷通过Wnt 信号途径对神经系统的NSCs 增殖有着重要的作用,但是其对NSCs 的分化作用会是怎样呢,仍需做进一步研究。如果能够深入明确腺苷对NSCs 增殖分化的作用机制,并以此为依据,为科研和临床提供不同目的的NSCs,对于神经系统疾病的治疗将会有很大的意义。
[1]王虹虹,曾 红.缺血性脑血管病概述[J].中国临床医生,2011,39(6):7-10.
[2]Bielewicz J,Kurzepa J,Lagowska-Lenard M,et al.The novel views on the patomechanism of ischemic stroke[J].Wiad Lek,2010,63(3):213-220.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]Anderson DJ,Michelsohn A.Role of glucocorticoids in the chromaffinneuron developmental decision[J].Int J Dev Neurosci,1989,7(5):475-487.
[5]Wen T,Li H,Song H,et al.Down-regulation of specific gene expression by double-strand RNA induces neural stem cell differentiation in vitro[J].Mol Cell Biochem,2005,275 (1-2):215-221.
[6]Whitman MC,Greer CA.Adult neurogenesis and the olfactory system[J].Prog Neurobiol,2009,89(2):162-175.
[7]Li Y,Hibbs MA,Gard AL,et al.Genome-wide analysis of N1ICD/RBPJ targets in vivo reveals direct transcriptional regulation of Wnt,SHH,and hippo pathway effectors by Notch1[J].Stem Cells,2012,30(4):741-752.
[8]Stabenfeldt SE,Munglani G,Garcia AJ,et al.Biomimetic microenvironment modulates neural stem cell survival,migration,and differentiation[J].Tissue Eng Part A,2010,16(12):3747-3758.
[9]Lendahl U,Zimmerman LB,McKay RD,et al.CNS stem cells express a new class of intermediate filament protein.[J].Cell,1990,60(4):585-595.
[10]Von Bohlen,Halbach O.Immunohistological markers for proliferative events,gliogenesis,and neurogenesis within the adult hippocampus[J].Cell and Tissue Research,2011,345(1):1-19.
[11]Moon C,Ahn M,Kim S,et al.Temporal patterns of the embryonic intermediate filaments nestin and vimentin expression in the cerebral cortex of adult rats after cryoinjury[J].Brain Res,2004,1028(2):238-242.
[12]Douen AG,Dong L,Vanance S,et al.Regulation of nestin expression after cortical ablation in adult rat brain[J].Brain Res,2004,1008(2):139-146.
[13]Yu J,Zeng J,Cheung RT,et al.Intracerebroventricular injection of epidermal growth factor reduces neurological deficit and infarct volume and enhances nestin expression following focal cerebral infarction in adult hypertensive rats[J].Clin Exp Pharmacol Physiol,2009,36(5~6):539-546.
[14]Wexler EM,Paucer A,Kornblum HI,et al.Endogenous Wnt signaling maintains neural progenitor cell potency[J].Stem Cells,2009,27(5):1130-1141.
[15]Guo YJ,Zhang ZJ,Wang SH,et al.Notch1 signaling,hippocampal neurogenesis and behavioral responses to chronic unpredicted mild stress in adult ischemic rats[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(4):688-694.
[16]邢雪松,吕威力.Wnt-1 在大鼠脑缺血再灌注海马组织内源性神经干细胞早期增殖分化中的作用[J].中国组织工程研究与临床康复,2007,11(3).
[17]Chen BY,Wang X,Wang ZY,et al.Brain-derived neurotrophic factor stimulates proliferation and differentiation of neural stem cells,possibly by triggering the Wnt/β-catenin signaling pathway[J].J Neurosci Res,2013,91(1):30-41.

