JAK2 抑制剂AG490 对EAE 小鼠C57BL/6 的Th17/Treg 细胞平衡的影响
董 梅,王 彬,辛立建,郭 力,檀国军,刘瑞春
多发性硬化(multiple sclerosis,MS)是中枢神经系统炎性脱髓鞘性自身免疫性疾病,发病机制尚不完全清楚,考虑与遗传、环境等多种因素有关,目前越来越多研究表明MS 发病可能与患者体内Th17/Treg 细胞失衡有关。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是国际公认的MS 经典模型,对MS 的发病机制、病程进展、诊治方法等研究有重要的指导作用。近来研究发现MS/EAE 或许与Th17/Treg 失衡有关。
JAK-STAT 信号通路广泛参与炎症反应、肿瘤等多种生理、病理反应。JAK 是一种非受体型酪氨酸蛋白激酶,目前发现JAK 家族包括JAK1-3 及TYK2。STAT 即信号传导及转录激活因子,磷酸化后进入细胞核内调节不同靶基因的转录。不同细胞因子激活不同的JAK 引起相应的STAT 磷酸化,从而调节特定基因对应产物的含量引起各种生物效应。JAK-STAT 信号通路同时参与了Th17 和Treg细胞分化的调节。
本研究应用JAK2 特异性抑制剂AG490 干预C57BL/6 小鼠EAE 模型,观察EAE 小鼠脊髓组织病理变化及免疫组化染色IL-17、Foxp3+及p-STAT5表达情况。探讨JAK2 抑制剂通过调控JAK-STAT信号通路,对Th17/Treg 平衡的影响和对EAE/MS的治疗作用。
1 材料与方法
1.1 实验动物和试剂
1.1.1 试 剂 MOG35-55 多肽购自西安霖肽生物科技有限公司,百日咳毒素购自ENZO 公司,AG490 购自Selleck 公司,FoxP3 抗体购自Immuno-Way 公司,p-STAT5 抗体购自bioworld 公司,IL-17抗体购自博士德公司。
1.1.2 实验动物 C57BL/6 小鼠60 只,体重18~22 g,6~8 周龄,购于河北医科大学实验动物中心(许可证号SCXK 冀2008-1-003)。
1.2 实验方法
1.2.1 实验动物分组 将实验动物随机分为对照组、EAE 组和AG490 组。每组按时间点分为免疫后13 d 即发病初期组,免疫后20 d 即高峰期组,每个时间点动物各10 只。
1.2.2 动物模型建立与干预 以200 μl 磷酸盐缓冲液(PBS)溶解300 μg 人工合成MOG35-55 多肽,与等量含有4 mg/ml 卡介苗的完全弗氏佐剂(CFA)充分混合成为油包水乳剂,制备完全抗原,免疫小鼠。EAE 组和AG490 组均于免疫后第0 小时和48 h 于腹腔内注射百日咳毒素500 ng,制备EAE模型。直接将200 μl PBS 与等量CFA 乳化免疫动物作为对照组。干预时,于免疫后第3、5、7、9、11、13、15、17、19 天给予AG490 组小鼠AG490 1 mg 皮下注射至处死,生理盐水0.1 ml/d 给予对照组和EAE 组小鼠皮下注射。免疫当天记为第0 天。
1.2.3 指标观察 按实验设计,各组动物于免疫后第13 天和第20 天取材,以水合氯醛麻醉小鼠至出现软瘫状态,用生理盐水冲洗左心室,之后用4%多聚甲醛灌注,取材后将脊髓组织固定于4%多聚甲醛,制备蜡块,进行HE 染色及免疫组化染色,观察炎症、IL-17、Foxp3+及p-STAT5 表达情况。
1.2.4 统计学分析 采用SPSS13.0 统计软件进行统计分析,计量资料以均数±标准差()表示,若数据不满足正态性(P <0.05)则进行秩转换,多组计量资料均数的比较应用ANOVA 方差分析,组间两两比较采用SNK 法,P <0.05 差异有统计学意义。
2 结果
2.1 临床表现 小鼠免疫后逐渐出现精神萎靡、食欲下降、体重减轻,于免疫后12 d 开始出现尾部无力、肢体瘫痪和二便失禁等,AG490 组较EAE组小鼠发病率下降,发病时间延迟,症状减轻。
2.2 小鼠脊髓HE 染色 EAE 组小鼠发病初期可见少量“血管袖套”现象和大量淋巴细胞浸润,发病高峰期可见到较多的“血管袖套”现象和更多的淋巴细胞浸润,而AG490 组同时期炎症均较EAE组减轻(见图1)。
2.3 小鼠脊髓IL-17、Foxp3+及p-STAT5 表达情况 EAE 组小鼠脊髓发病高峰期较发病初期IL-17 阳性细胞数量增多(P <0.05),p-STAT5 和Foxp3阳性细胞数目减少(P <0.05)。AG490 组小鼠脊髓IL-17 阳性细胞数目较同时期EAE 组小鼠减少(P <0.05),p-STAT5 和Foxp3 阳性细胞数目增多(P <0.05,见表1~表3)。
表1 各组IL-17 阳性细胞数目比较()

表1 各组IL-17 阳性细胞数目比较()
高峰期与发病初期比较* P <0.05;AG490 组与EAE 组比较☆P <0.05;EAE 组、AG490 组与对照组比较#P <0.05
表2 各组Foxp3 阳性细胞数目比较()

表2 各组Foxp3 阳性细胞数目比较()
高峰期与发病初期比较* P <0.05;AG490 组与EAE 组比较☆P <0.05;EAE 组、AG490 组与对照组比较#P <0.05
表3 各组p-STAT5 阳性细胞数目比较()

表3 各组p-STAT5 阳性细胞数目比较()
高峰期与发病初期比较* P <0.05;AG490 组与EAE 组比较☆P <0.05;EAE 组、AG490 组与对照组比较#P <0.05
3 讨论
Th17 细胞与包括MS、SLE、RA 在内的多种自身免疫性疾病有密切联系。在MS 中Th17 细胞通过自身表达的趋化因子受体CCR6 与脉络丛上皮细胞的趋化因子受体配体CCL20 相互作用从而透过脉络丛进入蛛网膜下腔,进一步引起其他炎症细胞聚集,释放IL-17 在内的细胞因子从而引起相应炎症介质释放造成BBB 破坏、髓鞘脱失、轴索损伤等病理损害[1]。Th17 细胞是由初始CD4+T 细胞在IL-6和TGF-β 的共同作用下分化而来[2],如果只存在TGF-β 而缺失IL-6,初始CD4+T 细胞则分化为Treg细胞[3]。维甲酸相关孤儿核受体γt(RORγt)以及RORα 属于细胞内转录因子核受体家族中的成员,他们是Th17 重要的转录因子。由IL-6 在TGF-β 存在的前提下,通过IL-6R 募集并磷酸化JAK1、JAK2、Tyk2,磷酸化后的JAK2 把结合在IL-6R 上的STAT3磷酸化形成二聚体,进入细胞核调节靶基因上调RORγt,促进Th17 细胞形成以及IL-17 分泌。IL-17可以通过加强粒细胞集落刺激生物因子(GM-CSF)和GM-CSF 受体增加嗜中性粒细胞、巨噬细胞等聚集。IL-17 还可以激活NF-κB、MAPK 信号通路加强促炎症因子CXCL1、CXCL2、CXCL5 等合成[4]。此外IL-17 还能促进基质金属蛋白(MMPs)的合成以帮助T 细胞降解胞外基质。
Treg 细胞是一类高表达IL-2 受体α 链(CD25)的CD4+T 细胞,在免疫应答的负调节及自身免疫耐受中发挥重要保护作用,此类细胞功能障碍可导致自MS 在内的多种自身免疫性疾病、代谢性疾病、过敏性疾病等异常。叉头蛋白3(Foxp3)不仅是Treg细胞重要的标志,同时也参与Treg 的分化及功能。Foxp3 的功能缺失可以导致X 连锁隐性自身免疫和炎性综合征[5]。Treg 细胞主要包括从胸腺直接分化而来的自然调节T 细胞(nTreg)和在外周由初始CD4+T 细胞接受抗原及其他因素诱导产生的适应性调节T 细胞(iTreg)。它们的表型都是CD4+CD25+Foxp3+Treg,主要通过与靶细胞直接接触及分泌TGF-β、IL-10、IL-35 细胞因子来抑制免疫应答。Treg 细胞主要通过细胞毒T 淋巴细胞相关抗原4(CTLA-4/CD152)影响CD80/CD86 介导的效应T 细胞及APC 与靶细胞接触的抑制自身攻击细胞[6],而TGF-β、IL-10 主要通过抑制DC 来发挥免疫调节作用[5]。并且TGF-β 通过Smad 家族同时参与了Th17 和Treg 细胞分化调节。
JAK-STAT 信号通路广泛参与CD4+T 细胞的分化,初始CD4+T 细胞在IFN-γ 和IL-12 作用下通过JAK1/JAK2-STAT1/STAT4 调控Th1 细胞分化,在IL-4 作用下通过STAT4/GATA3 调控Th2 细胞分化,在TGF-β 和IL-6 作用下通过JAK2/JAK1/Tyk2-STAT3 调控Th17 细胞分化,在TGF-β 和IL-2 作用下通过JAK1/JAK3-STAT5 调控Treg 细胞分化。AG490 是JAK2 特异性酪氨酸激酶抑制剂,并且不影响JAK1、Tyk2 的活性,被广泛用于抑制JAK2 参与的 信 号 传 导[7,8],所 以AG490 主 要 通 过 抑 制JAK2-STAT3 信号通路影响Th17 细胞的分化和IL-17 的合成,由于调节Treg 细胞分化功能的主要是JAK1/JAK3-STAT5 信号通路以及Smad 蛋白家族,所以AG490 并不影响CD4+CD25+Foxp3+Treg 细胞分化和功能,故本实验应用AG490 腹腔注射于小鼠EAE 模型来观察小鼠炎症反应情况及JAK2 抑制剂对Th17/Treg 细胞平衡的影响情况。
由于STAT3 不仅对Th17 分化起重要作用,同时也参与Treg 分化的调节[9],而IL-17 和EAE 的进展具有直接关系,所以,我们将IL-17 作为Th17 数量和功能的观察指标。可以看到随着小鼠EAE 模型发病,EAE 组小鼠逐渐表现出食欲减低、精神萎靡、尾部无力等临床症状,并且HE 染色可以观察到小鼠脊髓组织内淋巴细胞浸润增多,“血管袖套”现象逐渐明显,而此时IHC 观察到小鼠脊髓内IL-17阳性细胞数增多,说明逐渐增多的Th17 细胞和IL-17 导致小鼠病情的进展,在AG490 组小鼠中也可以看到随着时间推移,IL-17 阳性细胞数目的增多,但在与EAE 组相对应时期的小鼠相比IL-17 阳性细胞数目相比较少,这也与AG490 组小鼠临床症状相对较轻符合,这说明AG490 抑制了Th17 细胞的分化和功能。
Th17 细胞和CD4+CD25+Foxp3+Treg 细胞分化和功能在多个水平上相互抑制拮抗,Smad7 对Foxp3表达具有抑制作用,IL-6R 可以通过增加Smad7 的表达来抑制TGF-β 引起的Foxp3 表达[10],此外ROR-γt 和Foxp3 也具有互相抑制作用[11],STAT3和STAT5 由于都具有SH2 结构域也可以相互竞争结合位点,所以Th17 在许多层面上都对Treg 具有抑制作用,这或许可以解释为什么当TGF-β 单独存在是初始CD4+T 细胞向Treg 方向分化,而当TGFβ 和IL-6 同时存在时则初始CD4+T 细胞向Th17 方向分化。故当我们用JAK2 抑制剂AG490 抑制IL-6-JAK2-STAT3 的信号传导后不仅可以抑制Th17 细胞分化和IL-17 合成,而且通过减小Th17 对Treg 的抑制可以促进CD4+CD25+Foxp3+Treg 分化。由于CD4+CD25+Foxp3+Treg 不仅释放抗炎介质而且还能与炎症细胞相互接触来发挥抗炎作用,TGF-β 不仅促进CD4+CD25+Foxp3+Treg 分化,也对通过Smad 蛋白对Th17 细胞分化起重要作用,IL-10 则不仅具有抗炎作用也可以发挥促进炎症反应的作用[12],但基本nTreg 和iTreg 都表达Foxp3,并且Foxp3 也对CD4+CD25+Foxp3+Treg 的功能发挥起作用,所以我们将p-STAT5 和Foxp3 作为衡量CD4+CD25+Foxp3+Treg 数量和功能的指标。可以看到不论EAE 组还是AG490 组发病高峰期与发病初期相比,高峰期p-STAT5 和Foxp3 阳性细胞数量都有一定程度减少,这说明随着EAE 病情发展,Th17 逐渐增多对CD4+CD25+Foxp3+Treg 细胞的抑制作用也逐渐加强,Th17/Treg 平衡偏向Th17 细胞导致炎症反应加强。但同一时期AG490 组小鼠脊髓p-STAT5 和Foxp3 阳性细胞数比EAE 组小鼠脊髓明显增多,这与AG490 组小鼠炎症细胞浸润相对较少及“血管袖套”现象不如EAE 组小鼠明显相一致,说明AG490 虽然没有完全阻止EAE 发病,但很大程度上抑制了Th17 细胞的功能促使Th17/Treg平衡偏向Treg 方向,并减缓EAE 小鼠炎症反应。
总之,AG490 作为一种JAK2 特异性抑制剂缓解了EAE 小鼠的炎症反应,调整Th17/Treg 的方向,显示出了对MS 患者的潜在治疗价值,并且SOCS1 和SOCS3 具有相似的作用,都可以与通过抑制JAK2 磷酸化发挥调节作用[13],同时由于Treg 调节免疫反应参与MS 在内的多种自身免疫性疾病,预示着与通过干预JAK2-STAT3-SOCS 信号通路来调节Th17/Treg 平衡或许可以成为MS 等自身免疫性疾病一个新的治疗方向。
[1]Sie C,Korn T,Mitsdoerffer M.Th17 cells in central nervous system autoimmunity[J].Experimental Neurology,2014,262:18-27.
[2]Ghoreschi K,Laurence A,Yang XP,et al.T helper 17 cell heterogeneity and pathogenicity in autoimmune disease[J].Trends Immunol,2011,32(9):395-401.
[3]Aranami T,Yamamura T.Th17 cells and autoimmune encephalomyelitis (EAE/MS)[J].Allergology International,2008,57(2):115-120
[4]Gaffen SL.An overview of IL-17 function and signaling[J].Cytokine,2008,43(3):402-407.
[5]Kleinewietfeld M,Hafle D.Regulatory T cells in autoimmune neuroinflammation[J].Immunol Rev,2014,259(1):231-244.
[6]Haque M,Fino K,Lei F,et al.Utilizing regulatory T cells against rheumatoid arthritis[J].Front Oncol,2014,4:209.
[7]Seo I,Lee H,Shin Y,et al.Janus Kinase 2 inhibitor AG490 inhibits the STAT3 signaling pathway by suppressing protein translation of gp130[J].Korean J Physiol Pharmacol,2009,13(2):131-138.
[8]Poussin K,Pilati C,Couchy G,et al.Biochemical and functional analyses of gp130 mutants unveil JAK1 as a novel therapeutic target in human inflammatory hepatocellular adenoma[J].Oncoimmunology,2013,2(12):e27090.
[9]Hossain DM,Panda AK,Chakrabarty S,et al.MEK inhibition prevents tumor-shed TGFbeta-induced T-regulatory cell augmentation in tumor milieu[J].Immunology,2015,144(4):561-573.
[10]Dominitzki S,Fantini MC,Neufert C,et al.Cutting edge:trans-signaling via the soluble IL-6R abrogates the induction of foxp3 in naive CD4+CD25-T cells[J].J Immunology,2007,179(4):2041-2045.
[11]Pang N,Zhang F,Ma X,et al.TGF-beta/smad signaling pathway regulates Th17/Treg balance during echinococcus multilocularis infection[J].Int Immunopharmacol,2014,20(1):248-257.
[12]Raphael I,Nalawade S,Eagar TN,et al.T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J].Cytokine,2015,74(1):5-17.
[13]Yoshimura A,Yasukawa H.JAK's SOCS:a mechanism of inhibition[J].Immunity,2012,36(2):157-159.
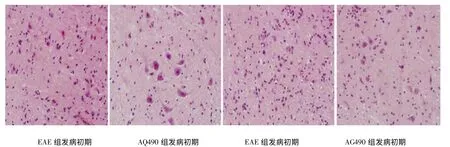
图1 各组小鼠不同发病时期脊髓HE 染色(HE,×400)

