槲皮苷对过氧化氢诱导PC12 细胞损伤的保护作用
江 芮,吕 浩,李 申,王丽莉
随着老龄化的发展,阿尔茨海默病(Alzheimer's disease,AD)已成为继心脑血管、肿瘤之后又一危害老年人健康的疾病,表现为退行性的神经系统病变[1]。在AD 众多的发病机制假说中,氧化应激假说越来越引起关注[2]。PC12 细胞株源于大鼠肾上腺嗜铬细胞瘤,它在形态,结构和功能上与神经细胞有许多相似之处,被广泛用于神经药理学方面的研究[3],H2O2诱导PC12 细胞损伤是经典的细胞氧化损伤模型,由活性氧(ROS)介导的氧化应激损伤在神经退行性疾病中起了至关重要的作用[4],H2O2是体内代谢产生的一种ROS,可以透过细胞膜,能够与多种生物靶标分子反应。
近年来,从天然产物中寻找具有清除自由基活性的物质用于保护细胞免受氧化损伤备受关注。黄酮类化合物可以对神经元发挥类似神经营养因子的保护作用[5]。槲皮苷(Quercitrin)是一种广泛存在于中草药和蔬果中的天然黄酮类化合物,研究证明其具有抗氧化、抗癌、抗病毒等作用[6]。本研究利用H2O2诱导类神经细胞系PC12 凋亡建立模型,检测槲皮苷对PC12 细胞的保护作用并初步分析其作用机制,为其在神经退行性疾病治疗上提供可行性的基础。
1 材料和方法
1.1 材料 槲皮苷购于阿拉丁试剂有限公司,纯度≥98%,DMSO 购于上海生物工程有限公司,DMEM 培养基、胰蛋白酶购于美国Gibco 公司,胎牛血清购于杭州四季青生物工程有限公司,MTT、DAPI购于Sigma 公司,H2O2(30%,AR 级)购于国药集团化学试剂有限公司。乳酸脱氢酶试剂盒购于南京建成生物工程研究所,Cytc 和caspase-3 一抗、HRP 标记二抗购于武汉三鹰生物技术有限公司,大鼠肾上腺嗜铬瘤细胞(PC12 细胞)购于中国科学院上海细胞所。
1.2 仪器 倒置显微镜(OLYMPUS);多功能酶标仪(Thermo,美国);美国UVP 凝胶成像系统(UVP,美国);荧光显微镜TE2000-U(Nikon,日本)。
1.3 方法
1.3.1 细胞培养 用含10% 小牛血清的DMEM 细胞培养液在37 ℃、5%CO2的培养箱内培养PC12 细胞,每隔48 h 换液。用0.25%胰蛋白酶进行消化。
1.3.2 H2O2诱导PC12 细胞损伤模型的建立PC12 细胞消化、计数,以8×104个/ml (100 μl)细胞接种于96 孔板中,在37 ℃、5%CO2的培养箱内培养24 h 后,弃培养基,用无血清培养基将H2O2分别配成0、100、200、400、800、1600 μmol/L 各浓度,分别加入96 孔板中,每孔100 μl,每组6 个复孔,分别作用2、4、6 h 后,弃掉上清,用PBS 洗涤3 次,每次200 μl。分别加入MTT(5 mg/ml)工作液100 μl,继续孵育4 h 后加入100 μl DMSO,微孔振荡器上震荡10 min,用酶标仪检测570 nm 下的吸光度值。
1.3.3 槲皮苷给药剂量筛选 槲皮苷用DMSO 溶解,配成终浓度为1600 mmol/L 的母液。为了检测槲皮苷对PC12 细胞的影响,收集对数生长期的PC12 细胞,将浓度为8 ×104个/ml (100 μl)细胞接种于96 孔板中,培养24 h 后,给予不同终浓度的槲皮苷(0、50、100、200、400、800、1600 μmol/L)分别预处理12 h 后,MTT 法检测细胞的生长存活率。
1.3.4 槲皮苷对H2O2损伤PC12 细胞活力的影响 为了检测槲皮苷对H2O2损伤PC12 细胞保护作用,实验方法分为5 组,空白对照组(Control):每孔加入100 μl 无血清培养液;模型组(Model):加入100 μl、400 μmol/L H2O2作用4 h;槲皮苷(Quercitrin)保护组:先用不同终浓度的槲皮苷100、200、400 μmol/L 分别预处理12 h 后,吸出药物,然后加入100 μl、400 μmol/L H2O2继续培养4 h 后,MTT法检测细胞的生长存活率。
1.3.5 LDH 释放量的检测 将PC12 细胞以2×105cells/well (2 ml)的密度接种于6 孔板,孵育培养24 h 后,按照参考文献[7]的方法,背景空白对照孔为无细胞的培养液,按照1.3.4 分为5 组处理细胞后,取各孔上清120 μl 于新的96 孔板中,再加入60 μl LDH 检测工作液,避光室温孵育30 min后,在490 nm 处测量吸光度值。
1.3.6 DAPI 荧光核染色分析 将PC12 细胞以2×105cells/well (2 ml)的密度接种于6 孔板,孵育培养24 h 后,按照1.3.4 分为5 组处理细胞后,用PBS 清洗3 遍后,加入1 μg/ml 的DAPI 溶液,37 ℃孵育5 min,PBS 清洗后用荧光显微镜进行拍照观察。
1.3.7 Western blotting 法检测蛋白表达水平按照1.3.4 分为5 组处理细胞后,0.25%胰酶消化,离心收集细胞500 g 离心10 min,以PBS 洗两次,细胞总蛋白提取用PIPA 细胞裂解液置冰浴裂解,14 000 × g 离心5 min,收集上清。经BCA 法进行蛋白定量后,取等量样品以12% SDS-PAGE 进行电泳。胞浆蛋白提取用胞浆蛋白提取试剂盒进行,细胞加入适量缓冲液A,涡旋震荡15 s,放置上10 min,加入总体积的1/20 体积的缓冲液B,快速震荡混匀,放置冰上1 min 后,16,000 g,4 ℃,离心30 s,收集上清至新的离心管中,即为胞浆蛋白。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1 h后,用Cytc、casepase-3 抗体(浓度1∶ 100)孵育过夜,再以辣根过氧化酶标记的二抗封闭液孵育1 h,用ECL 显影。以目标蛋白与内参的积分灰度值比值表示蛋白的相对表达量。
2 结果
2.1 H2O2诱导PC12 细胞损伤模型的建立MTT 实验结果显示,细胞抑制率随H2O2的浓度的升高和作用时间的延长而增加,当400 μmol/L H2O2作用4 h 时,其细胞抑制率达到50.8% (P <0.01)左右,作为最佳造模条件。
2.2 槲皮苷单独给药对PC12 细胞的影响药物剂量在400 μmol/L 以下的药物处理组与对照组相比差异没有显著性(P >0.05),表明对细胞没有损伤作用;而当药物剂量大于800 μmol/L 时,药物处理组与对照组相比差异具有显著性(P <0.01),表明此时的药物浓度对细胞有损伤作用。因此,选择100、200、400 μmol/L 作为合适的给药浓度。
2.3 槲皮苷对H2O2损伤PC12 细胞活力的影响 槲皮苷预孵育12 h 后,加入400 μmol/L H2O2作用4 h,细胞活力检测结果显示,与对照组相比,模型组细胞活力明显降低(P <0.01);与模型组相比,槲皮苷保护组细胞活力明显提高(P <0.01),且呈剂量依赖性(见图1)。
2.4 槲皮苷对H2O2损伤PC12 细胞LDH 释放量的影响 实验以LDH 释放量作为PC12 细胞损伤程度检测指标,与正常组比较,H2O2诱导后PC12的LDH 释放量明显升高(P <0.01),而预防应用槲皮苷能够显著降低LDH 释放量(P <0.01)(见图2)。
2.5 槲皮苷对H2O2损伤PC12 细胞凋亡形态学的影响 空白对照组细胞的细胞核呈均匀的淡蓝色,模型组细胞呈现强烈的蓝色荧光,提示细胞的细胞核固缩或碎裂。而400 μmol/L槲皮苷预处理组细胞蓝色荧光明显弱于模型组。
2.6 槲皮苷对H2O2损伤PC12 细胞中相关凋亡蛋白表达的影响 Western blot 结果显示,与对照组相比,模型组细胞胞浆中Cytc 和细胞内caspase-3蛋白表达水平明显升高(P <0.01);与模型组相比,槲皮苷预孵育组(100、200、400 μmol/L)细胞胞浆中Cytc 和细胞内caspase-3 蛋白表达水平均有不同程度的降低,且具有剂量依赖性(见图3)。
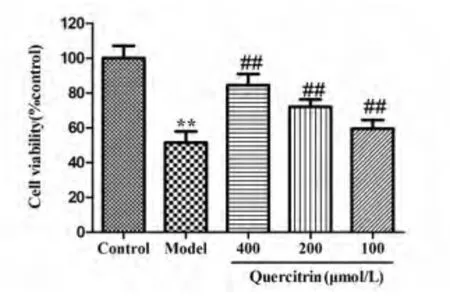
图1 槲皮苷对H2O2损伤PC12 细胞保护作用

图2 槲皮苷对H2O2损伤PC12 细胞LDH 释放量的影响
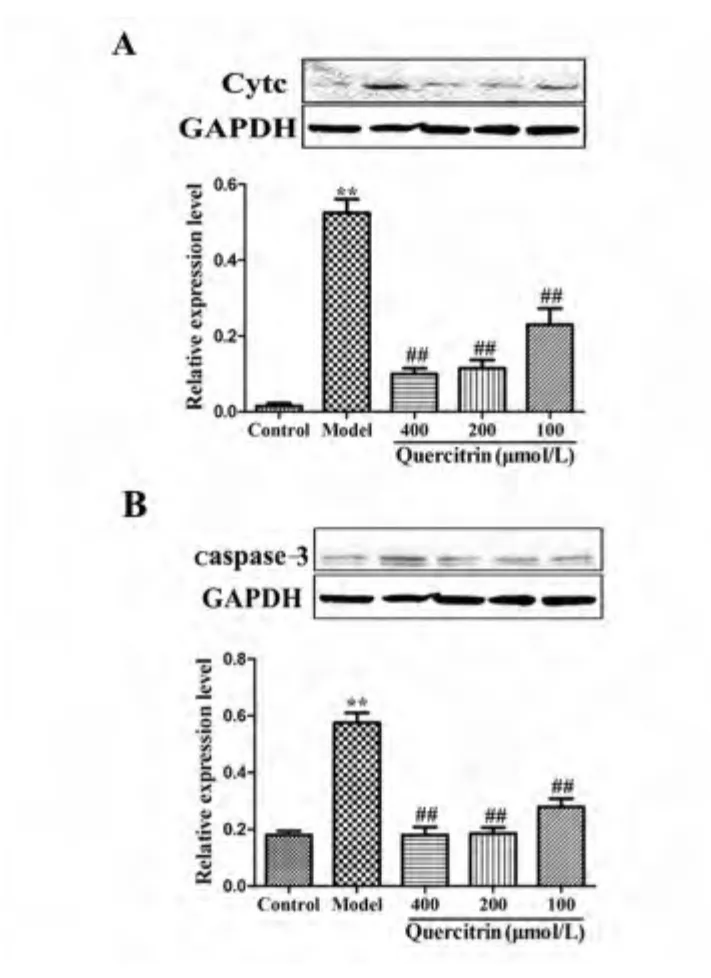
图3 槲皮苷对H2O2损伤PC12 细胞中相关凋亡蛋白表达的影响
3 讨论
本研究为了探讨槲皮苷对H2O2诱导的PC12 细胞损伤的保护作用和机制,首先采用MTT 法对H2O2诱导的PC12 细胞损伤浓度和时间进行检测。实验结果表明400 μmol/L H2O2作用细胞4 h 后,细胞活力抑制率为50.8%,该浓度下细胞有一定比例凋亡,但又不至于大量死亡,所以本研究选用400 μmol/L H2O2造模。MTT 法确定了3 个无毒剂量:100、200、400 μmol/L后对槲皮苷进行保护作用和机制的研究。
LDH 是细胞内标志酶,受损的细胞膜通透性发生改变,LDH 漏出量明显增大,其累计释放量与细胞受损的程度呈正相关[8],细胞损伤时LDH 会释放入培养液中,故其上清液中LDH 的浓度可反映出细胞的损伤程度,与正常对照组相比,H2O2能造成培养液中LDH 显著提高,100~400 μmol/L 槲皮苷能显著降低H2O2诱导的LDH 的释放。
DAPI 荧光核染色结果表明槲皮苷能够减轻由H2O2诱导的PC12 细胞凋亡。细胞内线粒体的双层膜受到破坏后会形成穿膜孔道,通透性增加,促进Cytc 的释放,胞浆中Cytc 含量也是指示细胞凋亡的重要指标[9]。实验发现,H2O2可导致PC12 细胞细胞胞浆中Cytc 和细胞内caspase-3 蛋白表达升高。提示H2O2可通过线粒体细胞色素C 介导的凋亡通路,启动caspase级联反应,导致细胞凋亡。caspase-3 的活化是凋亡进入不可逆阶段的标志,槲皮苷预孵育后可下调胞浆中Cytc 和细胞内caspase-3 蛋白表达,进而产生抗凋亡的作用。
综上所述,槲皮苷对H2O2诱导的PC12 细胞损伤具有一定的保护作用,可以提高H2O2损伤人PC12 细胞的存活率,降低LDH 释放量,下调胞浆中Cytc 和细胞内caspase-3 蛋白表达。提示槲皮苷可保护和修复过氧化H2O2诱导的PC12 细胞的损伤,其机制可能与抑制细胞凋亡线粒体途径中凋亡相关蛋白Cytc 和caspase-3 的表达有关。
[1]柳 星,汪萌芽.天麻素对海马内Aβ1-40 注射阿尔茨海默病模型大鼠学习记忆的改善作用[J].中国临床药理学与治疗学,2012,17(4):408-411.
[2]傅 皴,肖世富.氧化应激与阿尔茨海默病的神经病理机制研究进展[J].中华临床医师杂志,2010,4(9):1646-1648.
[3]张秋芳,汪选斌,戢艳琼,等.二氢石蒜碱对过氧化氢损伤的PC12细胞的保护作用[J].中国新药杂志,2012,21(11):1288-1291.
[4]Frledlander RM.Apoptosis and caspases in neurodegenerative diseases[J].New Engl J Med,2003,348:1365-1375.
[5]Hirpara KV,Aggarwal P,Mukherjee AJ,et al.Quercetin and its derivatives:sythesis,pharmacologacal uses with special emphasis on anti-tumor properties and prodrug with enhanced bioavailability[J].Anticancer Agents Med Chern,9(2):138-161.
[6]朱学鑫,蒋福升,丁志山一.槲皮苷生物活性研究进展[J].蛇志,2012,24(1):47-50.
[7]Cao BY,Yang YP,Luo WF.Paconiflorin,apotent natural compound,protects PC12 ceils from MPP+and acidic damage via autophagic pathway[J].J Ethnopharmacol,2010,131:122-129.
[8]王 斌,王学美.加味五子衍宗方及其有效部位对H2O2损伤PC12细胞的保护作用[J].中国实验方剂学杂志,2009,15(8):57-60.
[9]Yi S,Tsao MS.Activation of hepatocyte growth factor-met autocrine loop enhances tumorigenicity in a human lung adenocarcinoma cell line[J].Neoplasia,2000,2(3):226-234.

