二十二碳六烯酸预处理增强大鼠脑胶质细胞对氧糖剥夺条件下脑血管内皮细胞的保护作用
陈小波,占乐云,王 强,舒爱华,张明瑜,邓彩英
神经科学的研究表明,神经元细胞、胶质细胞和血管内皮细胞共同组成了一个完整的神经功能单元,它们之间相互的信号联系与血脑屏障功能的完整密切相关[1,2]。研究证实,胶质细胞和管周细胞等以旁分泌作用的方式分泌血管生成素1(Ang1),并激活血管内皮细胞Tie2 受体、调控其下游的抗凋亡等信号通路[3]。在我们前期的研究中发现,DHA预处理能够明显上调胶质细胞在氧糖剥夺环境下Ang1 的分泌。由于DHA 能够经多靶调节机制发挥脑保护作用,因此初步推测DHA 可能通过上调缺血环境下胶质细胞Ang1 的分泌水平,产生对血管内皮细胞的保护作用,并维持血脑屏障的完整性。我们希望为进一步探讨DHA 的脑保护作用机制提供实验参考。
1 材料和方法
1.1 主要试剂和仪器 Nu47-E 可调氧浓度孵箱(Nuaire,美国)、流式细胞仪(BD Biosciences)、TCSSP5 激光共聚焦显微镜(Leica,德国)。兔抗大鼠vWF 多克隆抗体(Chemicon,美国);Bax、bcl-2(cell signaling);capase-3 (Santa Cruz 公司);ZO-1、HRP 标记羊抗小鼠二抗、HRP 标记羊抗兔二抗、HRP 标记兔抗羊二抗(武汉博士德生物工程有限司);P-tie2(MILYPORE);显影定影试剂盒(武汉巴菲尔生物);细胞凋亡检测试剂盒(南京凯基生物)。
1.2 脑星形胶质细胞和BMECs 的分离与培养取2~3 w SD 大鼠,雌雄均可,体重40~60 g (华中科技大学实验动物中心),按照文献中描述的方法分别分离、培养和纯化脑星形胶质细胞和BMVECs。第3 代细胞95%以上为BMECs,用于实验。
1.3 氧糖剥夺模型(OGD)的建立 将原代培养的两种细胞在5% CO2条件下培养24 h 使细胞同步化。然后用无糖、无血清的DMEM 液置换原培液,再经94% N2∶ 5% CO2∶ 1% O2低氧条件下培养24 h。
1.4 脑星形胶质细胞培养的上清液 脑胶质细胞随机分为正常对照组(Ⅰ)、OGD 组(Ⅱ)、10 μmol DHA 预处理组(Ⅲ)、40 μmol DHA 预处理组(Ⅳ)。在正常对照组加入含血清和葡萄糖的DMEM,OGD 组和DHA 预处理组为无糖、无血清的DMEM。DHA 组另加入两种浓度的DHA 后在5%CO2和95%空气条件预处理培养1 h。除正常对照组在5% CO2和95%空气条件下培养外,其余组94% N2∶ 5%CO2∶ 1% O2条件下培养,所有组培养时间为24 h。收集各组培养后的上清液。
1.5 BMECs 和脑星形胶质细胞培养的上清液共培养 将血管内皮细胞随机分为正常对照+培养上清液Ⅰ(A 组)、OGD+培养上清液Ⅱ(B 组)、OGD+培养上清液Ⅲ(C 组)、OGD +培养上清液Ⅳ(D 组)、OGD+sTie2Fc+培养上清液Ⅲ(E 组)、OGD+sTie2Fc+培养上清液Ⅳ(F 组),每组设3 个复孔。各组先培养24 h 使细胞同步化。然后置换原培养液:在A 组加入2/3 量的含血清、和葡萄糖DMEM 和1/3 量的培养上清液Ⅰ;B 组加入2/3 量的无糖、无血清的DMEM 和1/3 量的培养上清液Ⅱ;C 组加入2/3 量的无糖、无血清的DMEM 和1/3量的培养上清液Ⅲ;D 组加入2/3 量的无糖、无血清的DMEM 和1/3 量的培养上清液Ⅳ;E 组加入2/3量的无糖、无血清的DMEM 和1/3 量的培养上清液Ⅲ及10 μg/ml sTie2Fc;F 组组加入2/3 量的无糖、无血清的DMEM 和1/3 量的培养上清液Ⅳ及10 μg/ml sTie2Fc。除正常对照组在5%CO2和95%空气条件下培养外,其余组94%N2∶ 5%CO2∶ 1%O2培养,培养时间均为24 h。
1.6 细胞凋亡实验 用不含EDTA 的0.25%胰酶消化细胞,终止消化后收集,1500 rpm,5 min 离心,去上清,加PBS 重悬;用PBS 将细胞润洗两次,1500 rpm,5 min,按照AnnexinV&PI 细胞凋亡检测试剂盒操作说明进行:各样品分别加入500 μl Binding Buffer,5 μl AnnexinV,5 μl PI,混匀,室温避光反应5~15 min(同时设阴性对照,即正常细胞不加AnnexinV 和PI;阳性对照1,以凋亡效果最明显的溶剂组作为阳性对照,只加5 μl AnnexinV 单标;阳性对照2,以凋亡效果最明显的溶剂组作为阳性对照,只加5 μl PI 单标)流式细胞仪上机检测以上实验均重复3 次并进行统计学分析。
1.7 Western blotting 法 检 测 Bax、bcl-2、caspase-3 等总蛋白 取适量RIPA 裂解液裂解细胞,测蛋白浓度后,各样品取50 μg 总蛋白上样电泳,根据蛋白分子量配制8%的PAGE 胶电泳。根据预染Marker 显示,判断目的蛋白得到充分分离后,停止电泳。取出凝胶根据Marker 切下目的条带,用蒸馏水冲洗,剪与PAGE 凝胶相同大小的PVDF 膜和滤纸,PVDF 膜用甲醇浸泡数秒后和滤纸一同浸泡于电转缓冲液中。用含5% 脱脂奶粉的TBST(封闭液)浸泡PVDF 膜,室温摇床封闭2 h。TBST 充分洗涤PVDF 膜5~6 次,5 min/次。用封闭液稀释相应的HRP 标记二抗-1 ∶ 50000 稀释,使PVDF 膜浸泡于二抗孵育液中,室温摇床孵育2 h。TBST 充分洗涤PVDF 膜5~6 次,5 min/次。每张膜滴加适量的ECL 底物液,孵育数分钟。待荧光带明显后,用滤纸吸去多余的底物液,覆上保鲜膜,X 光胶片压片后依次放入显影液显影、定影液定影。实验重复3 次,用Band Scan 分析胶片目的蛋白和内参照条带的灰度值,将目的条带的灰度值与同一样本内参照的灰度值相比,得出目的蛋白的相对表达量。
1.8 统计学处理 采用SPSS 13.0 软件分析。计量资料以均数±标准差()表示,组间比较采用单因素方差分析和SNK,P <0.05 为差异有统计学意义。
2 结果
2.1 胶质细胞培养24 h 后的上清液Ang1 含量 与正常对照组比较(1279.33 ±16.27)pg/ml,OGD 组Ang1 分泌量明显降低(1073.67 ±24.55)pg/ml (P <0.01),OGD+40 μmol DHA 组有明显增加(1758.01 ±33.18)pg/ml (P <0.01),但OGD +10 μmol DHA 组Ang1 分泌量无差异(1363.33.01 ±28.94)pg/ml P >0.05);与OGD 组比较,OGD +10 μmol DHA 组 和OGD+40 μmol DHA 组Ang1 分泌量均明显增加(P <0.01);与OGD +10 μmol DHA组比较,OGD +40 μ mol DHA 组有明显差异(P <0.01)。
2.2 脑血管内皮细胞凋亡的影响 与A 组比较,其余各组脑血管内皮细胞凋亡均明显增加(P <0.01);与B 组比较,C 和D 两组细胞凋亡明显降低(P >0.01),与B 组比较,E 组和F 组细胞凋亡也有明显差异(P <0.01);但与C 组比较,E 组细胞凋亡明显增加(P <0.01);与D 组比较,F 组细胞凋亡明显增加(P >0.01)(见图1)。
2.3 Bax、bcl-2、caspase-3 等蛋白表达 Western blotting 结果显示,各组之间内参蛋白β-actin 表达无差异(P >0.05);与A 组比较,其余各组Bax、caspase-3 表达明显增加(P <0.01),bcl-2、bcl-2/Bax、pTie-2、pAkt、ZO-1 表达明显降低(P <0.01);与B 组比较,C 和D 两组细胞Bax、caspase-3 表达明显降低(P <0.01),bcl-2、bcl-2/Bax、pTie-2、pAkt、ZO-1 表达明显增加(P <0.01);与B 组比较,E 组和F 组Bax、caspase-3 有明显降低(P <0.01),bcl-2、bcl-2/Bax、pTie-2、pAkt、ZO-1 表达明显增加(P <0.01);与C 组比较,E 组细胞Bax、caspase-3 表达明显增加(P <0.01),bcl-2、bcl-2/Bax、pTie-2、pAkt、ZO-1 表达明显降低(P <0.01);与D 组比较,F 组细胞组Bax、caspase-3、bcl-2、bcl-2/Bax、pTie-2、pAkt、ZO-1 表达均有明显降低(P <0.01)(见表1、表2)。
2.4 Western blotting 化学发光免疫印迹图各组Bax、bcl-2、caspase-3 和β-actin 等蛋白Western blotting 化学发光免疫印迹图(见图2)。
表1 Western blotting 检测caspase-3、bax、bcl-2、bcl-2/bax 的表达(n=3,)

表1 Western blotting 检测caspase-3、bax、bcl-2、bcl-2/bax 的表达(n=3,)
与A 组比较* P <0.01;与B 组比较#P <0.01;与C 组比较△P <0.01;与D 组比较▽P <0.01
表2 Western blotting 检测p-tie2、P-Akt-2、ZO-1的表达(n=3,)

表2 Western blotting 检测p-tie2、P-Akt-2、ZO-1的表达(n=3,)
与A 组比较* P <0.01;与B 组比较#P <0.01;与C 组比较△P<0.01;与D 组比较▽P <0.01
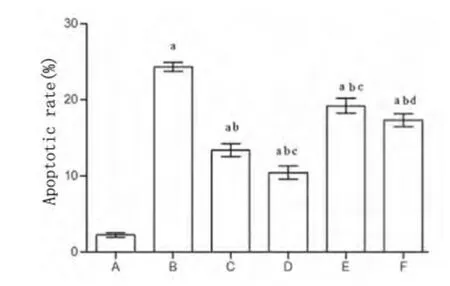

图1 脑血管胶质细胞凋亡流式分析结果
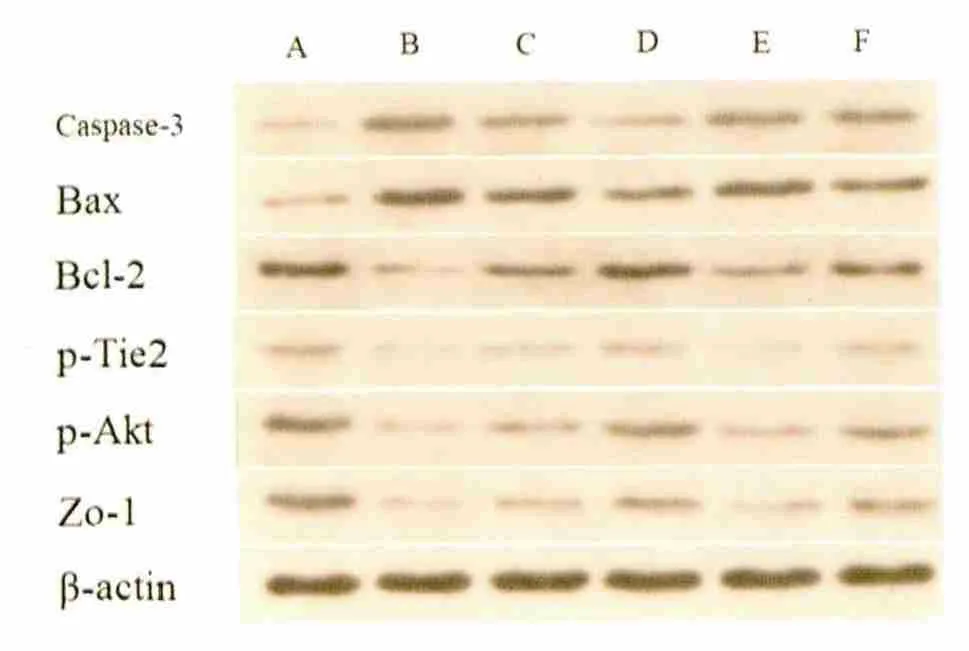
图2 A 组:正常对照+培养上清液Ⅰ;B 组:OGD+培养上清液Ⅱ;C 组:OGD+培养上清液Ⅲ;D 组:OGD+培养上清液Ⅳ;E 组:OGD+培养上清液Ⅲ+sTie2Fc;F 组:OGD+培养上清液Ⅳ+sTie2Fc
3 讨论
我们的研究结论表明:经DHA 预处理后的胶质细胞,并在体外模拟缺血/缺氧环境下培养24 h 后,其上清液中Ang1 的含量明显增加。当将其上清液加入到同样缺氧环境下培养的脑血管内皮细胞中,后者的凋亡出现明显降低。已有其它研究证实,低氧条件下培养的脑星形胶质细胞能够分泌GDNF 与TGF-β1[4],对同样缺氧环境下培养的脑神经元细胞等产生保护作用,但是Ang1 并不参与这种保护作用机制[5]。其原因可能是在低氧环境下星形胶质细胞Ang1 mRNA 和Ang1 分泌水平发生明显下降[6]。在本实验中也同样发现,未经DHA 预处理的胶质细胞Ang1 分泌水平与正常氧含量条件下比较有明显降低。Ang1 是Tie-2 的配体,Tie-2 激活后经PI3/Akt信号通路发挥抗凋亡作用[7]。表现为促凋亡蛋白Bax 等水平下降,而抗凋亡蛋白bcl-2 生成增加[8]。在研究中发现,经DHA 预处理的胶质细胞在低氧环境下培养上清液,使血管内皮细胞Tie-2 受体的磷酸化水平及其下有信号通路PI3/Akt 激活水平明显增加。当加入抑制剂(sTie2Fc)后,细胞凋亡和Bax 水平明显增加,而抗凋亡蛋白bcl-2 生成明显降低。这些结果进一步说明,其保护机制可能与Ang1 激活Tie-2 明显相关。
研究结果还表明:经DHA 预处理的胶质细胞在缺氧环境下培养后的上清液,能够使血管内皮细胞ZO-1 蛋白表达增加。ZO-1 蛋白对于维持血脑屏障的完整性具有重要的作用[9,10]。当加入抑制剂后,与相应未加抑制剂组比较,ZO-1 蛋白的表达明显下降。但研究结果还发现,加入抑制剂并不能完全消除使ZO-1 蛋白的表达上调的作用,这些研究说明上调ZO-1 蛋白表达的机制,可能大部分作用与Ang1激活Tie-2 受体相关,同时也可能还有其它作用机制参与。
综上所述,DHA 预处理后的星形胶质细胞能够增强对氧糖剥夺环境下大鼠脑微血管内皮细胞的保护作用,其机制可能与上调Ang1 的表达,激活Tie-2受体后,经PI3/Akt 等下游信号通路作用相关。
[1]Chu LF,Wang WT,Ghanta VK,et al.Ischemic brain cell-derived conditioned medium protects astrocytes against ischemia through GDNF/ERK/NF-κB signaling pathway[J].Brain Res,2008,1239:24-35.
[2]Lin CH,Cheng FC,Lu YZ,et al.Protection of ischemic brain cells is dependent on astrocyte-derived growth factors and their receptors[J].Experimental Neurology,2006,201(1):225-233.
[3]Hori S,Ohtsuki S,Hosoya K,et al.A pericyte-derived angiopoietin-1 multimeric complex induces occludin gene expression in brain capillary endothelial cells through Tie-2 activation in vitro[J].J Neurochemistry,2004,89(2):503-513.
[4]Redzic ZB,Rabie T,Sutherland BA,et al.Differential effects of paracrine factors on the survival of cells of the neurovascular unit during oxygen glucose deprivation[J].Int J Stroke,2013.
[5]Wang HJ,Cao JP,Yu JK,et al.Calbindin-D28K expression induced by glial cell line-derived neurotrophic factor in substantia nigra neurons dependent on PI3K/Akt/NF-kappaB signaling pathway[J].European J Pharmacology,2008,595(1/2/3):7-12.
[6]Redzic ZB,Rabie T,Sutherland BA,et al.Differential effects of paracrine factors on the survival of cells of the neurovascular unit during oxygen glucose deprivation[J].Int J Stroke,2015,10(3):407-414.
[7]Valable S,Bellail A,Lesne S,et al.Angiopoietin-1-induced PI3-kinase activation prevents neuronal apoptosis[J].FASEB Journal:official Publication of the Federation of American Societies for Experimental Biology,2003,17(3):443-445.
[8]Zhang ZG,Zhang L,Croll SD,et al.Angiopoietin-1 reduces cerebral blood vessel leakage and ischemic lesion volume after focal cerebral embolic ischemia in mice[J].Neuroscience,2002,113(3):683-687.
[9]Xia YP,He QW,Li YN,et al.Recombinant human sonic hedgehog protein regulates the expression of ZO-1 and occludin by activating angiopoietin-1 in stroke damage[J].PloS one,2013,8(7):e68891.
[10]Witt KA,Mark KS,Hom S,et al.Effects of hypoxia-reoxygenation on rat blood-brain barrier permeability and tight junctional protein expression[J].Am J Physiol Heart Circ Physiol,2003,285(6):2820-2831.

