黄花菜多糖的提取工艺及含量测定
武永福
(陇东学院农林科技学院,甘肃庆阳 745000)
通过水浴浸提法对黄花菜中的多糖物质进行提取,考察了提取温度、提取时间、料液比对多糖得率的影响,得出最佳提取工艺条件,用苯酚—硫酸法测定提取黄花菜的多糖,公式理论计算的多糖含量与提取的庆阳黄花菜多糖进行比较,求出用葡萄糖制作标准曲线时的换算因子,对传统的葡萄糖标准曲线法进行改进,从而使测定黄花菜中的多糖含量变得更为准确、方便[1-11]。
1 材料与方法
1.1 原料与试剂
黄花菜从甘肃省庆阳市购得。石油醚(天津富宇精细化工有限公司)、95%乙醇(西安三浦精细化工厂)、丙酮(西安化学试剂厂)、苯酚(天津红岩化学试剂厂)、浓硫酸(西安化学试剂厂)、葡萄糖(天津市新纯化学试剂研究所),以上试剂均为分析纯,实验室用水为一次蒸馏水。
1.2 仪器
7230 可见分光光度计(上海精密科学仪器厂)、数字式恒温水浴锅(金坛市富华仪器有限公司)、电热鼓风干燥箱(上海一恒科技有限公司)、电子天平(北京赛多利斯仪器系统有限公司)、离心机(上海安亭科学仪器总厂)、循环水式真空泵(巩义市予华仪器有限公司)、旋转蒸发仪(上海亚荣生化仪器厂)。
1.3 方法
1.3.1 多糖含量测定[2-11]
苯酚—硫酸试剂与游离寡糖、己糖、糖醛酸起显色反应,己糖在490nm 处,戊糖及糖醛酸在480nm 有最大吸收,在一定范围内,吸光度值与糖含量呈线性关系,因此根据吸光度值可确定样品多糖含量。
(1)5%苯酚液配制:称取苯酚12.5g,置于250mL容量瓶,用水稀释至刻度,摇匀,避光冷藏。
(2)标液配制:称取105℃干燥至恒重的葡萄糖标品20mg,定容至500mL。
(3)标准曲线绘制:取标液0、0.2、0.4、0.6、0.8、1.0mL,用水补至1.0mL,加5%苯酚0.6mL,再加浓硫酸3.6mL,混匀,沸水加热30min,冷后490nm测吸光度,绘制葡萄糖糖标准曲线。
(4)样品多糖含量测定:移取20mL 多糖提取液,定容至250mL,按改良苯酚—硫酸法测吸光度,用标准曲线计算样品多糖含量。
(5)计算公式如(1)式:
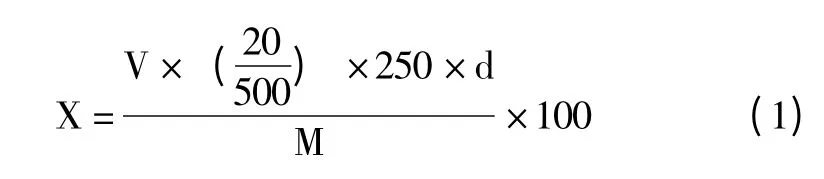
(1)式中,X 为样品多糖含量(%);V 为标准曲线上葡萄糖体积数(mL);d 为稀释倍数;M 为黄花菜样品质量(mg)。
1.4 水浴法浸提黄花菜多糖[12-20]
1.4.1 水浴浸提工艺
原料→清洗→热风烘干→磨碎过筛→石油醚脱脂→水浴浸提3 次→过滤→合并滤液→旋转蒸发→加乙醇→离心→收集沉淀→加水复溶→加乙醇→离心→沉淀用无水乙醇或丙酮洗涤3 次→水浴干燥得黄花菜多糖晶体→称重。
1.4.2 操作要点[12-21]
(1)热风烘干:用烘箱在60℃对洗净的黄花菜烘干,直至黄花菜质量不再减轻为止。(2)磨碎过筛:过筛目数过高,会给以后的抽滤带来困难。(3)石油醚脱脂:索氏抽提回流至石油醚提取液无色为止。(4)加乙醇:加浓缩液5 倍体积的95%乙醇,静置过夜。(5)离心:用3 500 r/min,离心20min,取其上清液。(6)洗涤烘干称重:沉淀洗涤后所得多糖晶体在60~70℃烘箱干至质量不变,称重。
1.4.3 水浴浸提工艺条件正交设计优化
影响多糖得率的因素很多,主要因素有:浸提温度(A)、浸提时间(B)和料液比(C),每因素取3 个水平,采用正交设计进行优化,详见三因素三水平正交试验表L9(33)。
1.4.4 换算因子的计算
将提出的黄花菜多糖进行准确称重,得到的重量与用苯酚—硫酸法测定出的多糖含量进行比较,计算出用葡萄糖标准曲线测定黄花菜多糖的换算因子。
计算公式如(2)式:
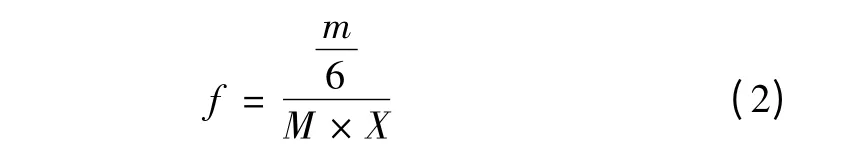
(2)式中,f:为换算因子;m 为提取出的黄花菜多糖质量(mg);M 为黄花菜样品的质量(mg);X 为样品中多糖的含量(%)[8-21]。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 料液比对样品多糖得率的影响
相同质量(5g)脱脂黄花菜,固定浸提温度60℃,浸提2h,浸提料液比分别取1∶10、1∶15、1∶20、1∶30,测其吸光度,结果见图1。
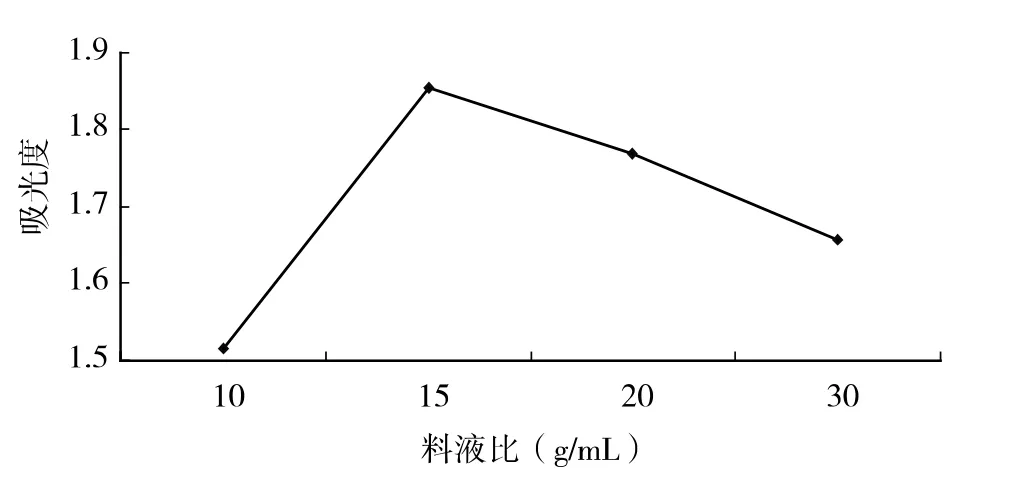
图1 液料比对黄花菜多糖得率的影响
由图1 可知,料液比低于1∶15 时提取率随料液比的增大而明显增加;当料液比大于1∶15 时提取率随着料液比的增大而稍减少。所以,本次试验选取1∶15 的料液比较为合适。
2.1.2 提取时间对黄花菜多糖得率的影响
分别取相同质量的黄花菜(5g),固定提取温度60℃、料液比为1∶15,浸提时间分别取2、4、6、8h,测其提取率,结果见图2。

图2 浸提时间对提取率得的影响
由图2 可以看出,时间在2~4h 内,黄花菜多糖提取率增长较快;在4~8h 内,提取率人有提高,但增幅较小,提高并不显著,从生产成本上考虑,选取6h 的提取时间较为合理。
2.1.3 提取温度对黄花菜多糖提取率的影响
分别取相同质量的黄花菜(5g),固定提取时间4h、料液比1∶15,浸提温度分别为60、70、80、90℃,测其提取率,其结果见图3。
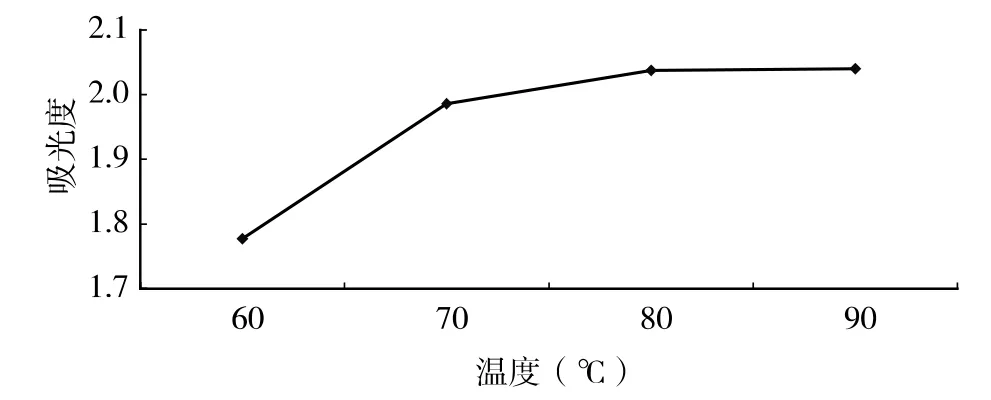
图3 浸提温度对多糖得率的影响
由图3 可知,在70~90℃间,提取率随浸提温度升高而增加,但提取率增加不显著,从生产成本角度考虑,浸提温度80℃较合理。
2.2 热水提取最佳工艺条件确定
正交设计因素水平见表4。
表4 正交设计因素水平
由正交设计试验结果可知,影响多糖得率的诸因素的主次关系依次是提取温度(A)、提取时间(B)、料液比(C)。最佳组合为A3B3C3,即提取温度80℃、浸提时间6h、料液比1∶15 时,提取的黄花菜多糖液的吸光度为2.566 (表5)。
2.3 用苯酚一硫酸法测定黄花菜多糖含量
由表6 可得,回归方程为:y=0.468x +0.083 5,R2=0.999 8。

表5 正交设计试验结果

表6 葡萄糖标准溶液浓度与吸光度的关系
根据正交试验结果,将采用最佳工艺条件A3B3C3提取的多糖滤液,采用苯酚—硫酸法测定其在490nm 处的吸光度,其吸光度为0.586,根据公式计算出黄花菜多糖的含量。
2.4 黄花菜多糖的提取
精确称取30g 黄花菜粉末,根据正交试验结果,确定提取温度为80℃、提取料液比为1∶15、提取时间6h。然后抽滤提取液,旋转蒸发浓缩,加约5 倍体积95%乙醇,静置过夜,沉淀过滤后60℃干燥,直到恒重为止,取出准确称重。
2.5 换算因子的计算
将提出的黄花菜多糖进行准确称重,得到3.3760g的黄花菜多糖,根据公式计算出换算因子为4.2。
3 结论
本试验中采取热水提取法对黄花菜多糖进行提取,通过单因素和正交试验找出了热水提取法在80℃,料液比为1∶15、浸提时间6h 时,浸提率最高。在此条件下求得黄花菜多糖含量为2.68%,并求得的苯酚硫酸法测定黄花菜多糖的换算因子为4.2。
[1]王雪艳.龙眼多糖的提取纯化及其抗氧化活性研究[D].厦门:集美大学,2009.
[2]李艳红.山楂多糖的提取、分离纯化及结构研究[D].太原:山西大学,2006.
[3]李粉玲,蔡汉权,林泽平.红豆多糖抗氧化性及还原能力的研究[J].食品工业,2014,2:190-194.
[4]谢红旗.香菇多糖提取、纯化、结构表征及生物活性的研究[D].长沙:中南大学,2007.
[5]何雯娟.黄苓多糖的提取及其对肉仔鸡营养物质消化率、生长性能和免疫指标的影响[D].哈尔滨:黑龙江八一农垦大学,2009.
[6]赵凤春.黄芪多糖的提取及分离纯化的研究[D].南宁:广西大学,2007.
[7]王国艺.滑菇W-01 胞外与胞内多糖的提取及其抗氧化活性[D].泰安:山东农业大学,2012.
[8]杨方美,王林,胡秋辉.鼠尾藻多糖的制备及其抗氧化活性[J].食品科学,2005,2:224-227.
[9]杨超惠.桦褐孔菌多糖的提取及功能的初步研究[D].天津:天津科技大学,2007.
[10]葛玉,段玉峰,刘俊花,等.酸浆果多糖不同提取工艺研究[J].食品科学,2006,8:65-67.
[11]黄琼,林翠梧,韦藤幼,等.内部汽化法提取牡荆总黄酮的工艺研究[J].广东化工,2008,2:5-9.
[12]王明艳,杨凡,李燕,等.响应面法优化百部多糖提取条件研究[J].食品科学,2013,15(3):80-83.
[13]毛英丽,王忠民.葡萄多糖的提取纯化及抗氧化性研究[D].乌鲁木齐:新疆农业大学,2013:15-22.
[14]苏钰琦,马惠玲.苹果多糖的分离纯化与抗氧化活性深入研究[D].杨凌:西北农林科技大学,2013:23-29.
[15]郝杰,查学强,鲍素华,等.霍山石角豆不同分子量多糖体外抗氧化性研究[J].食品科学,2013,1(8):94-98.
[16]谢佳,柳红.张静.南瓜多糖的修饰结构分析及抗氧化活性的研究[J].食品工业科技,2012,10:35-41.
[17]杨翠娴,李清彪.龙眼多糖的提取分离纯化及初步结构分析[D].厦门:厦门大学,2012:25-31.
[18]邹佳,郁建平,胡美忠.草珊瑚水溶性黄花菜粗多糖提取及抗氧化性能研究[J].食品科学,2013,28(11):283-286.
[19]黄琼.牡荆挥发油和黄酮提取工艺及其生理活性研究[D].南宁:广西大学硕士论文,2006.
[20]杨宇博,夏红梅,袁恒翼.植物多糖及其提取方法[J].中国甜菜糖业,20138,2:34-37.
[21]李小平.红枣多糖提取工艺研究及其生物功能初探[D].西安:陕西师范大学,2011:19-20.

