鸡毒支原体SYBR Green I荧光定量PCR检测方法的建立
孙俊颖,刘志成,孙敏华,李冰玲,沈海燕,张春红,董嘉文,李林林,张建峰*
(1.广东省农业科学院动物卫生研究所,广东广州 510640;2.广东省畜禽疫病防治研究重点实验室,广东广州 510640;3.广东省兽医公共卫生公共实验室,广东广州 510640;4.北京出入境检验检疫局,北京 100026)
鸡毒支原体(Mycoplasma gallisepticum,MG)是柔膜体纲,支原体目,支原体科的一类无细胞壁,能够自我复制的单细胞原核生物。基因组为双链环状DNA,仅0.9~1.2×106bp,G+C 含量低。MG 感染引起的禽慢性呼吸道病(Chronic respiratory disease,CRD)广泛分布所有养禽国家,在我国部分地区感染率高达75 %以上。该病可以通过水平和垂直方式传播,并可以引起继发感染,严重阻碍养禽业的健康发展。控制MG 感染的最根本有效方法是对感染鸡群进行净化,从根本上防止MG 的传播和流行。但由于经济原因,大多数鸡场仍采用疫苗防控[1]。因此,建立一种敏感性高、特异性强、快速有效的检测方法对鸡群的早期诊断和净化,以及对疫苗质量的监控和分子流行病学调查都具有重要意义。
目前MG 的检测常采用血清学方法,如ELISA、血清平板凝集(SPA)、血凝抑制试验(HI)作为鸡群筛查方法[2],采用病原分离培养和PCR 方法作为确证方法[3]。现有检测方法各有优点,但存在灵敏度低,存在交叉反应,培养周期长或样品易污染等方面不足。荧光定量PCR 方法采用荧光信号,极大提高检测的灵敏性,同时可以定量检测,并且能够避免常规PCR 电泳检测所带来的高污染率,成为病原检测的重要技术。本研究以MG 16S rDNA 基因为靶标,建立了MG 的荧光定量PCR 检测方法,显著提高了MG 检测的敏感性和特异性,为病原早期诊断和疫苗定量监测提供了有效手段。
1 材料和方法
1.1 菌株、病毒及临床样品 MG S6 株由中国农业大学兽医药理实验室惠赠;MG Ts-11 疫苗购自澳大利亚生物制品有限公司;MG 6/85 疫苗购自美国英特威公司;MG F36 疫苗购自广东永顺生物制药公司;鸡滑液支原体(M.synoviae,MS)、猪肺炎支原体(M.pneumonia of swine,MPs)、鸡传染性喉气管炎病毒(ALTV)、鸡传染性支气管炎病毒(IBV)、禽流感病毒(AIV)及鸡新城疫病毒(NDV)均由本实验室分离和保存;临床样品来源广东粤西地区4 市(湛江、茂名、阳江、云浮)鸡场疑似病料。
1.2 主要试剂 核酸抽提试剂盒、琼脂糖凝胶DNA 回收试剂盒和质粒抽提试剂盒均购自天根生化科技(北京)有限公司;pMD18-T 载体和SYBR Premix Ex Taq 均购自TaKaRa 公司。
1.3 引物设计与合成 对GenBank 中登录的不同国家和地区MG 16S rDNA 基因的序列进行比对,根据其保守区域设计一对特异性引物:5'-AGCTAA TCTGTAAAGTTGGTC-3'/5'-CGCTTCCTTGCGGTTA GCAAC-3',预期扩增片段大小为186 bp,引物由上海生工生物工程技术服务有限公司合成。
1.4 荧光定量PCR重组质粒标准品的制备 按照DNA 提取试剂盒说明提取MG S6 株DNA,以其为模板利用引物F/R 进行PCR 扩增,扩增产物经胶回收纯化后,克隆于pMD18-T 载体中构建重组质粒,测定其浓度并计算拷贝数[4]后作为荧光定量PCR 的标准标准品。
1.5 反应条件的优化及标准曲线的建立 应用矩阵法对荧光定量PCR 的引物浓度(0.1 μM、0.3 μM、0.5 μM、0.7 μM)、退火温度(51 ℃、53 ℃、55 ℃、57 ℃、59 ℃、61 ℃、63 ℃)等进行优化,以得到最佳反应条件。
将重组质粒标准品10 倍梯度稀释至浓度范围为1.96×108拷贝/μL~1.96×102拷贝/μL。以各浓度梯度的质粒DNA 为模板,采用建立的荧光定量PCR进行扩增,绘制动力学曲线,并通过仪器软件自动生成标准曲线。
1.6 特异性试验 以MG S6、MG Ts-11、MS、MPs、ALTV、NDV、AIV、IBV 的DNA 为模板进行荧光定量PCR 反应,以验证该方法的特异性。
1.7 敏感性试验 将重组质粒标准品10 倍梯度稀释至1.96×101拷贝/μL,以每个稀释度的标准品为模板,进行荧光定量PCR 扩增,以确定最低检测限。判定标准为Ct 值在35 个循环以内的判定为阳性扩增,Ct 值高于35 个循环的判定为阴性扩增,同时进行普通PCR 扩增作为对照,比较两者敏感性。
1.8 重复性试验 选取1.96×106拷贝/μL、1.96×104拷贝/μL、1.96×102拷贝/μL 3 个稀释度标准品作为模板进行批内和批间重复性试验。每个稀释度重复检测3 次。根据循环阈值的差异计算批内和批间变异系数。
1.9 临床样本和疫苗检测 采集30 份来自广东不同地区的疑似鸡慢性呼吸道病病料样本,提取核酸,分别进行荧光定量PCR、常规PCR 和SPA 检测,以比较3 种方法的灵敏度。将活疫苗用PBS 溶液溶解,取1 头份量稀释100 倍后,提取DNA,进行荧光定量PCR 试验,检测疫苗中病毒的含量。并对检测为阳性的样品进行测序验证。
2 结果
2.1 重组质粒标准品的制备 重组质粒经PCR 鉴定和测序显示,PCR 产物约为186 bp,表明16S rDNA 片段已克隆至pMD18-T 载体中。重组质粒标准品浓度为62 ng/μL,根据公式计算分子拷贝数为1.96×1010拷贝/μL。
2.2 荧光定量PCR反应条件的优化 优化荧光定量PCR 反应体系为10 μL,其中SYBR Premix Ex Taq 5 μL,上下游引物(10 μM)各0.3 μL,模板1 μL,补加双蒸水至10 μL。优化荧光定量PCR 反应参数:95 ℃30 s;95 ℃5 s、55 ℃30 s、72 ℃30 s,在72 ℃采集荧光,共进行40 个循环;HRM 65 ℃~90 ℃。
2.3 荧光定量PCR标准曲线的建立 将重组质粒标准品10 倍倍比稀释后作为模板,采用优化的荧光定量PCR 条件进行扩增,以重组质粒拷贝数的常用对数值(lg copies)为x 轴,Ct 值为y 轴,得到标准曲线图(图1),标准曲线方程为y=-3.24x+35.47,相关系数R2=0.999,结果呈良好线性关系。熔解曲线分析表明,其熔解温度为85 ℃~86 ℃,扩增的目的片段仅产生特异性单峰,无引物二聚体和非特异性扩增。
2.4 特异性试验 采用建立的荧光定量PCR 方法检测MG S6、MG Ts-11、MS、MPs、NDV、ILTV、AIV、IBV,结果显示仅MG 出现扩增曲线,其余均无阈值信号产生,表明建立方法特异性良好(图2)。
2.5 敏感性试验 对1.96×1010拷贝/μL~1.96×101拷贝/μL 10 个浓度的重组质粒标准品进行敏感性试验,结果显示,建立的荧光定量PCR 方法对重组质粒标准品的检测下限为1.96×101拷贝/μL,而常规PCR 的检测下限为1.96×103拷贝/μL(图3),表明荧光定量PCR 比常规PCR 的敏感性高100 倍。
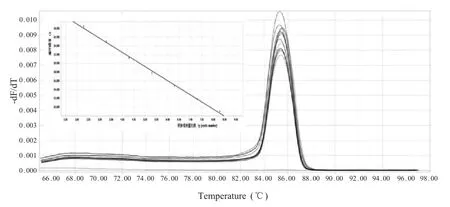
图1 荧光定量PCR 标准曲线和熔解曲线Fig.1 Standard curve and melting curve of SYBR Green I real-time PCR for detection of recombinant plasmids with series dilutions
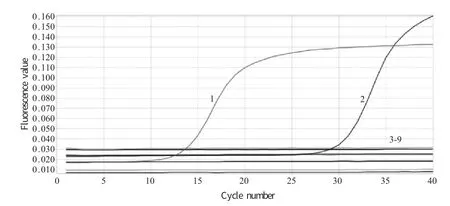
图2 MG 荧光定量PCR 的特异性扩增曲线Fig.2 The specific amplification curve of SYBR Green I real-time PCR for detection of MG
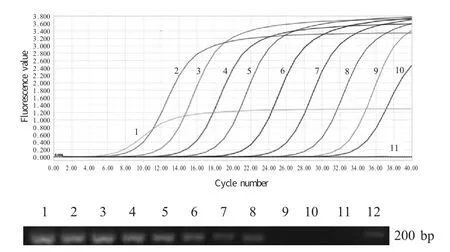
图3 MG 荧光定量PCR 和常规PCR 敏感性试验比较Fig.3 Sensitivity test comparision of SYBR I Green real-time PCR and conventional PCR for MG
2.6 重复性试验 采用建立的荧光定量PCR 方法对1.96×106拷贝/μL、1.96×104拷贝/μL、1.96×102拷贝/μL 的标准品做3 次重复检测,批间和批内的变异系数均小于2 %(表1),表明该方法具有良好的重复性。

表1 荧光定量PCR 重复性试验结果Table 1 The reproducibility test of the SYBR I Green real-time PCR
2.7 临床样品的检测 抽检来自粤西4 市鸡场呼吸道病的肺脏样品30 份,利用建立的荧光定量PCR、常规PCR 及SPA 方法对病料样品进行检测。结果显示,在30 份待检样品中,荧光定量PCR 检出12份阳性,常规PCR 检出10 份阳性,SPA 检出7 份阳性(表2)。表明本实验建立的荧光定量PCR 的敏感性显著高于常规PCR 及血清学方法。采用荧光定量PCR 方法对活疫苗检测的结果每头份为2.0×107拷贝/μL。
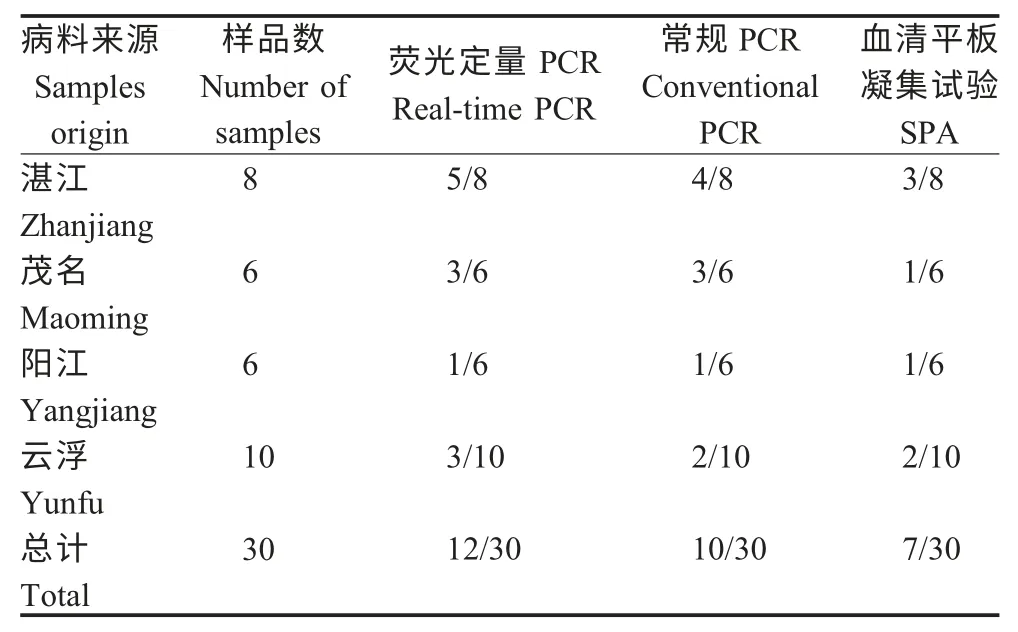
表2 临床样品检测结果Table 2 Detection results of clinical samples
3 讨论
目前MG 的检测方法主要有血清学方法、分离培养法、分子生物学方法等。血清学方法,如ELISA 及胶体金技术、SPA、HI 等临床常用的检测方法[5-7],广泛应用于养禽场筛选试验,但很难检测出早期的MG 感染,并且敏感性低。病原分离培养仍是病原检测的金标准,但MG 病原生长条件苛刻,培养周期长(7 d~10 d),给分离培养带来严重挑战,而且MG 常伴发有混合感染,也增加了MG分离的难度,不适用于早期诊断。PCR 方法敏感性高,特异性强,是目前MG 最常采用的分子生物学检测方法,一些学者建立了以mgc2、16S rRNA、LP、gapA 基因为靶标的PCR 检测方法[8-11]。近年来开始利用荧光定量PCR 技术检测MG。Kahya 和周云蕾等分别以mgc 基因和PvpA 基因为靶基因序列建立了荧光定量PCR 方法,检测限分别为0.9 pg/μL和72 拷贝/反应[7-12];Fraga 建立了能够同时区分MG 和MS 的Taq man 荧光定量PCR 方法,对MG的检测限为25 拷贝/反应,定量限为102拷贝/反应[13];本研究以16S rDNA 为靶标建立了SYBR GreenⅠ荧光定量PCR 方法,检测限为19.6 拷贝/μL(19.6 拷贝/反应)。
在疫苗的质量监控中,病毒含量是至关重要的,建立简便、快速、可靠的病原检测方法对疫苗生产的监控具有实际意义。目前主要是通过活菌计数方法来检测MG 疫苗中的病原含量,但活菌计数方法操作繁琐,所需时间长,不能达到实时监控,误差也较大。本实验采用荧光定量PCR 对F36 株弱毒疫苗的病毒含量进行了测定,结果测得每头份MG 的含量为2.0×107拷贝/μL。该方法的建立为弱毒疫苗的质量监控提供了一种新的快速检测方法。
综上所述,本研究建立的SYBR GreenⅠ荧光定量PCR 方法特异性高,重复性好,灵敏度比常规PCR 高100 倍,并且可避免常规PCR 电泳检测所带来的高污染率,在敏感性和检测速度上有明显提高,并且可精确定量,可应用于MG 感染引起的慢性呼吸道病的早期检测及疫苗监测等方面的定量研究。
[1]Landman W J.Is Mycoplasma synoviae outrunning Mycoplasma gallisepticum?A viewpoint from the Netherlands[J].Avian Pathol,2014,43(1):2-8.
[2]Brown D R,Whitcomb R F,Bradbury J M.Revised minimal standards for description of new species of the class Mollicutes(division Tenericutes)[J].Int J SystEvolMicrobiol,2007,57(Pt 11):2703-2719.
[3]Garcia M,Ikuta N,Levisohn S,et al.Evaluation and comparison of various PCR methods for detection of Mycoplasma gallisepticum infection in chickens[J].Avian Dis,2005,49(1):125-132.
[4]周涛,张继挺,王国良.香鱼假单胞菌SYBR GreenⅠ荧光定量PCR 检测方法的建立[J].中国预防兽医学报,2015(01):35-39.
[5]宁官保,刘国莉,张鼎,等.鸡毒支原体胶体金免疫层析试纸条的研制和初步应用[J].动物医学进展,2015(05):25-28.
[6]Kleven S H.Control of avian mycoplasma infections in commercial poultry[J].Avian Dis,2008,52(3):367-374.
[7]Kahya S,Temelli S,Eyigor A,et al.Real-time PCR culture and serology for the diagnosis of Mycoplasma gallisepticum in chicken breeder flocks[J].Vet Microbiol,2010,144(3-4):319-324.
[8]Salisch H,Hinz K H,Graack H D,et al.A comparison of a commercial PCR-based test to culture methods for detection of Mycoplasma gallisepticum and Mycoplasma synoviae in concurrently infected chickens[J].Avian Pathol,1998,27(2):142-147.
[9]Feberwee A,Mekkes D R,de Wit J J,et al.Comparison of culture,PCR,and different serologic tests for detection of Mycoplasma gallisepticum and Mycoplasma synoviae infections[J].Avian Dis,2005,49(2):260-268.
[10]Garcia M,Ikuta N,Levisohn S,et al.Evaluation and comparison of various PCR methods for detection of Mycoplasma gallisepticum infection in chickens[J].Avian Dis,2005,49(1):125-132.
[11]Marois C,Dufour-Gesbert F,Kempf I.Polymerase chain reaction for detection of Mycoplasma gallisepticum in environmental samples[J].Avian Pathol,2002,31(2):163-168.
[12]周云雷,魏飞龙,李健,等.鸡毒支原体实时荧光定量PCR检测方法的建立[J].中国农业科学,2011,(11):2371-2378.
[13]Fraga A P,de Vargas T,Ikuta N,et al.A Multiplex real-time PCR for detection of Mycoplasma gallisepticum and Mycoplasma synoviae in clinical samples from Brazilian commercial poultry flocks[J].Braz J Microbiol,2013,44(2):505-510.

