草鱼致病性豚鼠气单胞菌的分离鉴定
何永龙,黄锦炉,乔晶鑫,王贵平,李中圣
(广东海大畜牧兽医研究院,广东广州 511490)
草鱼(Grass carp)又名鲩鱼,属鲤形目鲤科雅罗鱼亚科草鱼属,是我国重要的人工淡水养殖“四大家鱼”之一,由于其肉质鲜美、饲料来源广、养殖成本低而深受养殖户喜爱。然而,随着养殖密度的不断提高,养殖水环境的不断恶化,各种病原危害不断侵扰草鱼的健康养殖,原本水环境中无害或低危害的常在微生物在一定条件下变成病原体,直接或间接导致草鱼发病死亡,成为草鱼养殖成败中不可忽视的因素。2014 年8 月,江苏省南通市某养殖场的草鱼出现陆续浮头死亡现象,发病草鱼鱼体发黑、鱼鳍充血、鱼鳞脱落、体表溃烂,腹腔内充满浑浊液体,肝脏偏黄、脾脏肿大色泽变暗。从现场采集多份发病草鱼病料组织样品,分离出同一种细菌。对该分离菌株进行形态学、培养特性、生理生化、16S rRNA 序列等方面的综合分析鉴定,并将分离的细菌进行动物回归试验,测定其半数致死量(LD50),检测其对相关药物的敏感性,为草鱼养殖中防治该病提供了实验依据。
1 材料和方法
1.1 临床样品及实验动物 发病草鱼取自江苏省南通市某养殖鱼塘(体质量500 g~750 g)。实验草鱼(体质量50 g)购自广东海大集团股份有限公司实验基地。
1.2 主要试剂 绵羊血平板购自环凯微生物科技有限公司;抗菌药物药敏纸片和微量生化鉴定管购自杭州微生物试剂有限公司;PCR 试剂购自TaKaRa公司;细菌基因组抽提试剂盒购自生工生物工程(上海)有限公司;引物合成由上海生工生物工程技术服务有限公司合成。
1.3 细菌分离纯化 无菌采集发病鱼各脏器渗出液及草鱼体表溃烂处浸出液涂布于LB 平板,同时无菌采集发病草鱼血液、鳃、肝脏、肾脏、脾脏和肠道组织样品,涂布LB 平板,于28 ℃恒温培养24 h[1]。观察各脏器及体表分离细菌菌落形态,挑取优势菌落于LB 平板上进行两次纯化培养后,接种于LB 培养基,于28 ℃摇床培养8 h 后镜检,保存于超低温冰箱。
1.4 细菌生长特性观察 将菌株分别划线于LB 和绵羊血平板,28 ℃培养24 h,观察菌落形态,挑取单菌落革兰氏染色后镜检。将分离菌株经LB 培养基活化后稀释100 倍,再按体积千分之一接种于50 mL LB 培养基,28 ℃200 r/min 振荡培养24 h,间隔不同时间取样,系列稀释后进行菌落计数,每个时间点作3 次重复。计数后取平均值,绘制24 h 细菌生长曲线[2]。
1.5 细菌致病力分析
1.5.1 动物回归试验 将分离菌株接种LB 培养基,28 ℃振荡培养至对数生长期,进行细菌计数,将菌液稀释至6.6×109cfu/mL 和6.6×108cfu/mL。将体质量约为50 g 的健康草鱼分为6 组,每组15 尾,饲养在28 ℃~30 ℃曝气水中。第一组背鳍基部注射6.6×109cfu/mL 菌液,0.5 mL/尾;第二组背鳍基部注射生理盐水,0.5 mL/尾;第3 组腹腔注射6.6×108cfu/mL 菌液,0.5 mL/尾;第4 组腹腔注射生理盐水,0.5 mL/尾;第5 组用镊子刮取健康鱼体表鳞片制造创伤,在6.0×109cfu/mL 菌液中浸泡30 min,然后转入饲养水体;第6 组设为浸泡对照组,以相同方法制造创伤后,转入饲养水体[3]。
1.5.2 细菌LD50测定 将分离菌株接种LB 培养基,28 ℃振荡培养至对数生长期,细菌计数后,稀释菌液至所需浓度。将健康草鱼分为8 组,每组30尾。1~7 组分别背鳍基部注射不同稀释度(6.6×103cfu/mL~6.6×109cfu/mL)的菌液0.5 mL,第8 组注射0.65 %生理盐水0.5 mL[4-5]。观察7 d 并记录各组鱼的死亡情况,按照Reed-Muench 法计算LD50[6]。
1.6 细菌生理生化鉴定 挑取LB 平板上生长24 h的分离菌株单菌落,按照生理生化试验操作方法进行生化鉴定。
1.7 细菌16S rRNA基因的分析 利用细菌基因组提取试剂盒提取细菌基因组作为PCR 模板。引物为27F:5'-AGAGTTTGATCATGGCTCAG-3'/1492R:5'-CTACGGTTACCTTGTTACGAC-3'。参考文献[7]PCR体系扩增目的片段。PCR 产物经回收纯化后,克隆于pMD18-T 载体中,进行测序。将测定的16S rRNA序列在GenBank 中进行序列相似性比较,确定其物种属的范围。
从GenBank 中获取对应模式菌株的16S rRNA序列,各模式菌尽量选自同一个菌种库ATCC。利用MEGA 5.0 软件,通过Neighbour Joining 法基于各菌株的16S rRNA 序列对分离菌株进行系统进化分析,并构建系统进化树[8]。
1.8 病原药物敏感试验 根据美国临床实验室标准委员会(NC-CLS)推荐的K-B 法对分离菌株进行药敏试验。将新鲜培养8 h 的菌液利用培养基稀释至5×108cfu/mL,以灭菌棉签蘸取菌液均匀涂布在MH平板上,将药敏片以4 cm 的距离等间距贴放在平板上,28 ℃培养18 h,根据杭州微生物药物敏感标准判断细菌对各药敏片的敏感程度[9]。
2 结果
2.1 细菌菌落及其形态特征 将病鱼的各脏器组织及体表溃烂处浸出液接种LB 平板,培养后的菌落形态显示,存在同一形态的优势菌落,挑取该细菌单菌落于LB 平板上进行两次纯化,接种于LB 液体培养基扩大培养,镜检显示,病原菌在LB 固体培养基上生长24 h 后菌落呈圆形,边缘完整,中央突起,表面光滑,浅黄色半透明,无色素产生;细菌在绵羊血平板上生长24 h 后菌落呈圆形,边缘完整,中央有突起,表面光滑,产生β 溶血环。挑取该病原菌单菌落进行革兰氏染色,镜检为阴性短杆状,两端钝圆,无荚膜,细菌长短较均一,呈单个分散排列(图1)。
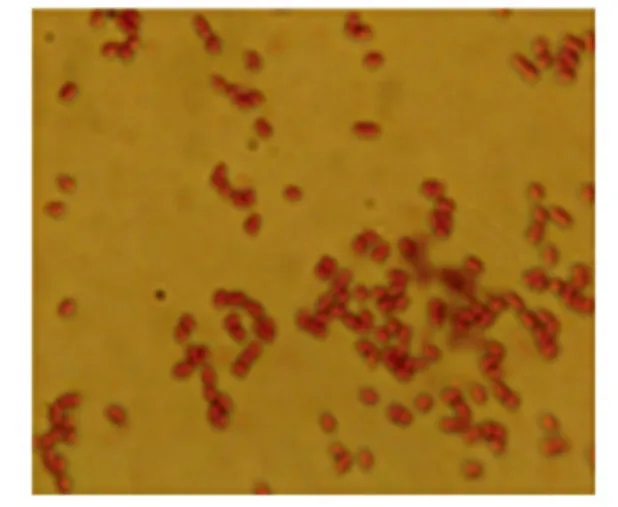
图1 分离菌株在油镜下细菌形态Fig.1 The bacterial morphs of isolation strain on oil immersion lens
2.2 分离菌在LB液体培养基中生长曲线 将分离菌接种LB 液体培养基,于不同时间取样后,以取样时间点为X 值,各时间点菌落计数结果的对数平均值为Y 值,绘制生长曲线。结果显示,细菌在第3 h 开始进入对数生长期,在第8 h 后生长趋于平缓,到14 h 后达到峰值7.41×109cfu/mL,之后活菌数开始下降,生长24 h 后活菌浓度依然保持在1.3×108cfu/mL 以上(图2)。
2.3 动物回归试验 将分离菌株经不同途径和不同稀释度接种6 组健康草鱼,结果显示草鱼腹腔接种组、背鳍基部接种组和菌液浸泡组自接种之日起,陆续出现发病死亡现象,腹腔接种组死亡较快,草鱼浸泡接种组发病死亡缓慢。各组发病草鱼活动迟缓、背部发黑、胸鳍充血,与临床发病草鱼症状类似,对照组无发病死亡现象。将濒死草鱼无菌解剖,取鳃、肝脏、脾脏、肾脏、肠、胃组织涂布LB平板,结果显示,腹腔内主要脏器组织中均分离到较纯的优势菌,经鉴定与接种细菌为同一菌株。
2.4 细菌LD50检测 将不同稀释度的分离菌接种草鱼,结果显示,部分高剂量组自接种后第1 d 开始出现死亡,低剂量组草鱼发病缓慢,死亡数量相对较少,连续观察7 d 后,根据各组草鱼死亡情况(表1),采用Reed-Muench 法计算该分离菌LD50=4.928×106cfu。
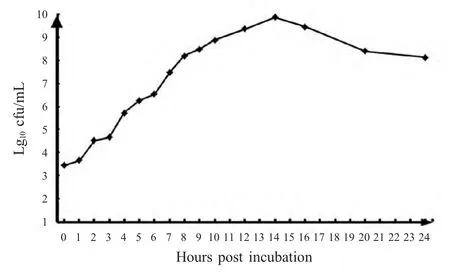
图2 分离株在LB 培养基中的生长曲线Fig.2 Growth profiles of the isolate in LB
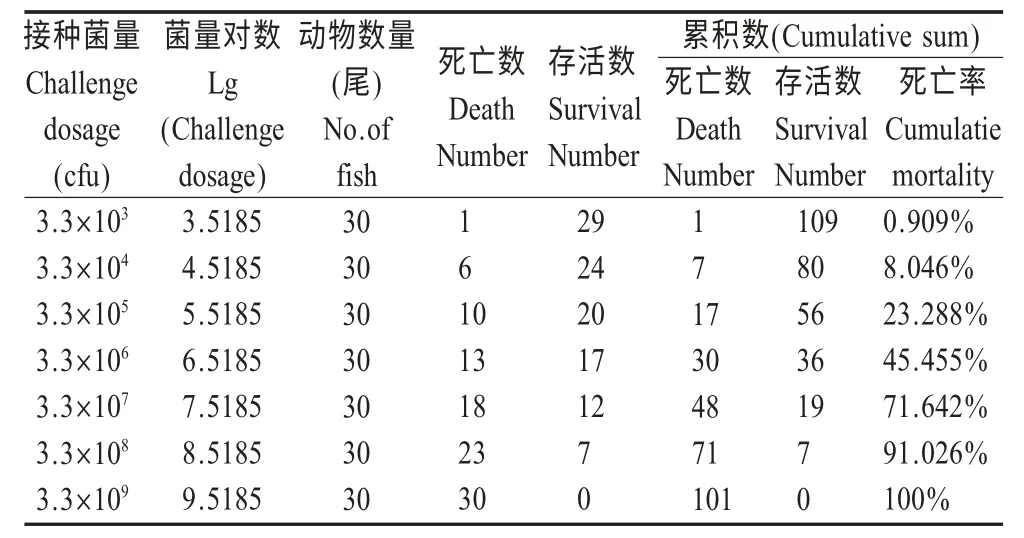
表1 分离株对健康草鱼LD50试验结果Table 1 Results of LD50of isolation strain in grass carp
2.5 生理生化鉴定 将分离细菌加至微量生化管后放置37 ℃观察24 h~48 h,其中甘油和乳糖生化管观察7 d,参照杭州微生物试剂有限公司提供的判定标准,分离菌各项生理生化反应结果如下(表2)。根据《Bergey's Manual of Systematic Bacteriology,Second Edition》提供的气单胞菌属各种及亚种生化鉴定参考标准,在选取的32 种生理生化指标中,除乳糖以外,其它项目均与豚鼠气单胞菌(Aeromonas caviae)符合,符合率为96.9 %。
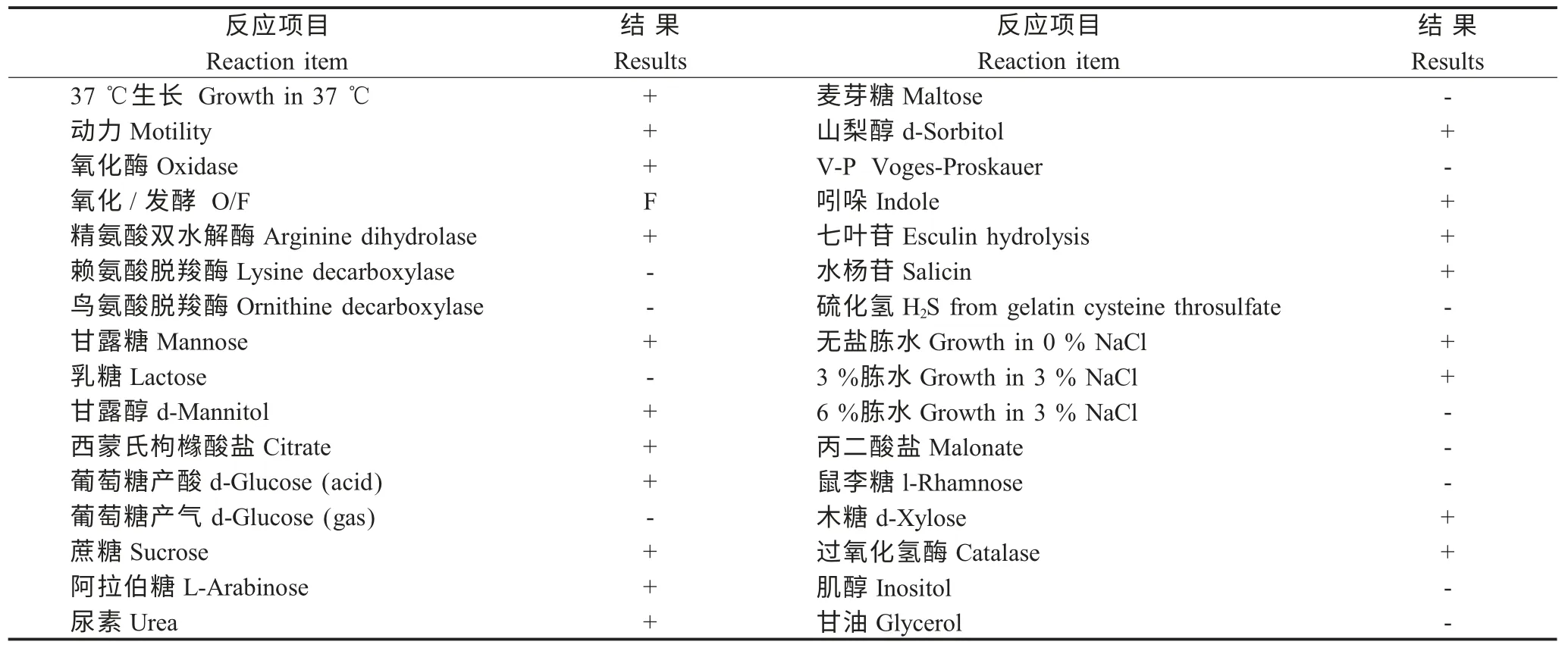
表2 生理生化鉴定结果Table 2 Results of physiological and biochemical identification
2.6 细菌16S rRNA基因的分析 提取细菌基因组为模板,利用通用引物PCR 扩增分离菌株16S rRNA,结果显示,目的片段长度约为1 500 bp,大小与预期相符(图3)。将测定的分离菌株16S rRNA序列(KR559929.1)登录至GenBank 中进行BLAST 分析,结果显示,与所测序列同源性达99.5 %以上的菌株均为气单胞菌属,可以确定分离菌株大致种属范围为气单胞菌属。
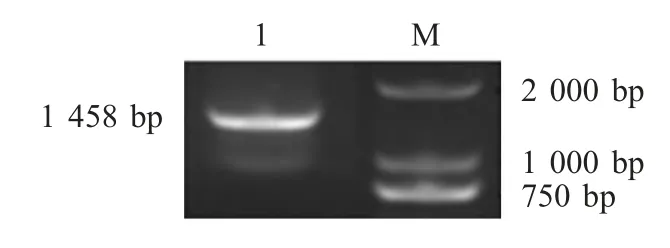
图3 分离菌株16S RNA PCR 扩增结果Fig.3 PCR amplified products of 16S rRNA
利用MEGA 5.0 软件,通过Neighbour Joining法基于各菌株的16S rRNA 序列对分离菌株进行系统进化分析,并构建系统进化树(图4),节点的置信度检验采取Bootstrap 分析(1 000 个循环)。根据构建的系统进化树各分支置信度及进化距离显示,分离菌株与豚鼠气单胞菌、肠棕气单胞菌(Aeromonas trota)同属一个分支,可能为其中某一个种。结合以上细菌形态、菌落生长形态、溶血特征、生理生化鉴定结果,可以确定该菌株为豚鼠气单胞菌,将其命名为JS 分离株。
2.7 药物敏感试验 利用24 种常用药物对JS 株进行药物敏感性试验,结果显示:该分离株对17 种药物(恩诺沙星、卡那霉素、四环素、诺氟沙星、复方新诺明、依诺沙星、强力霉素、氯霉素、头孢曲松钠、利福平、庆大霉素、环丙沙星、氟苯尼考、磺胺甲氧嘧啶)敏感,对多粘菌素B 和红霉素2 种药物中度敏感,对青霉素、克林霉素、头孢拉定、阿莫西林、氨苄青霉素5 种药物耐药。
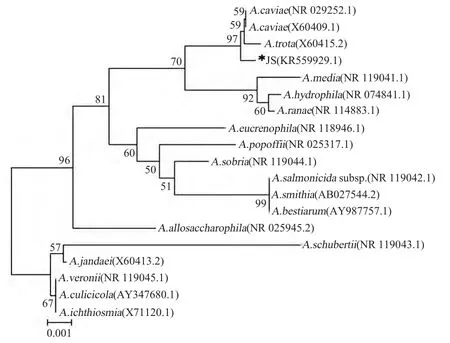
图4 JS 株 根据16S rRNA 基因序列构建的系统进化树Fig.4 Phylogenetic tree of Aeromonas based on 16S rRNA gene sequence of JS strain
3 讨论
豚鼠气单胞菌隶属于气单胞菌属,是导致我国淡水水生动物发病死亡的主要病原菌之一,能够引起包括鲢鱼、鳙鱼、甲鱼、鳗鲡,泥鳅、蟹在内多种水生动物发病[10-11],主要表现为体表溃烂、败血症、肠炎、鳞片出血及鱼鳍充血等相关症状,还可以通过饮水和带菌食物引起人的肠炎、菌血症等,严重时可危及生命[12]。本研究从临床发病草鱼中分离到致病性豚鼠气单胞菌尚属少见,进一步验证了其对不同宿主的致病性。
随着分子诊断技术的不断发展,气单胞菌新的种及亚种不断被鉴定。截止2004 年,《Bergey's Manual of Systematic Bacteriology,Second Edition》共收录气单胞菌种及亚种26 个。本研究采用生理生化特性与16S rRNA 基因序列系统进化分析相结合的方法鉴定气单胞菌,其中生化项目符合率达96.9%,能够与气单胞菌属内其它大部分的种或亚种区分开来。为保证系统进化分析的准确性,尽量选取细菌库(ATCC)的模式菌株进行比较分析,由于部分模式菌株存在争议[13],以及16S rRNA 高保守性导致各分支的置信度数值偏低,基于16S rRNA 序列的系统进化分析只能将菌株确定在较小的范围内,结合生理生化鉴定结果才可以确定种的名称。细菌16S rRNA 序列种间差异小于1 %,对种及种下阶元的鉴定存在局限性,如需从基因序列的同源性进一步验证该菌归属,可以选取气单胞菌属aha1、Hly、Alt、gyrB、rpoD、rpoB、groL、gltA、metG、ppsA、asal等相关基因进行多位点序列分型(MLST),或根据国际条形码库提供的属级别的基因进行种及种下阶元的划分[14-15]。
本研究分离的豚鼠气单胞菌在普通LB 培养基中生长迅速,对健康草鱼具有较强的致病性,对17种临床用药较为敏感。该结果对临床用药具有一定指导意义,可以从临床分离更多豚鼠气单胞菌,扩大试验药物范围,筛选出合适的抗生素指导临床用药。同时可以进一步验证该菌株对其它水生动物的致病性,利用该菌株作为基础菌株进行灭活疫苗或基因工程疫苗的相关研究。
[1]杨金平,沐建刚,刘岳,等.罗非鱼维罗纳气单胞菌的分离鉴定[J].动物医学进展,2015,36(5):40-43.
[2]张红丹,杜茜,张正坤,等.放线菌769 抑菌谱及液体培养生长曲线的测定[J].中国植保导刊,2010,30(7):5-9.
[3]刘志刚,可小丽,卢迈新,等.尼罗罗非鱼致病性类志贺邻单胞菌的分离鉴定及其病理观察[J].微生物学报,2015,55(1):96-106.
[4]王小兰,胡青海,童永亮,等.血清1 型鸭疫里默氏杆菌灭活油乳剂疫苗的研制[J].中国预防兽医学报,2012,34(4):313-316.
[5]杨宝凤,李能章,邹灵秀,等.6 株牛源A 型多杀性巴氏杆菌的分离与鉴定[J].中国预防兽医学报,2014,36(6):487-489.
[6]Reed L J,Muench H.A simple method of estimating fifty percent end points[J].Am J Hyg,1938,27:493-497.
[7]李 梅,刘文利,黄树涛,等.锦鲤嗜水气单胞菌的分离鉴定及生物学特性研究[J].中国预防兽医学报,2010,32(8):591-594.
[8]Esteve C,Alcaidei E,Blasco M D.Aeromonas hydrophila subsp.dhakensis isolated from feces,water and fish in Mediterranean Spain[J].Microbes Environ,2012,27(4):367-373.
[9]李楠,郭慧芝,焦冉,等.草鱼的一种急性细菌性传染病病原的分离鉴定及致病性研究[J].水生生物学报,2011,35(6):980-987.
[10]马英,关瑞章,郭松林,等.鳗鲡病原菌16S rRNA 基因序列测定及系统进化分析[J].华中农业大学学报,2010,29(6):758-763.
[11]曹海鹏,温乐夫,杨移斌,等.克氏原螯虾源致病性豚鼠气单胞菌的分离及其生物学特性[J].水生生物学报,2014,38(6):1047-1053.
[12]吴珺,鹿英英,刘亚莉.严重肺部感染合并嗜水/豚鼠气单胞菌菌血症11 例临床分析[J].中华医院感染学杂志,2011,21(18):3835-3837.
[13]李爱华.气单胞菌(Aeromonads)分类与命名的最新进展[J].鱼类病害研究,2001,23(2):25-32.
[14]Maria M,Luca F,Filomena M,et al.Determination of microbial diversity of Aeromonas strains on the basis of multilocus sequence typing,phenotype,and presence of putative virulence genes[J].Appl Environ Microbiol,2011,77(14):4986-5000.
[15]田茜,张美,胡洁,等.植物病原细菌DNA 条形码检测技术[J].植物检疫,2014,28(6):1-7.

