可溶性NKG2D配体降低NK细胞对骨髓瘤细胞杀伤功能的研究
短篇论著
可溶性NKG2D配体降低NK细胞对骨髓瘤细胞杀伤功能的研究
韩文敏1, 贾祝霞1, 姜玉1, 朱志超2, 张修文2,
肖溶1, 杨建和1, 卢绪章1
(江苏省常州市第二人民医院, 1. 血液科; 2. 中心实验室, 江苏 常州, 213003)
关键词:NKG2D配体; 自然杀伤细胞; 多发性骨髓瘤; 杀伤功能
人自然杀伤细胞(NK细胞)是人体抗肿瘤免疫的第一道防线,NK细胞通过识别自我的MHCⅠ类分子或Ⅰ类分子样的独特受体,可以识别和杀伤体内的肿瘤细胞[1-2]。体外实验[3-4]证实NK细胞对骨髓瘤细胞细胞具有很强的杀伤能力,但是肿瘤患者体内的肿瘤细胞可以逃逸免疫细胞的识别和杀伤,而且通过NK细胞输注治疗骨髓瘤患者并没有得到预期的效果,说明MM患者体内环境抑制NK细胞功能。作者以前的研究[5-6]表明NKG2D介导免疫细胞对骨髓瘤细胞的杀伤作用,作者通过检测MM患者血清中可溶性NKG2D配体水平变化,并通过细胞株模型探讨可溶性的NKG2D配体对NK细胞抗骨髓瘤能力的影响。
1材料与方法
1.1 一般资料
选取2009年3月—2013年12月在本院确诊的13例MM患者,中位年龄63岁(41~89岁),所有患者均符合国内MM诊断标准,设为实验组。以30名健康志愿者为正常对照,中位年龄59岁(45~82岁),对照组均无肿瘤及自身免疫性疾病史。收集的血清放在-20 ℃冻存,然后统一检测。
1.2 细胞及主要试剂
骨髓瘤细胞株U266由上海长征医院侯健教授惠赠,用含有10%灭活胎小牛血清(FBS)、100 U/mL的青霉素和100 μg/mL的链霉素的PRMI1640培养液,置于5% CO2,37 ℃培养箱内培养。流式细胞术抗体为美国Becton Dickinson公司产品流式细胞抗体包括CD3-Percp、CD56-FITC、NKG2D-PE及NK细胞分离试剂盒购买于R&D Systems公司。用于sMICA、sMICB检测的ELISA试剂盒购于北京来博生物科技公司。Transwell培养系统购于Nunc公司。流式细胞仪(BD FACS Canto Ⅱ)为BD公司。
1.3 研究方法
1.3.1流式细胞仪(FCM)测定:取待标记的细胞1×105/100 mL,分别加入4 μL荧光抗体,4 ℃避光反应30 min后用PBS洗2遍,用300 mL的PBS悬浮后上机检测,每标本记录细胞数为1×104个。利用FlowJO 软件进行数据分析。
1.3.2ELISA检测可溶性NKG2D配体水平:按照ELISA试剂盒说明书进行操作,用酶标仪于波长450 mm处测定吸光度(A)值,并计算出待测标本可溶性NKG2D配体(sMICA、sMICB)的表达水平。
1.3.3NK细胞分离和培养:将健康人单个核细胞用PBS洗涤2次,按NK细胞分离试剂盒说明书进行操作,分离纯化的NK细胞用含有10%FBS、100 U/mL IL-2、50 U/mL青霉素、50 UG/mL链霉素的RPMI1640培养基培养,并检测其表面NKG2D受体的表达水平。
1.3.4Transwell实验: Transwell上室加入2×105/200 mL的NK细胞悬液,对照组下室加入10%血清的1640培养液600 mL, 实验组下室加入2×105/600 mL的U266细胞。每组3个复孔,37℃培养箱培养48 h后检测NK细胞表面NKG2D受体的表达或用作效应细胞。
1.3.5NK细胞的细胞毒性试验:根据作者以前应用的方法[5],骨髓瘤细胞U266预选用0.1 μM Calcein acetoxymethyl ester (CAM)孵育15 min后,标定的U266用PBS洗2次,然后用培养液重新调整细胞浓度,并按照5×105/孔放到圆底的96孔板中,然后按照的E︰T比值为10加入NK细胞,在培养箱里一起孵育8 h后用PBS洗1次,然后用结合缓冲液重新混悬细胞,然后用加入7-AAD抗体在常温中孵育15 min后用流式细胞仪检测特异性杀伤。特异性杀伤用百分比用公式:特异性杀伤(%)=(CT-TE/CT)×100% (CT表示在对照孔中活细胞的所占的比率,TE表示测试管中活细胞所占的比率)。
2结果
2.1 骨髓瘤患者血清可溶性NKG2D配体浓度
水平变化
比较健康人和初诊的多发性骨髓瘤患者外周血清中可溶性NKG2D配体的浓度,ELISA方法检测血清中NKG2D配体的浓度。多发性骨髓瘤患者外周血清中sMICA和sMICB的浓度分别是(156.4±47.1) ng/L和(106.2±35.3) ng/L,明显高于正常人的(57.2±26.7) ng/L和(44.6±23.5) ng/L(P<0.001)。
2.2 骨髓瘤细胞U266培养上清中可溶性
NKG2D配体的浓度
U266细胞培养24、48、72 h后用ELISA检查培养上清中NKG2D配体的浓度,随着培养时间的增多,骨髓瘤细胞培养上清中NKG2D配体的浓度逐渐增加。见表1。
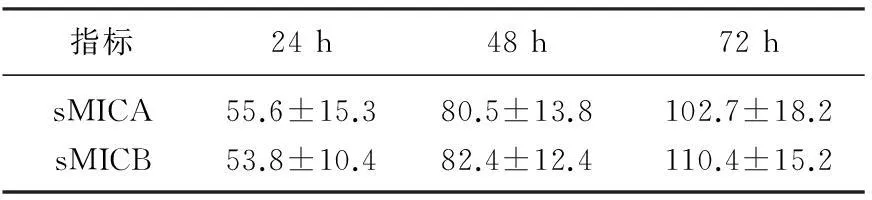
表1 U266培养上清中sMICA和sMICB的表达水平 ng/L
2.3 可溶性NKG2D配体对NK细胞表面NKG2D受体及杀伤功能的影响
U266和NK细胞在Transwell共培养48 h检测NK细胞表面NKG2D受体,实验组NK细胞表面的NKG2D受体表达为(66.5±5.8)%,明显低于对照组的(96.8±7.4)%。作者用NK细胞为效应细胞,骨髓瘤细胞U266为靶细胞,检测NK细胞对U266特异性杀伤,实验组的NK细胞对U266特异性杀伤为(42.3±10.7)%,低于对照组的(62.8±15.6)%,差异有统计学意义(P<0.05)。
3讨论
人自然杀伤细胞是肿瘤生物治疗常用的一类免疫细胞,NK细胞的杀伤活性是通过其表面的活化型受体介导的NK细胞激活[7-8],其中NKG2D是NK细胞表面重要的活化型受体,它可以识别肿瘤细胞表面相应的NKG2D配体从而杀伤肿瘤细胞,对NK细胞活性的调控起重要作用[9-11]。但是肿瘤细胞的金属蛋白酶可以水解细胞表面的NKG2D配体,从而形成可溶性NKG2D配体分子,诱导肿瘤细胞逃逸NK细胞识别和杀伤[12]。作者以前的研究表明患者的骨髓瘤细胞表面表达一定水平的NKG2D配体,免疫细胞通过NKG2D受体和配体的相互作用杀伤骨髓瘤细胞。作者进一步检测MM患者血清中可溶性NKG2D配体的浓度,发现MM患者血清中可溶性的NKG2D配体分子(sMICA,sMICB)明显高于健康人(P<0.001), 可溶性NKG2D配体可能是体内影响NK细胞功能的重要因素。
为了验证可溶性NKG2D配体对NK细胞功能的影响,作者以骨髓瘤细胞株U266为模型,验证骨髓瘤细胞分泌的可溶性NKG2D配体对NK细胞杀伤作用的影响。作者以前的研究[13]发现骨髓瘤细胞株U266表达一定水平的MICA/B蛋白分子,其培养上清可检测到一定水平的sMICA/B,而且随着培养时间的延长,其上清中sMICA/B浓度逐渐升高。作者用Tanswell共培养U266细胞和NK细胞48 h后可以发现NK细胞表面的NKG2D受体表达水平明显下降,同时U266共培养的 NK细胞对骨髓瘤细胞U266的杀伤作用明显降低,这说明骨髓瘤细胞分泌的可溶性的NKG2D配体分子通过降低NK细胞表面的NKG2D受体表达,从而降低了NKG2D介导的NK细胞对骨髓瘤细胞的杀伤作用。
本研究表明,骨髓瘤细胞能够分泌可溶性sMICA/B配体分子,降低NK细胞表面NKG2D受体的表达,从而导致了NK细胞抗肿瘤能力的下降,这可能是MM患者体内NK细胞抗肿瘤能力下降的原因。改善肿瘤患者内环境,降低体内可溶性NKG2D配体分子水平,可能会改善体内免疫细胞抗肿瘤能力,从而提高患者的无病生存时间及总生存时间。
参考文献
[1]Cooper M A, Fehniger T A, Caligiuri M A. The biology of human natural killer-cell subsets[J]. Trends Immunol, 2001, 22(11): 633.
[2]Pende D, Cantoni C, Rivera P, et al.Role of NKG2D in tumor cell lysis mediated by human NK cells: cooperation with natural cytotoxicity receptors and capability of recognizing tumors of nonepithelial origin[J].Eur J Immunol, 2001, 31(4): 1076.
[3]Garg T K, Szmania S, Mkhan JA, et al.Highly activated and expanded natural killer cells for multiple myeloma immunotherapy [J].Haematologica, 2012, 97(9): 1348.
[4]Alici E, Konstantinidis K V, Sutlu, T, et al. Anti-myeloma activity of endogenous and adoptively transferred activated natural killer cells in experimental multiple myeloma model[J]. Exp Hematol, 2007, 35(12): 1839.
[5]Lu X, Zhu A, Cai X, et al.Role of NKG2D in cytokine-induced killer cells against multiple myeloma cells[J]. Cancer Biol Ther, 2012, 13(8): 623.
[6]卢绪章, 蔡晓辉, 马玲娣, 等.NKG2D介导正常人NK细胞对白血病细胞的杀伤作用[J]. 中华血液学杂志, 2012, 33(6): 444.
[7]Purdy A K, Campbell K S. Natural killer cells and cancer: regulation by the killer cell Ig-like receptors (KIR)[J]. Cancer Biol Ther, 2009, 8(23): 2211.
[8]Miller J S. The biology of natural killer cells in cancer, infection, and pregnancy[J]. Exp Hematol, 2001, 29(10): 1157.
[9]Boerman G H, van Ostaijen-Ten Dam M M, Kraal K C, et al. Role of NKG2D, DNAM-1 and natural cytotoxicity receptors in cytotoxicity toward rhabdomyosarcoma cell lines mediated by resting and IL-15-activated human natural killer cells[J]. Cancer Immunol Immunother, 2015, 64(5): 573.
[10]Gilfillan S, Ho E L, Cella M, et al. NKG2D recruits two distinct adapters to trigger NK cell activation and costimulation[J]. Nat Immunol, 2002, 3(12): 1150.
[11]Fernandez-Messina L, Reyburn HT, Vales-Gomez M.Human NKG2D-ligands: cell biology strategies to ensure immune recognition[J]. Front Immunol, 2012, 3: 299.
[12]Salih H R, Holdenrieder S, Steinle A. Soluble NKG2D ligands: prevalence, release, and functional impact[J]. Front Biosci, 2008, 13: 3448.
[13]何金媛, 贾祝霞, 蔡晓辉, 等. NKG2D在细胞因子诱导的杀伤性细胞(CIK)抗血液肿瘤细胞的作用[J]. 中国试验血液学杂志, 2013, 21(6): 1380.
通信作者:卢绪章, E-mail: luxuzhang2008@163.com
基金项目:江苏省常州市卫生局重大科技项目(ZD201311)
收稿日期:2015-06-17
中图分类号:R 551.3
文献标志码:A
文章编号:1672-2353(2015)24-134-02
DOI:10.7619/jcmp.201524053

