沙利度胺、雷那度胺、硼替佐米治疗多发性骨髓瘤的预后因素分析
韩雪++++蒋苏豫+++王建宁++侯艳秋++张柳波

[摘要]目的 探讨沙利度胺、雷那度胺、硼替佐米等治疗多发性骨髓瘤患者的总生存期(OS)及无进展生存(PFS),并分析预后相关因素。方法 回顾性分析2010年1月~2015年1月在我院经沙利度胺、雷那度胺、硼替佐米治疗的42例多发性骨髓瘤患者病历资料。对选取的参数进行单因素分析,采用Cox模型行单因素分析,对有统计学意义的参数进行多因素回归分析,并构建生存曲线。结果 全组中位生存期43.36个月,2年OS率为76.19%,3年OS率为42.86%。单因素分析中,患者的年龄、血肌酐、LDH、β2-MG、ISS分期、治疗后血清游离轻链比值正常化与否、疗效与OS相关,年龄、疗效与PFS相关。结论 多发性骨髓瘤治疗后血清游离轻链比值及治疗深度与患者OS相关,沙利度胺、雷那度胺、硼替佐米能够明显改善患者的OS。
[关键词]多发性骨髓瘤;预后;单因素分析;多因素分析;Kaplan-Meier评估
[中图分类号] R733.3 [文献标识码] A [文章编号] 1674-4721(2016)10(a)-0101-04
[Abstract]Objective To explore overall survival (OS) and progression free survival (PFS) Thalidomide,Lenalidomide and Bortezomib in the treatment of patients with multiple myeloma and analyze prognosis related factors.Methods A retrospective analysis was made on 42 cases of multiple myeloma in our hospital from January 2010 to January 2015.The parameters were analyzed by single factor,the single factor analysis was carried out by Cox model,and the parameters of statistical significance were analyzed by multiple factors regression analysis,and the survival curve was constructed.Results Median survival time was 43.36 months,OS rate for 2 years was 76.19%,with 42.86% for 3 years.In single factor analysis,age,serum creatinine,LDH, β2-MG,ISS stage,serum free light chain ratio of normal or not after treatment and effect were associated with OS,age and effect were associated with PFS.Conclusion Serum free light chain ratio and the depth of treatment are associated with OS after treatment for patients with multiple myeloma,Thalidomide,Lenalidomide and Bortezomib treatment can significantly improve OS of patients.
[Key words]Multiple myeloma;Prognosis;Single factor analysis;Multiple factor analysis;Kaplan-Meier evaluation
作为初始治疗及治疗复发疾病,多发性骨髓瘤(multiple myeloma,MM)是一种典型的对化疗药物敏感的疾病,不幸的是,反应短暂的MM仍被认为是现阶段治疗手段无法治愈的疾病。但是,近年来,由于新药诸如沙利度胺、雷利度胺以及硼替佐米的应用,MM的治疗得到了迅速的发展[1]。在此笔者回顾性研究了新型药物对MM的治疗反应及临床特征对其预后的影响。
1资料与方法
1.1一般资料
2010年1月~2015年1月我科共接诊了80例MM患者,诊断依据张之南等主编的《血液病诊断及疗效标准》及MM肿瘤临床指南[2]。其中12例未接受治疗,26例未坚持在我院化疗或失联。在其余的42例患者中,男性27例(64.28%),女性15例(35.72%),年龄(59.85±11.42)岁。42例患者均坚持化疗>4个完整疗程,其中初治病例24例,复发及难治病例18例。有12例患者接受含硼替佐米方案治疗:硼替佐米(国药准字J20050042,美国Ben Venue Laboratories Inc)1.3 mg/m2,第1、4、8、11天;地塞米松20 mg,第1~4天和第9~12天,28 d为1个疗程。8例患者接受含雷利度胺方案:环磷酰胺(国药准字H32020857,江苏恒瑞医药股份有限公司)500 mg第1、8天,雷利度胺(批准文号:HZ200302,印度Natco公司)25 mg第1~21天,地塞米松20 mg第1~4天、第8~11天,28 d为1个疗程。其中有4例患者两者均使用。30例患者服用沙利度胺方案:沙利度胺(国药准字H32026129,常州制药厂有限公司)开始剂量为100 mg,每晚顿服,每周增加50~100 mg,至最大剂量400 mg或无法耐受时减为增加前剂量并维持口服;地塞米松40 mg/d,第1~4天、第9~12天和第17~20天分次餐后口服,每28天为1个疗程。
1.2疗效评价标准及监测项目
疗效判定参照国际骨髓瘤工作组(IMWG)标准[3]。分为完全缓解(complete remission,CR)、非常好的部分缓解(very good partial remission,VGPR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progression of disease,PD)。观察总反应率[(CR+VGPR+PR)例数/总例数×100%]、总体生存(overall surviva,OS)率及无进展生存(progression free survival,PFS)率。OS为自诊断开始到患者死亡或随访截止日期,进展或复发标准根据文献[7]标准判断;PFS从诊断开始计算,到疾病进展日或复发日或其他因素导致个体死亡日。最佳疗效为基础化疗方案诱导治疗后最佳疗效,不包括巩固强化(如HSCT)及维持治疗后所获得疗效。变量监测:疗程中监测肝肾功能、β2-微球蛋白(Beta2-microglobulin,β2-MG)、血清游离轻链、骨髓象,随访截止日期为2015年1月。
根据Iwama等的标准[4],治疗后血游离轻链比值(serum free light chain ratio,sFLCR)持续正常>4周者为正常化轻链比患者,反之为异常轻链比患者;对于κ轻链型者,κ/λ比值<0.26;或对λ轻链型κ/λ比值>1.65,考虑为假阳性结果。认为该项指标为MM的独立预后因素。
1.3统计学处理
采用SPSS 19.0软件对数据进行分析,采用Kaplan-Meier曲线方法进行生存分析,显著性检验采用Log-Rank方法,多因素采分析用Cox比例风险回归模型,以P<0.05为差异有统计学意义。
2结果
2.1一般临床结果
42例MM患者,其中IgG型18例,IgA型15例,轻链型9例;Durie-Salmon分期标准(DS分期):Ⅰ期2例(4.8%),Ⅱ期10例(23.8%),Ⅲ期30例(71.4%);按照国际预后指数(ISS)分期标准:Ⅰ期5例(11.9%),Ⅱ期14例(33.3%),Ⅲ期23例(54.7%)。实验室检查:血清白蛋白为(31.72±6.89)g/L,β2-MG为(5.92±3.06)mg/L,骨髓中异常浆细胞比例为(28.57±18.45)%。乳酸脱氢酶(LDH)为(232.14±125.93)g/L,血肌酐(Cr)为(102.74±58.48)μmol/L,血红蛋白为(91.86±24.60)g/L。
2.2疗效评价
42例MM患者中接受硼替佐米联合化疗12例,雷利度胺应用8例(4例患者两者均应用),沙利度胺应用30例;共反应率73.7%(CR率23.8%,VGPR率30.9%,PR率19.0%),SD率19.1%,PD7.2%。初治及难治复发患者CR率分别为29.2%和26.7%,总反应率分别为83.33%和72.78%,差异无统计学意义,
2.3预后因素分析
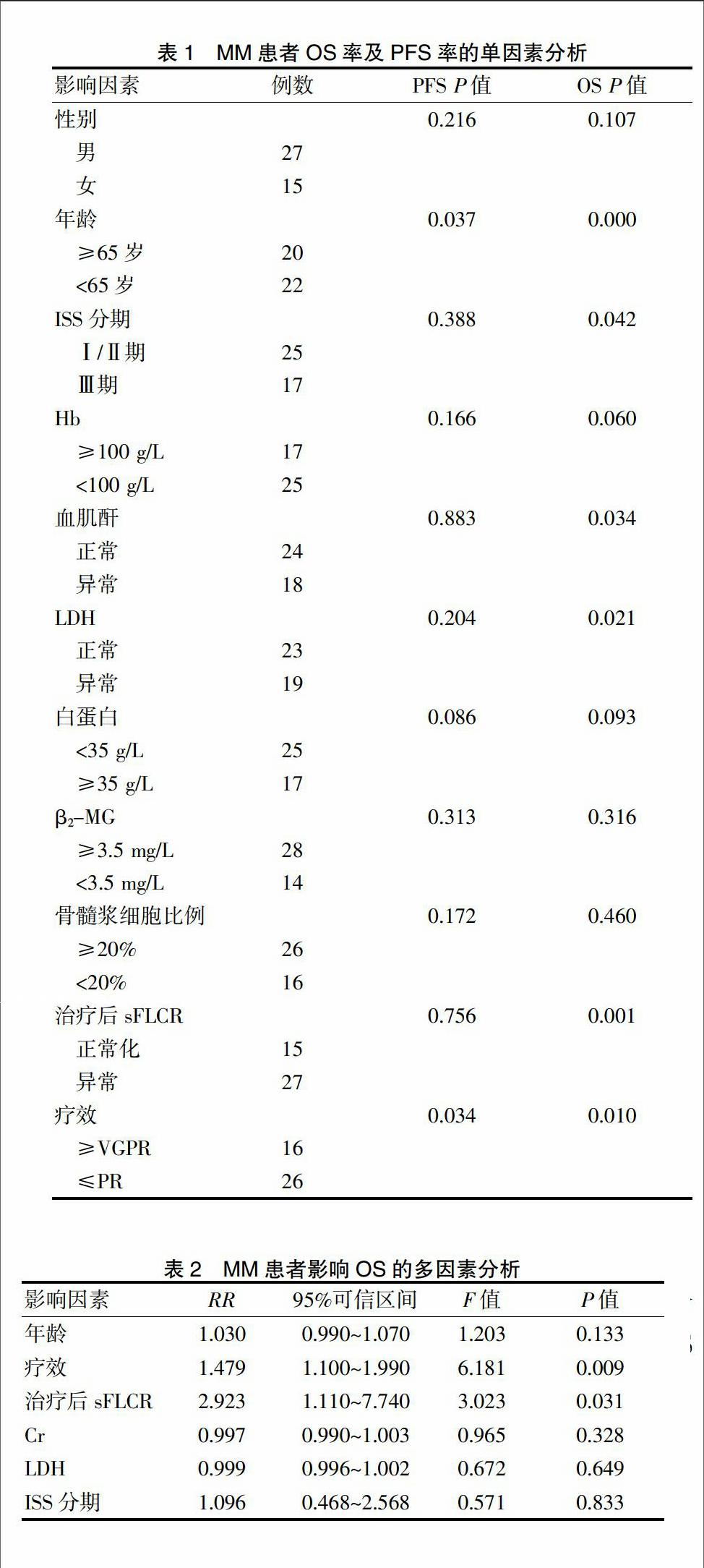
骨髓瘤患者OS及PFS率见图1、2,42例MM患者中2年、3年OS率分别为76.19%,42.86%;1、2、3年PFS分别为71.43%、26.19%、11.90%。
生存时间 (个月)
图2 多发性骨髓瘤的无病进展生存率
与OS相关的单因素分析显示,年龄≥65岁(P=0.000),ISS分期Ⅲ期(P=0.042),血肌酐异常增高(P=0.034),LDH异常增高(P=0.021),治疗后sFLCR未正常化(P=0.001),以及疗效差(P=0.010)与OS呈负相关(r=-0.823),而性别、血红蛋白、白蛋白、β2-MG、骨髓浆细胞比例与OS无相关性。与PFS有关的因素为年龄(P=0.037)及疗效(P=0.034)(表1)。
2.4多因素分析
对年龄、疗效、治疗后sFLCR、Cr、LDH及ISS分期进行多因素分析发现,疗效及治疗后sFLCR对OS有影响(P值分别为0.009及0.031)(表2)。
3讨论
MM传统预后因素与肿瘤负荷与临床病程相关,随着诊疗技术的提高,发现相关遗传学[5-6]及治疗后缓解质量亦影响MM患者预后[7]。Greipp等[3]把经过治疗后的sFLCR恢复正常持续>4周称为血清游离轻链正常化,他们认为sFLCR正常化可作为MM独立预后因素。
骨髓瘤新型药物如沙利度胺、雷利度胺和硼替佐米等的临床应用,显著提高了MM患者的近期疗效和远期生存。在影响OS的危险因素中,本文结果表明治疗效果对患者的长期生存有重要意义,这与以往的研究相一致[8-9]。因此,疗效达到CR及VGPR被认为是影响患者OS率的独立预后良好因素,表明MM患者治疗后缓解程度可作为判断预后的标志之一。排除了MM患者其他危险因素后发现,骨髓瘤治疗后的sFLCR正常化也是影响OS的独立危险因素。沙利度胺、雷那度胺、硼替佐米的应用,使MM治疗后sFLCR的正常时间亦有所延长,时间足够能使患者恢复正常的多克隆游离轻链,这时能够反映真正的sFLCR正常,有人认为该指标对OS有重要意义,对PFS意义不大[3];但也有学者研究发现正常化sFLCR与更长的PFS有关联,可提示MM良好的治疗前景[10]。本研究不论是单因素分析还是多因素分析,均提示MM治疗后的sFLCR正常化与OS有关联性,但与PFS无关。该指标在国内鲜有报道,在我科就诊的部分骨髓瘤患者初次就诊时未行游离轻链检测,因此无法了解患者初诊时的sFLCR情况,但有学者研究指出,MM患者初始的sFLCR水平与治疗效果无明显关系;该部分数据仍需进一步完善[11-12]。
在影响PFS的危险因素中,结果提示年龄有着明显影响,有文献报道各个不同年龄段MM的生物学特点均有明显差异性,而且高龄骨髓瘤患者基础状态、对化疗药物耐受程度均较年轻者受限制,其治疗亦受到以上多种因素的影响,化疗药物临床能否应用及应用剂量均与之有明显关联,导致治疗效果欠佳,生存期短[13]。有学者提出性别对患者的预后有影响[14-15],但本研究中未发现,可能与样本量小或样本选择有关。
本研究中PFS较短而OS相对较长,考虑与当前沙利度胺、雷那度胺、硼替佐米进入临床,患者用药选择相关。沙利度胺、雷那度胺、硼替佐米的应用解决了部分复发或难治性骨髓瘤生存几率的问题。在沙利度胺、雷那度胺、硼替佐米临床应用中相关预后因素需更多大样本研究,以有效评估患者临床预后[16-17]。
[参考文献]
[1]Palumbo A,Anderson K.Multiple myeloma[J].N Engl J Med,2011,364(11):1046-1060.
[2]Anderson KC,Alsina M,Atanackovic D,et al.Multiple Myeloma,version 2.2016: clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2015,13(11):1398-1435.
[3]Greipp PR,San Migue IJ,Durie BG,et al.International staging system for multiple myeloma[J].J Clin Oncol,2005,23(12):3412-3420.
[4]Iwama K,Chihara D,Tsuda K,et al.Normalization of free light chain kappa/lambda ratio is a robust prognostic indicator of favorable outcome in patients with multiple myeloma[J].Eur J Haematol,2013,29(10):134-141.
[5]Broyl A,Hose D,Lokhorst H,et al.Gene expression profiling for molecular classification of multiple myeloma in newly diagnosed patients[J].Blood,2010,116(14):2543-2553.
[6]vet Loiseau H,Durie BG,Cavo M,et al.Combining fluorescent in situ hybridization data with ISS staging improves risk assessment in myeloma:an International Myeloma Working Group collaborative project[J].Leukemia,2013,27(3):711-717.
[7]Ladetto M,Pagliano G,Ferrero S,et al.Major tumor shrinking and persistent molecular remissions after consolidation with bortezomib,thalidomide,and dexamethasone in patients with autografted myeioma[J].J Clin Oncol,2010,28(12):2077-2084.
[8]Martinez-Lopez J,Blade J,Mateos MV,et al.Long term prognostic significance of response in multiple myeloma after stem cell transplantation[J].Blood,2011,118(3):529-534.
[9]Moreau P,Attal M,Pégourié B,et al.Achievement of VGPR to induction therapy is an important prognostic factor for longer PFS in the IFM 2005-01 trial[J].Blood,2011,117(11):3041-3044.
[10]Paiva B,Martinez-Lopez J,Vidriales MB, et al.Comparison of immunofixation,serum free light chain,and immunophenotyping for response evaluation and prognostication in multiple myeloma[J].J Clin Oncol,2011,29(12):1627-1633.
[11]Murng SH,Follows L,Whitfield P,et al.Defining the impact of individual sample variability on routine immunoassay of serum free light chains (sFLC) in multiple myeloma[J].Clin Exp Immunol,2013,171(2):201-209.
[12]An N,Li X,Shen M,et al.Analysis of clinical features,treatment response,and prognosis among 61 elderly newly diagnosed multiple myeloma patients:a single-center report[J].World J Surg Oncol,2015,13:239.
[13]梁赜隐,任汉云,岑溪南,等.硼替佐米为基础的化疗方案治疗多发性骨髓瘤患者的疗效及预后因素分析[J].中华血液学杂志,2014,35(3):225-230.
[14]Bianchi G,Richardson PG,Anderson KC.Promising therapies in multiple myeloma[J].Blood,2015,126(3):300-310.
[15]陶中飞,傅卫军,陈玉宝,等.206 例多发性骨髓瘤预后因素分析及分期评价[J].癌症,2015,25(5):461-464.
[16]许戟,李春溟,张森森,等.多发性骨髓瘤浆细胞标记指数检测的临床意义研究[J].实用老年医学,2011,25(6):487-489.
[17]魏道林,赵初娴,赵旻,等.改良的以硼替佐米为基础的联合化疗方案治疗多发性骨髓瘤患者的临床疗效[J].中华血液学杂志,2014,35(9):854-856.
(收稿日期:2016-08-24 本文编辑:方菊花)

