Graves病对骨代谢相关指标及骨密度的影响
罗维思 冯燕红 李明星
(阳江市阳春人民医院内分泌科,广东 阳江 529600)
·临床实践·
Graves病对骨代谢相关指标及骨密度的影响
罗维思 冯燕红 李明星
(阳江市阳春人民医院内分泌科,广东 阳江 529600)
目的:探讨Graves病(GD)对骨代谢相关指标及骨密度(BMD)影响。方法:将2013年1月至2015年1月阳江市阳春人民医院收治的72例GD患者作为研究对象,同期健康体检者作为健康对照组(35例),其中GD患者分为GD伴低骨量组(22例)、GD伴OP组(17例)、单纯GD组(33例)。测定BMD、血清游离T3(FT3)、T4(FT4)、促甲状腺素(TSH)、骨钙素(BGP)、Ⅰ型前胶原N端前肽(P1NP)和Ⅰ型胶原羧基端降解产物(β-CTX)等指标。结果:GD患者血清BGP、P1NP、β-CTX、FT3、FT4、高于健康对照组(P<0.05),TSH低于健康对照组(P<0.05)。GD伴低骨量组及GD伴OP组各测量部位BMD值低于健康对照组(P<0.05)。结论:GD可导致高骨转换骨质疏松,治疗时注意BMD及骨代谢指标检测,积极防治疗骨质疏松。
甲亢;骨密度;骨代谢指标;骨质疏松
2010年,流行病学调查资料显示中国十大城市甲亢患病率为1.1%,其中最常见病因是自身免疫性疾病Graves病(Graves disease,GD)[1]。本研究通过对2013年1月至2015年1月本院收治的72例GD患者骨代谢相关指标及骨密度(bone mineral density,BMD)进行测定,以探讨甲亢患者BMD改变及其临床意义。
1 资料与方法
1.1 一般资料
本组GD患者72例,男33例,女39例;年龄17~65岁;病程1个月至12年;平均体重指数(17.9±2.1) kg/m2;均无肝、肾、骨关节及其他内分泌疾病,未服用引起骨质疏松症(osteoporosis,OP)和影响钙磷代谢的药物。
分组:GD伴低骨量组22例(30.5%),男10例,女12例;年龄17~63岁,平均年龄(46.3±11.1)岁;GD伴OP组17例(23.6%),男7例,女10例;年龄23~65岁,平均年龄(42.5±12.3)岁;单纯GD组33例(45.9%),男16例,女17例;年龄24~61岁,平均年龄(45.5±10.4)岁;健康对照组35例,男15例,女20例;平均年龄(41.2±7.9)岁,平均体重指数(21.1+2.1) kg/m2。
1.2 研究方法
采用双能X线吸收法测定BMD,以低于骨峰值均值2.0个标准差作为OP标准,低于骨峰值均值1.0~2.0个标准差作为低骨量标准。采集空腹静脉血,放免法测定骨钙素(BGP)、I型前胶原N端前肽(P1NP)和I型胶原羧基端降解产物(β-CTX)使用全自动生化分析仪测定血清游离T3(FT3)和T4(FT4)、促甲状腺素(TSH)。
1.3 统计学分析
2 结 果
GD组BGP 、P1NP、β-CTX血清FT3、FT4、高于健康对照组(P<0.05),TSH低于健康对照组(P<0.05)。GD伴低骨量组及GD伴OP组各测量部位BMD值低于健康对照组(P<0.05)。见表1~3。

表1 各组骨代谢生化指标比较
注:与健康对照组比较,*P<0.05。
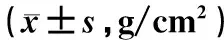
表2 各组各部位骨密度(BMD)测定结果
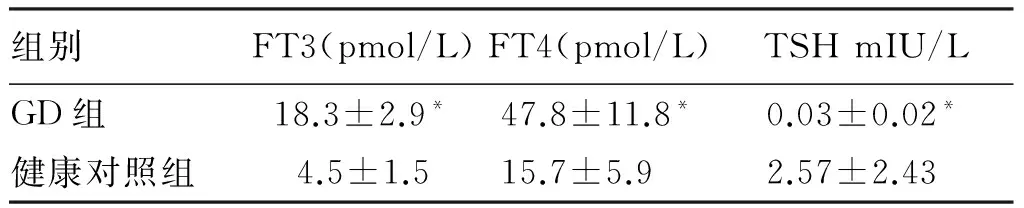
表3 两组受试者生化指标
注:与对照组比较,*P<0.01。
3 讨 论
骨组织由骨细胞和细胞间质构成,后者组成是骨基质和沉积的矿物质,骨基质90%为Ⅰ型胶原,Ⅰ型胶原反映骨形成和骨吸收的强度,由成骨、破骨细胞合成、降解。骨矿物质代谢受甲状腺激素(TH)、甲状旁腺激素、1,25二羟维生素D3(1,25(OH)2D3)共同调控、相互协调维持骨细胞活性、骨骼重建和钙代谢平衡。TH 在骨骼生长发育、基本代谢及转换中起到非常关键的作用。正常生理情况下,骨的重吸收和形成维持在一个稳定平衡的状态,成年人每年的骨转换率为10%左右。当各种因素导致骨的重吸收和形成失平衡时,可出现各种代谢性骨病。GD患者TH 分泌增多,引起一系列高代谢症状,其中约有20%~50%患者会发生钙磷镁等矿物质代谢紊乱导致骨量减少及和OP发生[2]。GD导致低骨量及OP的原因是多方面的:TH 分泌增加使成骨和破骨细胞活性增强,动员骨钙,同时骨胶原组织破坏增多,骨钙转换率增加,两者导致血钙过高,尿钙排泄量增加;TH 增多导致甲状旁腺激素、1,25(OH)2D3分泌异常,造成骨矿物质代谢异常;TH 直接作用于肾小管,对磷的重吸收减少,尿钙排出增加,呈负钙平衡;GD肠蠕动加快,吸收钙减少,引起血钙降低,机体为维持正常血钙浓度,动员骨钙入血致骨量丢失,加上合并糖代谢紊乱,血糖、尿糖升高,分解代谢增强,加重骨代谢紊乱;GD高代谢状态促进蛋白质分解排泄,同时消耗了钙、磷、镁等元素,骨骼的蛋白质基质形成减少及分解增加,钙大量丢失,骨骼脱钙和骨吸收增加;TH 升高促骨吸收的多种细胞因子水平升高,破骨细胞分化因子表达增加,诱导破骨细胞分化成熟,骨吸收增加。
临床OP诊断的“黄金标准”是双能X线吸收法测定的BMD[3],BMD是评估OP骨折风险、监测自然病程和评估药物疗效的推荐手段。但BMD变化缓慢,药物干预后,至少需要12~18个月才有明显变化,不利于及时评估药物干预的疗效及监测自然病程变化。国际骨质疏松基金会(IOF)、国际临床化学与实验医学联合会(IFCC)、中国骨质疏松学会推荐对OP患者,在BMD测定的基础上,监测骨转换生化标志物(BTM)。骨形成与骨吸收指标PINP、β-CTX作为BTM参考分析物,两者敏感性较高、影响因素较少[4]。临床检测BTM样本易采集、无创、检测时间短、价格合理,提供的信息与BMD相辅相成,有利判断骨转换类型、骨折风险、病情进展评估和指导治疗措施的选择。P1NP是新骨形成的特异和敏感指标[5],反映成骨细胞活性和I型胶原合成情况,与骨形成和钙的稳态相关,分子量大,不能由肾脏过滤清除,由肝脏代谢清除;β-CTX是骨吸收过程中I型胶原被降解后释放入血的片段,从肾脏排泄,反映破骨细胞活性和I型胶原降解情况,与骨重吸收程度相关,对抗骨吸收治疗反应迅速而灵敏,用于OP治疗时出现快速且剧烈的反应,能针对治疗提供早期信息,指导药物种类、剂量以及疗程的选择,帮助建立药物治疗原则以及明确作用机制;BGP是骨组织中能结合钙的蛋白质,主要功能是维持骨的矿化,其浓度升高提示骨转换增加。
本研究结果显示,GD具有较高低骨量和OP患病比例,占54.1%。与国内的相关报道结论相近[2];GD无论是否合并低骨量及OP,BGP 、P1NP、β-CTX 高于对照组,来源于成骨细胞的BGP 、P1NP增高,提示成骨细胞活性增强[6],骨代谢活跃和骨形成加速,而血清β-CTX较对照组明显增高,表明过量的TH刺激破骨细胞活动使其活性及数量增强,过度骨吸收,两者相比破骨细胞活动较成骨细胞活动增强占主导,骨吸收及骨形成失衡,高骨转换率是GD合并低骨量及OP患者的显著特征[7];GD血清FT3、FT4升高,TSH明显降低,成骨及破骨指标与TSH活性及数量呈负相关,高TH水平是影响骨转换速率和OP的重要因素。因此临床要对GD患者BMD及BTM检测,尽早进行相关风险评估,降低OP发生率。避免甲亢代谢性骨病在GD治疗时要尽快恢复及保持TSH控制在正常范围[8],以利于骨的重建。
[1] 王 亮, 刘安宁, 王亚兰, 等. 甲状腺功能亢进患者骨密度和血清骨代谢指标的变化及相关性分析[J]. 临床荟萃, 2013,21(10):1141-1142.
[2] 刘忠厚.骨质疏松学[M].北京: 科学出版社, 1998:558-556.
[3] 张 伟, 李石玲. 骨质疏松症诊断与骨密度测定方法[J]. 中华生物医学工程杂志, 2012,18(1):81-84.
[4] 黄 灵,李晓牧,凌 雁,等. Graves病患者骨质疏松患病情况及骨转换指标特征[J].中华内分泌代谢杂志,2011,31(11):21-32.
[5] 陈 玮,徐 将,陈 超 .中青年甲亢患者血清PINP、β-CTx与骨密度关系分析[J].安徽医科大学学报, 2014,10(6):10-12.
[6] 王维力.骨矿疾病[M].天津:天津科技翻译出版社, 1997: 225-253.
[7] 张 梅,刘 超,甲状腺激素和骨骼健康[J].中国骨质疏松杂志, 2003,9(2): 185-187.
[8] 李婷婷,张 锦,曾 华,等.抗甲状腺药物治疗对Graves病患者骨代谢的影响[J].广东医学, 2013,12(22): 21-24.
(本文编辑:张辉)
Effects of Graves disease on bone metabolism-related indexes and bone mineral density
LuoWeisi,FengYanhong,LiMingxing
(DepartmentofEndocrinology,YangchunMunicipalPeople′sHospital,Yangjiang,Guangdong529600,China)
Objective:To investigate the effects of Graves disease (GD) on bone metabolism-related indexes and the bone mineral density (BMD). Methods: Seventy-two GD patients hospitalized in Yangchun Municipal People′s Hospital between January 2013 and January 2015 were included as the subjects in the study, and a contemporary cohort of healthy subjects were included in the healthy control group (n=35). The GD patients were divided into the GD and low bone mass group (n=22), GD and Osteorosis Pathology (OP) group (n=17), and simple GD group (n=33). The indexes, including BMD, serum free triiodothyronine T3, T4 (FT3, FT4), thyroid stimulating hormone (TSH), bone Gla protein (BGP), type I procollagen N-terminal propeptide (N P1NP) and type I collagen C-terminal degradation product (β-CTX) were determined. Results: The serum FT3, FT4, BGP, P1NP and β-CTX in GD patients were higher than those in the healthy control group (P<0.05), whereas the TSH in GD patients was lower than that in the healthy control group (P<0.05). The BMD values of the determined sites in the GD and low bone mass and the GD and OP group were lower than those in the healthy control group (P<0.05). Conclusion: GD can lead to high bone turnover in osteoporosis (OP). The determination of BMD and bone metabolism-related indexes should be paid attention, and the active prevention and treatment of OP should be taken in the treatment of GD.
hyperthyroidism; bone mineral density; bone metabolism indexes; osteoporosis
10.3969/j.issn.2095-9664.2015.04.025
罗维思(1966-),女,本科,副主任医师。
R581.1
A
2095-9664(2015)04-0086-03
2015-02-20)
研究方向:内分泌疾病。

