慢性缺氧对大鼠肺静脉平滑肌细胞内钙离子浓度的影响
胡锦兴 彭德虎 梁小朋 罗立全 林 媛 蔡琼娣 罗 炜 林兆原
(广州市胸科医院肺外结核八内科,广东 广州 510095)
·论著·
慢性缺氧对大鼠肺静脉平滑肌细胞内钙离子浓度的影响
胡锦兴*彭德虎 梁小朋 罗立全 林 媛 蔡琼娣 罗 炜 林兆原
(广州市胸科医院肺外结核八内科,广东 广州 510095)
目的:探索原代培养肺动脉高压模型大鼠肺静脉平滑肌细胞(PVSMCs)是否具有血管平滑肌功能及L型电压依赖性钙通道(VDCC)阻断剂硝苯地平对其细胞内钙离子浓度([Ca2+]i)的影响,为慢性缺氧性肺动脉高压发病机制的研究提供理论依据。方法:用显微镜操作和胶原酶消化法分离、培养肺动脉高压模型大鼠肺静脉平滑肌细胞,鉴定培养的细胞及计算纯度,利用细胞内钙离子浓度检测系统观察慢性缺氧对PVSMCs静息[Ca2+]i的影响及硝苯地平的干预作用。结果:该方法培养的肺动脉高压模型造模的PVSMCs呈典型的平滑肌特性,表现为“峰-谷”状生长,免疫化学α-Actin鉴定显色,而且培养纯度达到98%;慢性缺氧能使PVSMCs的静息[Ca2+]i从(104.3±7.9) nmol/L提高到(197.9±11.8) nmol/L(P<0.05);5 mmol/L的硝苯地平能完全阻断慢性缺氧PVSMCs的[Ca2+]i对高钾溶液的反应。结论:慢性缺氧可使PVSMCs的静息[Ca2+]i升高,其机制可能与激活PVSMCs的VDCC导致细胞外Ca2+内流有关。
肺静脉平滑肌细胞;慢性缺氧;硝苯地平;细胞内钙离子浓度
肺动脉高压(pulmonary hypertension,PH)是大部分慢性阻塞性肺疾病(COPD)最终发展成为肺心病而死亡的主要原因,PH的发病机制十分复杂,经过几十年的研究,人们认识肺高压的特点就是血管重构和肺血管平滑肌中Ca2+稳态改变,细胞内Ca2+在血管平滑肌细胞的收缩和增生的复杂机制中起至关重要的作用[1]。研究表明,急性缺氧能导致肺静脉收缩,而慢性低氧也能导致肺静脉血管重塑[2-4]。另外,肺静脉同肺动脉及毛细血管网一样是形成肺循环阻力的主要部分之一,缺氧情况下下肺静脉血管阻力改变也会影响肺循环阻力,进而影响肺动脉压力[5-6]。本研究通过原代培养大鼠远端肺静脉平滑胎细胞(pulmonary venous smooth muscle cells,PVSMCs),借助荧光显微镜及细胞内钙离子浓度检测系统观察慢性缺氧对大鼠远端PVSMCs的[Ca2+]i影响,从而初步探索慢性缺氧导致肺静脉重塑的可能机制。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级SD雄性大鼠,体质量200~250 g,由广东省实验动物中心提供。
1.1.2 主要试剂和仪器 体式显微镜(日本 Nikon SMZ1000),0.1 mm直头显微镊、0.3 mm弯头显微镊、0.15 mm显微剪(上海金钟),倒置相差显微镜(德国 Leica),激光扫描共聚焦显微镜(日本 Nikon),Ⅰ型胶原酶、木瓜酶、牛血清白蛋白(BSA)、Triton X-100、小鼠抗大鼠平滑肌α-actin单克隆一抗、硝苯地平、NaCl、KCl、KH2PO4、MgSO4(美国Sigma),PBS、DMEM培养基、Ham′S F-12、胎牛血清(美国 Gibco),CyTM3偶联山羊抗小鼠IgG二抗(美国 Jackson ImmunoResearch),细胞核荧光染料YO-PRO-1、Fura-3 AM(美国 Invitrogen), PClamp软件记录(美国Axon公司)。
1.2 方法
1.2.1 肺动脉高压模型建立与鉴定 密闭缺氧箱内放置2个氧浓度探测器,控制N2阀门,控制箱内氧浓度在10%,一旦氧浓度高于10%,氮气阀门自动打开灌入氮气,平衡箱内氧浓度。同时向缺氧箱持续泵入空气,一方面防止氧浓度过低,另一方面用以维持正常的CO2浓度,减少CO2对实验结果的影响。随机选取10只健康SD大鼠放入缺氧箱内3周作为缺氧组,每周更换鼠笼1次并补充饲料和水,同种同龄雄性鼠在正常条件下饲养作为对照组。饲养3周后处死,剪下右心室,左心室、分离室间隔称重,测右心室/(左心室+室间隔重量)[RV/(LV+S)]。缺氧组右心室/(左心室+室间隔重量)为0.512±0.053,与对照组的0.343±0.048比较,差异有统计学意义,说明造模成功。
1.2.2 大鼠远端肺静脉平滑肌细胞原代培养 称量SD大鼠,按50 mg/kg腹腔注射苯巴比妥钠麻醉大鼠后,剪开胸腔,迅速离断并取出心脏和左右肺,浸入预冷的2 mmol/L Ca2+HBSS溶液中,解剖显微镜下用显微镊、剪分离出各叶肺静脉,去除血管外膜黏附的结缔组织和脂肪组织,纵向剪开血管,用棉签轻拭血管内表面以去除内皮细胞。将分离出的肺静脉置于2 mmol/L Ca2+HBSS溶液中,冰上放置45 min,然后转移到20 μM Ca2+HBSS溶液中室温放置20 min。加入2.5 mL消化液并置于37 ℃消化23 min,注意消化时切勿密闭试管,消化至21 min时可取出观察消化程度以及时按情况调节消化时间。将1.5 mL消化液倒入10 mL Ca2+HBSS液中终止消化。小心取出血管,置于1 mL过滤的无 Ca2+HBSS液中,用切去箭头的l mL枪头小心轻柔吹散消化过的血管,约25~35次,镜下观察吹打是否合适及完全,制成细胞悬液以5×107/L-1接种于6孔板中的载玻片(使用前100%酒精擦拭,过火,紫外照射15 min)中央,静置20 min。小心加入2 mL Ham′SF-12+0.5%胎牛血清培养基,置于37 ℃和5%的CO2孵箱,12 h后换成含10%DMEM培养基培养5~6 d,实验前12 h又换成Ham′SF-12+0.5%胎牛血清培养基培养12 h。
1.2.3 细胞形态学观察PVSMC 应用倒置相差显微镜观察细胞形态、大小及生长特点。
1.2.4 免疫荧光法鉴定PVSMC 使用平滑肌α-actin单克隆抗体对培养的细胞进行鉴定,吸除细胞培养基,用PBS清洗2次后,多聚甲醛固定15 min,PBS清洗3次,每次2 min,5%BSA室温封闭30 min,加1∶400稀释的小鼠抗大鼠平滑肌α-actin单克隆一抗,湿盒内40℃过夜,阴性对照组加入PBS代替一抗,PBS清洗3次,每次5min,再加入1∶500 CyTM3偶联山羊抗小鼠IgG二抗室温避光孵育2 h,PBS清洗3次,每次5 min,加入3.5 μL/mL的YO-PRO-A液体室温避光1 min,用50%缓冲甘油封片后激光共聚焦荧光显微镜下观察。
1.2.5 PVSMC细胞内[Ca2+]i的检测 用可以透过细胞膜的Ca2+敏感的荧光染料Fura-3 AM检测PVSMC细胞内[Ca2+]i,Fura-3 AM溶解于20%普朗尼克酸溶液的DMSO中。室温下,细胞在Tyrode溶液中用Fura-3 AM(终浓度为5 μmol/L)负载40 min后,用Tyrode溶液充分冲洗细胞外Fura-3 AM,室温静置20min,使胞质中染料完全脱脂。关闭显微镜可视灯,打开荧光比/成像系统,设置激发波长为480 nm,发射波长为 535 nm,采样时间为 35 ms/s,记录时间为 45 min。高速荧光光源输出激发光(波长 480 nm),激发光经倒置显微镜的超级荧光型油镜后,作用于PVSMCs,产生的发射光经带通滤镜(535/40 nm)后,由光-电倍增管(PMT)输入计算机,荧光信号比率(F/F0)经PClamp软件记录与分析。
1.3 统计学分析
2 结 果
2.1 细胞生长的形态学鉴定
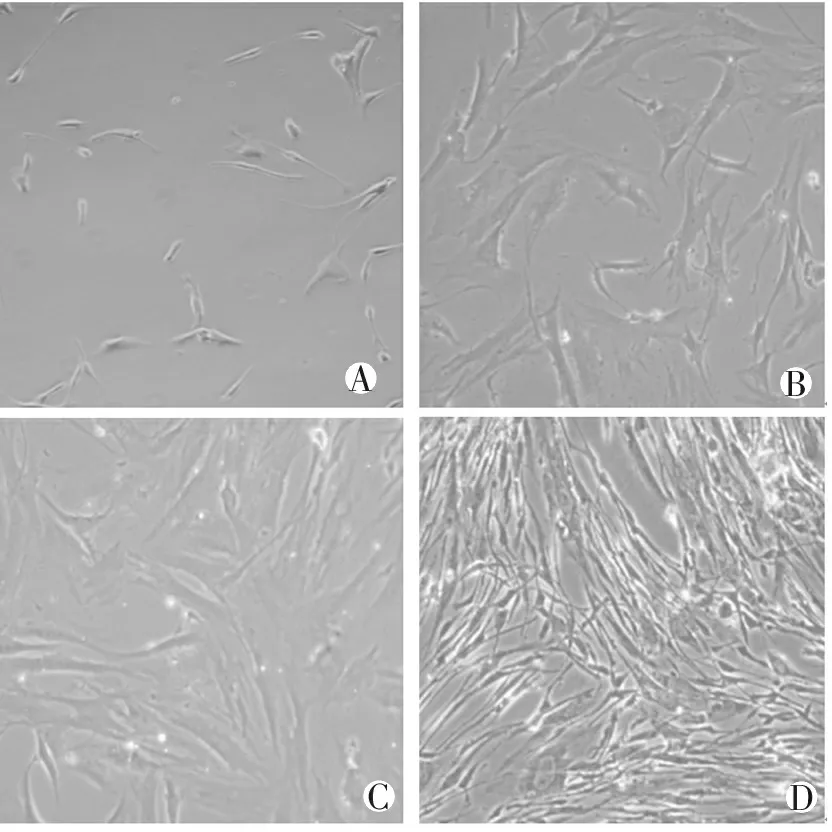
在倒置相差显微镜下观察,刚消化下来并种植的细胞呈圆形或长圆形、透亮及大部分单个均匀分布,1 h后大部分可以贴壁,慢慢恢复长梭形,1 d后观察,细胞展开,少量未贴壁细胞上浮死亡,见图1A;3 d后观察,细胞贴壁生长良好,呈现长梭形为主,细胞中间凸起的部分含有细胞核, 见图1B;4~6 d细胞彼此交织成网状, 见图1C;7 d后细胞上满整个培养皿的底面,呈长梭形,表现出典型的“峰-谷”状生长,见图1D。
BACD
注:A:酶消化后1 d展开的细胞;B:3 d后细胞呈长梭形;
C:5 d后细胞交织成网;D:7 d后细胞“峰-谷”状生长
图1 倒置相差显微镜下观察肺动脉高压模型
大鼠远端PVSMCs(×100)
2.2 细胞荧光免疫法鉴定PVSMC培养细胞
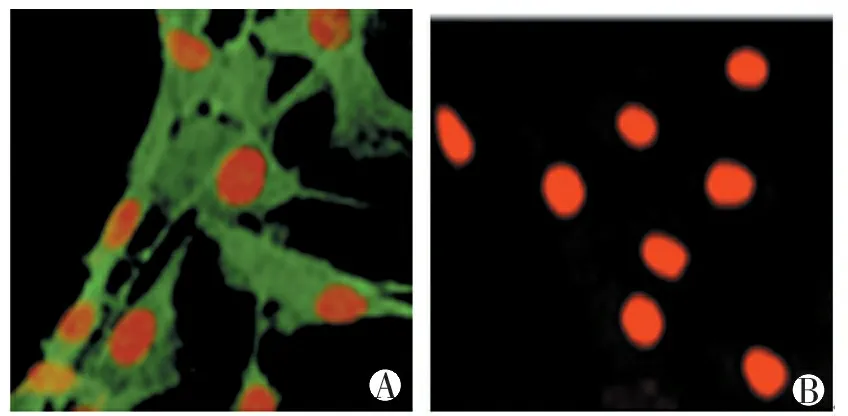
在激光扫描共聚焦显微镜下,培养细胞对平滑肌α-actin免疫荧光显色呈阳性反应,细胞质中填满了典型的、平行排列的、红色荧光显色的平滑肌α-actin蛋白,见图2A。在没有用一抗孵育的对照组细胞,呈阴性反应,见图2B。
BA
图2 肺动脉高压模型大鼠远端PVSMCs α-actin免疫荧光染色(400×)
2.3 慢性缺氧对PVSMCs的细胞内静息Ca2+浓度的影响
常氧组肺静脉平滑肌细胞静息钙离子浓度为(104.3±7.9) nmol/L,而慢性缺氧性肺动脉高压组肺静脉平滑肌细胞静息钙离子浓度为(197.9±11.8) nmol/L,两组比较,差异有统计学意义(P<0.05)。
2.4 硝苯地平对KCl诱导PVSMC细胞内[Ca2+]i升高的影响
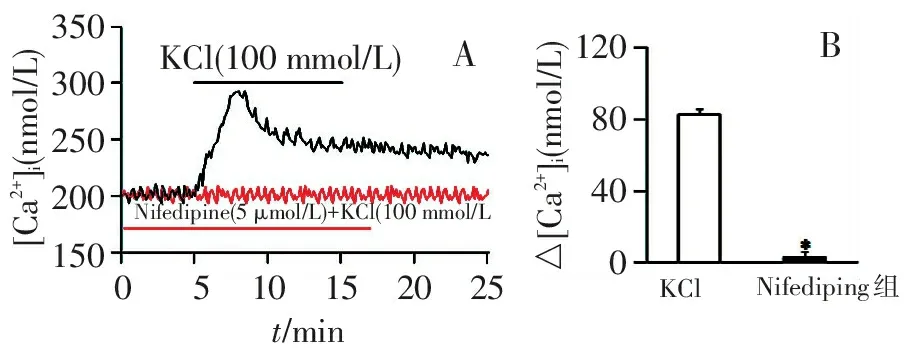
KCl组细胞先用Tyrode溶液孵育5 min,换用100 nmol/L KCl溶液孵育细胞后,PVSMCs的[Ca2+]i从(203.6±10.8) nmol/L升高到(290.5±6.5) nmol/L(P<0.05),△[Ca2+]i达到(83.4±9.8)nmol/L;10 min后,再改用Tyrode溶液孵育细胞,PVSMCs的[Ca2+]i逐渐恢复。硝苯地平干预组PVSMCs的[Ca2+]i的△[Ca2+]i仅仅是(8.4±1.5) nmol/L,与KCl组比较,差异有统计学意义(P<0.05)。见图3。
350300250200150KCl(100mmol/L)[Ca2+]i(nmol/L)Nifedipine(5μmol/L)+KCl(100mmol/L1015202505t/min12080400KClNifediping组△[Ca2+]i(nmol/L)AB
注:A:两组引起的钙离子信号变化;B:两组钙离子变化的绝对值;与KCl组比较,*P<0.05
图3 硝苯地平阻断高钾对慢性缺氧大鼠远端PVSMCs的[Ca2+]i的影响
3 讨 论
PH是由不同发病机制引起的,以肺动脉压力超过一定界值为特征的多种疾病所共有的一组临床病理生理综合征[7-8]。慢性缺氧引起肺血管重塑是PH发病的主要环节之一,不仅发生在肺动脉,也包括肺静脉[8]。因此,本实验采用显微镜及酶消化法原代培养慢性肺动脉高压模型大鼠远端PVSMCs培养获得的细胞 “峰-谷”状生长,具有典型的平滑肌细胞形态学特性。平滑肌α-actin蛋白是血管平滑肌表达的特征蛋白,国内外文献多有报道[9]。本实验培养的PVSMCs免疫荧光可见细胞内大量肌丝,且平滑肌纯度达到98%,运用该细胞探讨了慢性缺氧对其[Ca2+]i的影响及可能机制。
L-型电压依赖性钙通道是血管平滑肌广泛存在的一种钙通道,基础状态下,各种钙通道介导钙内流维持血管基础张力,如电压依赖性钙通道(L-VDCC)、钙池操纵性钙通道(SOCC)及受体操纵性钙通道(ROCC)等[10-11]。
本研究结果显示,慢性缺氧可导致PVSMCs静息[Ca2+]i的升高,尽管静息[Ca2+]i的升高需要细胞外钙离子的内流,但是,硝苯地平可以完全抑制KCL诱导的[Ca2+]i的升高,确对静息[Ca2+]i不产生影响,这表明PVSMCs静息[Ca2+]i的升高主要通过非L型依赖的钙离子通道途径激活。有许多研究表明,暴露于慢性缺氧可使肺血管平滑肌细胞去极化[12-13],我们推测,慢性缺氧导致PVSMCs静息[Ca2+]i的升高进而激活L型钙离子通道,从而使PVSMCs去极化,产生一系列的电生理反应。慢性缺氧激活大鼠远端PVSMCs的非L型依赖的钙通道的具体机制尚有待进一步研究。
综上所述,本研究培养所获得的PVSMCs不仅具有典型的血管平滑肌细胞形态学和免疫学结构特征,同时表现出良好的血管平滑肌细胞生理功能;慢性缺氧能引起PVSMCs静息[Ca2+]i的升高,其可能是通过非L型依赖的钙离子通道途径激活,提示慢性缺氧引起的PVSMCs[Ca2+]i的升高在肺静脉重塑过程中可能发挥独特作用
[1] Wang J, Weigand L, Lu W, et al. Hypoxia inducible factor 1 mediates hypoxia-induced TRPC expression and elevated intracellular Ca2+in pulmonary arterial smooth muscle cells[J]. Circ Res,2006,98(12):1528-1537.
[2] Wagenvoort CA, Wagenvoort N. Pulmonary venous changes in chronic hypoxia[J]. Virchows Arch A Pathol Anat Histol,1976,372(1):51-56.
[3] Takahashi H, Soma S, Muramatsu M, et al. Upregulation of ET-1 and its receptors and remodeling in small pulmonary veins under hypoxic conditions[J]. Am J Physiol Lung Cell Mol Physiol,2001,280(6):L1104-L1114.
[4] Uzun O, Tuncay DA. Involvement of tyrosine kinase pathway in acute hypoxic vasoconstriction in sheep isolated pulmonary vein[J]. Vascul Pharmacol,2003,40(3):175-181.
[5] Schindler MB, Hislop AA, Haworth SG. Postnatal changes in pulmonary vein responses to endothelin-1 in the normal and chronically hypoxic lung[J]. Am J Physiol Lung Cell Mol Physiol,2007,292(5):L1273-L1279.
[6] Gao Y, Raj JU. Role of veins in regulation of pulmonary circulation[J]. Am J Physiol Lung Cell Mol Physiol,2005,288(2):L213-L226.
[7] Liu C, Chen J, Gao Y, et al. Endothelin receptor antagonists for pulmonary arterial hypertension[J]. Cochrane Database Syst Rev,2013,2(10):D4434.
[8] 陈 芳, 汤 彦. 肺动脉高压的发病机制、治疗进展[J]. 中华生物医学工程杂志, 2006, 12(1): 80-84.
[9] Cairrao E, Santos-Silva AJ, Alvarez E, et al. Isolation and culture of human umbilical artery smooth muscle cells expressing functional calcium channels[J]. In Vitro Cell Dev Biol Anim,2009,45(3-4):175-184.
[10] Lin MJ, Leung GP, Zhang WM, et al. Chronic hypoxia-induced upregulation of store-operated and receptor-operated Ca2+channels in pulmonary arterial smooth muscle cells: a novel mechanism of hypoxic pulmonary hypertension[J]. Circ Res,2004,95(5):496-505.
[11] Liu XR, Zhang MF, Yang N, et al. Enhanced store-operated Ca(2)+ entry and TRPC channel expression in pulmonary arteries of monocrotaline-induced pulmonary hypertensive rats[J]. Am J Physiol Cell Physiol,2012,302(1):C77-C87.
[12] Peng W, Michael JR, Hoidal JR, et al. ET-1 modulates KCa-channel activity and arterial tension in normoxic and hypoxic human pulmonary vasculature[J]. Am J Physiol,1998,275(4 Pt 1):L729-L739.
[13] Shimoda LA, Sylvester JT, Sham J S. Chronic hypoxia alters effects of endothelin and angiotensin on K+currents in pulmonary arterial myocytes[J]. Am J Physiol,1999,277(3 Pt 1):L431-L439.
(本文编辑:欧阳菁)
Effect of chronic hypoxia on intracellular calcium ion concentration in rat pulmonary venous smooth muscle cells
HuJinxing,PengDehu,LiangXiaopeng,LuoLiquan,LinYuan,CaiQiongdi,LuoWei,LinZhaoyuan
(DepartmentofExtra-pulmonaryTuberculosis,GuangzhouChestHospital,Guangzhou510095,China)
Objective:To determine whether the primary culture of pulmonary venous smooth muscle cells (PVSMCs) from rats with pulmonary hypertension exhibit functions of vascular smooth muscles, and effect of L-type voltage-dependent Ca2+channel (VDCC) antagonist nifedipine on intracellular calcium ion concentration of PVSMCs, so as to provide scientific evidence for research on pathogenic role of chronic hypoxia in development of pulmonary hypertension. Methods: Microscopic operations and collagenase digestion were performed to isolate and culture the PVSMCs from rat model of chronic hypoxia. The PVSMCs were identified and studied for the purity of cultured cells. The effects of chronic hypoxia on resting [Ca2+]iin PVSMCs and the interventional role of nifedipine were examined with InCyte [Ca2+]imeasurement system. Results: The PVSMCs from rat model of pulmonary hypertension showed typical features of smooth muscles as reflected by “peak and trough” growth pattern and positive immunohistochemical staining of α-actin. The purity of PVSMCs reached 98%. Resting [Ca2+]iin PVSMCs was significantly elevated to (197.9±11.8) nmol/L from 104.3±7.9 nmol/L by chronic hypoxia (P<0.05).5mmol/L Nifedipine was shown to completely block the PVSMC [Ca2+]iresponse to KCL. Conclusion: Chronic hypoxia increases the resting [Ca2+]iin rat PVSMCs probably via activation of VDCC in PVSMCs which in turn results in influx of extracellular Ca2+.
pulmonary venous smooth muscle cells; chronic hypoxia; nifedipine; intracellular Ca2+concentration
10.3969/j.issn.2095-9664.2015.04.002
胡锦兴(1980-),男,博士,主治医师。
R543.2
A
2095-9664(2015)04-0005-04
2015-02-17)
研究方向:肺动脉高压及肺结核疾病。
*通讯作者:E-mail:hujinxing2000@163.com

