KOH溶液中CeO2-Pd/C对乙醇的电催化研究
刘畅,田丹妮,周新文,代忠旭,2
(1.三峡大学生物与制药学院,湖北宜昌443002;2.三峡大学材料与化工学院,湖北宜昌443002)
KOH溶液中CeO2-Pd/C对乙醇的电催化研究
刘畅1,田丹妮1,周新文1,代忠旭1,2
(1.三峡大学生物与制药学院,湖北宜昌443002;2.三峡大学材料与化工学院,湖北宜昌443002)
摘要:用液相还原法制得CeO2-Pd/C催化剂样品,研究Ce元素对Pd/C催化氧化乙醇能力的影响.通过XRD,循环伏安和计时电流法对实验样品进行了结构表征和催化氧化乙醇行为测试.结果表明,在碱性条件下,CeO2有助于提升Pd/C对乙醇的催化氧化能力.当n(Pd)∶n(CeO2)=2∶1(摩尔比)时,催化效率达到峰值.但当Pd和CeO2的摩尔比达到1∶2后,继续增加CeO2的量,其氧化电量基本保持平稳.样品中,Pd和CeO2的摩尔比达到1∶2之前,CeO2可以作为Pd的助催化剂;当Pd和CeO2的摩尔比达到1∶2之后,CeO2不再作为助催化剂,而可能是成为了催化剂的载体.①
关键词:Pd;CeO2;乙醇;电氧化
0 引言
乙醇作为一种液态燃料,具有储运方便、无毒、来源广泛、比甲醇的能量密度高等特点.这些特点使直接乙醇燃料电池(DEFCs)具有较好的应用前景[1-2].直接乙醇燃料电池中,常用的阳极催化剂是Pt及Pt合金,如Pt-Sn[3],Pt-Ru[4]等.但Pt价格昂贵,且Pt在乙醇的氧化过程中容易CO中毒[5],导致其催化活性降低.Pd的价格仅为Pt的三分之一左右,研究表明,Pd在碱性介质中显示出可与Pt媲美的催化氧化活性[6-10].
由于金属氧化物微观结构中可能存在的氧空位或能够吸附含氧物种的原因,所以是一类重要的异相催化剂.氧化物如CeO2,Y2O3,NiOx,CoOx和MnOx都是CO低温化学氧化很好的催化剂.氧化物作为Pd的助催化剂在酸性溶液中可使Pd电化学氧化甲醇的催化活性得到一定的提高.其中最受关注的是CeO2,由于其独特的特性、结构、贮备和释放氧的能力,CeO2可以提高贵金属Pd对CO化学氧化的活性. CeO2在燃料电池阳极中处于部分还原态,水在还原态Ce3+部位产生OH基团,OH基团可与吸附于Pd表面上的CO发生反应,使得Pd催化剂能有效预防中毒,提升催化剂的抗中毒能力.
本文中用液相还原法制备了几种不同摩尔比例的CeO2-Pd/C催化剂,摸索得到它对乙醇催化氧化效率最高时对应的Pd和Ce的比值.还比较了样品掺Ce元素前后,Pd对乙醇的催化氧化行为及其抗中毒能力的变化.
1 实验部分
1.1主要试剂和实验仪器实验研究所涉及的PdCl2,NaBH4,Ce(NO3)3·6H2O,KOH等药品均为分析纯,均用二次蒸馏水配制溶液.BP-2000炭黑载体为电池级.
X线衍射仪(Ultima IV,日本)表征样品结构.样品对乙醇催化氧化行为检测均在电化学工作系统(瑞士万通,Autolab PGSTAT12型)上完成.所有性能测试在室温下进行.
1.2催化剂样品制备取适量硝酸铈和炭黑于二次蒸馏水中,搅拌均匀.逐滴加入氨水,超声搅拌均匀,90℃下加热1.5 h,过滤,干燥.干燥后放入马弗炉,450℃反应4 h,自然冷却得到CeO2/C样品.
称取一定量CeO2/C,加入一定量0.01 mol/L PdCl2溶液,超声振荡30 min,控制溶液pH值为9~10,在搅拌下缓慢滴加过量新配制的NaBH4溶液,在50~70℃下反应8~10 h,过滤,并用二次水洗涤沉淀、干燥,制得CeO2-Pd/C样品.
1.3样品的电催化性能测试取4 mg所得CeO2-Pd/C样品置于0.5 mL无水乙醇中,超声震荡得黑色悬浮液,移取3 mL悬浮液至处理好的玻碳电极表面,干燥后移取2 mL 0.5%Nafion溶液滴于玻碳电极上,干燥得到CeO2-Pd/C电极.采用CeO2-Pd/C研究电极、Pt电极和SCE电极组成的三电极系统.电解质溶液为含2.0 mol/L C2H5OH的1.0 mol/L KOH溶液.CV扫描范围为-0.8~0.3 V,扫速为50 mV/s.为便于样品间的相互比较,归一化到每mg Pd表示电流密度.所有实验均在室温下完成.
2 结果与讨论
图1是CeO2-Pd/C粉末样品的XRD图.为了便于比较,Pd/C粉末样品的XRD图谱也在图中给出.从图1中可以清楚地看出,图中2θ为40.2°,46.6°,68.1°处的衍射峰对应于Pd的面心立方(fcc)相结构(PDF No. 05-0681卡片)的参数,分别对应Pd(111),(200)和(220)晶面.金属Ce的(111),(220)和(311)晶面衍射峰对应位置分别为30.06,50.08和59.60.XRD图谱中,与Ce的标准谱图(PDF No. 00-001-0887卡片)对比,没有发现Ce金属单质的特征衍射峰.图中在26.7°,46.6°和54.8°的衍射峰归属于CeO(2PDF No.00-034-0394卡片)的(111),(220)和(311)晶面.这说明Ce元素在样品中以CeO2形式存在.随后掺入CeO2的Pd/C样品,都可用CeO2-Pd/C表示.
图2是CeO2-Pd/C,CeO2/C和Pd/C在含2 mol/L乙醇的1 mol/L KOH溶液中的循环伏安曲线.从图中可以看出,CeO2/C对乙醇本身基本没有催化活性.当催化剂样品中引入了Ce元素后,样品在含乙醇的KOH溶液中的CV曲线形状与空白样品一样,但CV曲线的峰电流密度大幅度增加,峰电位变化幅度并不显著,阳极化曲线与零电流密度线之间围成的面积(可看成是乙醇被氧化的电量或者质量)明显增加,这说明样品对乙醇的催化氧化能力得到了显著的提升.可见,在这种组成的CeO2-Pd/C催化剂样品中,CeO2起到了助催化的作用.
不同Pd和CeO2摩尔比的CeO2-Pd/C样品电极在含2 mol/L乙醇和1 mol/L KOH溶液中的典型CV参数列于表1中.表中ip,f(A/mg),ip,b(A/mg)分别表示阳极化方向的峰电流密度、阴极化方向的峰电流密度.ip,f/ ip,b值的大小是催化剂抗中毒能力的量度[11],该值越大,表示抗中毒能力越强.为了便于不同样品间的相互比较,电流密度的值和电量的值均统一到每毫克(mg)Pd.从表1中数据可以看出,催化剂中含有Ce元素时,Pd对乙醇的催化氧化能力都得到一定的提升.当nPd∶nCe为2∶1时,其催化能力达到峰值.从ip,f/ ip,b的数值可以发现,含Ce元素催化剂样品催化氧化乙醇时抗毒化能力也得到了增强.另外,一个值得注意的现象是,当Pd/C中Ce元素的含量增大到一定程度(达到1∶2)后,CeO2的助催化效果变得不再显著.
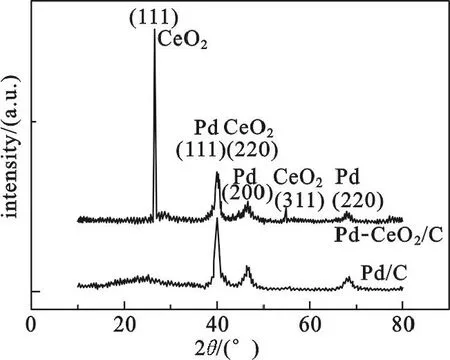
图1 CeO2-Pd/C和Pd/C粉末XRD图谱
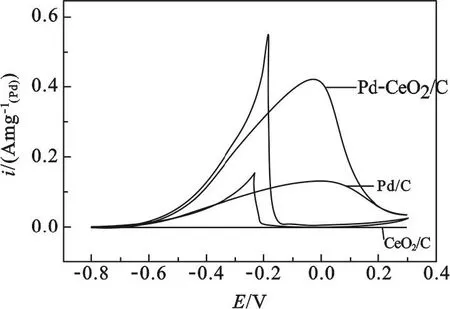
图2 CeO2-Pd/C,CeO2/C和Pd/C在含2 mol/L乙醇和1 mol/L KOH溶液中的CV曲线
图3为Pd和CeO2不同摩尔比样品电极的乙醇氧化电量变化曲线图.从图中可以看出,随着CeO2含量的增加,单位质量Pd氧化乙醇的电量增加;当Pd和CeO2的摩尔比为2∶1时,乙醇氧化电量的值达到最大,约为空白样的2.4倍. 当CeO2含量继续增大,乙醇氧化电量开始减小;直至Pd和CeO2比为1∶2时开始下降缓慢.再增加CeO2的比例,其电量值基本保持平稳.可能原因是,在钯催化剂中,CeO2的作用之一是使贵金属Pd元素得以充分分散,即使极少量的贵金属也能高度分散在载体上,若能形成原子簇,则能提供大量的活性中心,使化学反应得以充分进行.显然,CeO2的分散作用是与其用量有关的:用量太少,不能起到明显的分散与改性作用;用量太多,有可能使催化剂的导电性降低,甚至使Pd 被CeO2所淹没,从而活性受到抑制.当CeO2的量达到一定比例时,CeO2此时已经作为载体而不是助催化剂,因而乙醇氧化电量基本保持不变.

表1 不同Pd和CeO2摩尔比的CeO2-Pd/C样品电极的CV参数
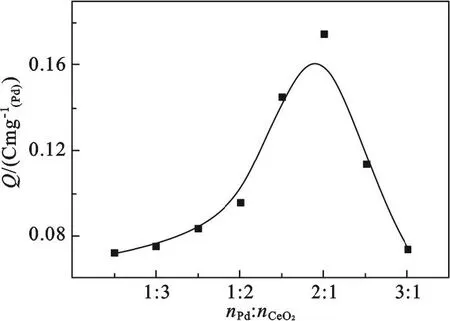
图3 不同Pd和CeO2摩尔比的样品催化氧化乙醇的电量关系曲线

图4 CeO2-Pd(2∶1)/C和Pd/C电极在-0.2 V时的i-t曲线
图4为CeO2-Pd(2∶1)/C和Pd/C在含2 mol/L乙醇的KOH溶液中在-0.2 V下的计时电流曲线.由图可知,Pd/C催化氧化乙醇的平均电流密度值为0.066 A/mg(Pd),CeO2-Pd(2∶1)/C的氧化电流平均值为0.150 A/mg(Pd),对乙醇的催化氧化效率提高了约2.3倍,与前述的乙醇催化氧化量变化程度一致.从图中曲线可以看出,Ce元素的引入,不仅可以提高催化剂对乙醇的催化氧化效率,而且同样可以保持催化剂的工作稳定性.
3 强碱溶液中乙醇氧化机理探讨
乙醇被催化氧化的反应过程一般主要分为以下几个步骤:(1)乙醇分子在贵金属催化剂表面发生吸附;(2)乙醇的α位CH键断裂,生成乙醛(CH3CHO).或者CC键断裂,形成CHx和CO中间产物;(3)吸附在催化剂表面的中间产物分子进一步被氧化生成产物.其中,CH3CHO氧化生成CH3COOH;CHx和CO氧化生成CO2[12-13].碱性溶液中,当pH值大于13.0时,乙醇发生部分氧化,分子中的CC键不发生断裂,没有检测出CO,产物仅有乙酸盐[14].当Pd/C中引入CeO2后,由于Pd的d电子向CeO2表面转移,使得部分CeO2中部分Ce4+向Ce3+转化,这种d电子转移,削弱了中间氧化产物与Pd表面的吸附作用,有利于中间产物的进一步氧化;而Ce3+含量的增加,使CeO2结构中产生更多的氧空位,CeO2释放含氧基团能力得到了增强,也有利于中间产物的进一步氧化.在乙醇氧化过程中,CeO2的释放/储存氧能力促进了催化剂表面中间产物氧化能力的“双功能机理”的发挥[15],也佐证了CeO2能提升Pd对乙醇催化氧化效率的实验结论.
4 结论
用液相还原法在Pd/C催化剂中引入助剂轻稀土氧化物CeO2,制备了CeO2-Pd/C催化剂.实验结果表明,CeO2-Pd/C催化剂在碱性溶液中对乙醇的氧化活性优于Pd/C催化剂,CeO2起到了助催化的作用. 当nPd∶nCe约为2∶1时,其催化能力达到了峰值,乙醇氧化电量的值达到最大,约为空白样的2.4倍.当CeO2含量继续增大,乙醇氧化电量开始减小,直至Pd和CeO2比为1∶2时开始下降变缓.再增加CeO2的比例,其电量值基本保持平稳,CeO2此时已经作为载体而不是助催化剂.可见,在Pd/C催化剂中添加适量的CeO2,才能对Pd/C催化剂氧化乙醇的效率起到助催化的提升作用.
5 参考文献
[1]Lamy C,Lima A,LeRhun V,et al. Recent advances in the development of direct alcohol fuel cells(DAFC)[J]. Journal of Power Sources,2002,105(2):283-296.
[2]Song S Q,Tsiakaras P. Recent progress in direct ethanol proton exchange membrane fuel cells(DE-PEMFCs)[J]. Appl Catal. B,2006,63(3/4):187-193.
[3]姜鲁华,臧海霞,孙公权,等.制备方法对直接乙醇燃料电池阳极PtSn/C催化剂性能的影响[J].催化学报,2006,27 (1):15-19.
[4]Colmenares L,Wang H,Jusys Z,et al. Ethanol oxidation on novel,carbon supported Pt alloy catalysts——model studies under defined diffusion conditions[J]. Electrochimic Acta,2006,52:221-233.
[5]孙芳,邬冰,曲微丽,等. Pt/C电极表面活性处理对乙醇电催化氧化的影响[J].无机化学学报,2005,21(10):1546-1550.
[6]Shen P K,Xu C. Alcohol oxidation on nanocrystalline oxide Pd/C promoted electrocatalysts[J]. Electrochemistry Communications,2006,8(1):184-188.
[7]Xu C,Shen P K,Liu Y. Ethanol electrooxidation on Pt/C and Pd/C catalysts promoted with oxide[J]. Journal of Power Sources,2007,164(2):527-531.
[8]Xu C,Cheng L,Shen P,et al. Methanol and ethanol electrooxidation on Pt and Pd supported on carbon microspheres in alkaline media[J]. Electrochem Comm,2007,9(5):997-1001.
[9]Hu F,Cui G,Wei Z,et al. Improved kinetics of ethanol oxidation on Pd catalysts supported on tungsten carbides/carbon nanotubes[J]. Electrochem Comm,2008,10(9):1303-1306.
[10]Zheng H T,Li Y,Chen S,et al. Effect of support on the activity of Pd electrocatalyst for ethanol oxidation[J]. Journal of Power Sources,2006,163(1):371-375.
[11]Zheng S F,Hu J S,Zhong L S,et al. In situ one-step method for preparing carbon nanotubes and Pt composite catalysts and their performance for methanol oxidation[J].Phys Chem C,2007,111(30):11174-11179.
[12]Iwasita T,Pastor E. A dems and FT IR spectroscopic investigation of adsorbed ethanol on polycrystalline platinum[J]. Electrochimica Acta,1994,39(4):531-537.
[13]Hitmi H,Belgsir E M,Léger J M,et al. A kinetic analysis of the electro-oxidation of ethanol at a platinum electrode in acid medium[J]. Electrochimica Acta,1994,39(3):407-415.
[14]方翔,沈培康.乙醇在钯电极上的电氧化机理[J].物理化学学报,2009,25(9):1933-1938.
[15]Yajima T,Wakabayashi N,Uchida H,et al. Adsorbed water for the electro-oxidation of methanol at Pt-Ru alloy[J]. Chem Commun,2003,7:828.
(责任编辑胡小洋)
Study on CeO2-Pd/C to ethanol electrocatalytic reaction in KOH solution
LIU Chang,TIAN Danni,ZHOU Xinwen,DAI Zhongxu
(1.College of Biological and Pharmaceutical,China Three Gorges University,Yichang 443002,China;2.College of Materials and Chemical Engineering,China Three Gorges University,Yichang 443002,China)
Abstract:To study the influence of catalytic oxidation ability to ethanol of Ce element in Pd/C catalyst,CeO2-Pd/C catalysts were prepared by a liquid phase chemical reduction method. The structure and catalytic oxidation of ethanol behavior of the catalysts were characterized and tested by XRD,cyclic voltammograms and chronoamperometry experiment,respectively. The results show that CeO2can improve Pd/C catalytic oxidation ability of ethanol in alkaline solution. When n(Pd)∶n(CeO2)equaled 2∶1(molar ratio),its catalytic efficiency value reached a peak. When the molar ratio of Pd and CeO2changed less than 1∶2,its oxidation capacity remained unchanged basically by increasing the amount of CeO2. It was indicated that CeO2was a co-catalyst before the molar ratio of Pd to CeO2was larger than 1∶2. After the numerical value was less than 1∶2,CeO2was no longer act as a co-catalyst,but might play a role of the catalyst carrier.
Keywords:palladium;ceric oxide;ethanol;electro-oxidation
作者简介:刘畅(1990-),女,硕士生;代忠旭,通信作者,教授,E-mail: daizx@ctgu.edu.cn
基金项目:三峡大学-宜昌科力生天然气股份有限公司技术开发(合作)项目(SDHZ2008195)资助
收稿日期:2015-04-25
文章编号:1000-2375(2015)06-0600-05
中图分类号:TQ150
文献标志码:A
DOI:10.3969/j.issn.1000-2375.2015.06.017

