牛病毒性腹泻病毒E0基因重组慢病毒载体构建和鉴定
刘 军,尹惠琼,颜仁和,王 蕊,李红卫,章金刚*,魏建忠
(1.安徽农业大学 动物科技学院,安徽 合肥 230036;2.军事医学科学院 野战输血研究所,北京 100850;3.南方医科大学 生物技术学院,广东 广州 510515)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)为黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)成员,为+ssRNA 有囊膜病毒。自Olafson 等1946年首次报道该病毒[1]以来,该病毒已呈世界性分布,主要基因型为1a 和1b。动物感染BVDV 后主要表现为体温升高,采食量下降,反刍次数减少或停止,口腔和鼻腔粘液分泌增多,白细胞数下降,粪便呈水样,母畜表现为产奶量下降,怀弱胎、畸形胎或死胎,给养牛业造成严重的经济损失[2]。
BVDV 基因组仅有一个开放阅读框(Open reading frame,ORF),编码一个约4 000 个氨基酸残基的前体蛋白,两侧为非翻译区(Untranslated region,UTR)。ORF 编码4 种结构蛋白(Core、E0、E1 和E2 蛋白)和7 种非结构蛋白(Npro、p7、NS2-3、NS4A、NS4B、NS5A 和NS5B)。
利用基因工程方法重组病毒主要保护性抗原用于疾病的预防已经得到广泛应用,E0 蛋白在各病毒株之间相对保守,因此本研究构建携带BVDV E0基因的重组慢病毒载体并包装慢病毒,为BVDV E0蛋白哺乳动物细胞中的表达及其免疫原性研究,基因工程疫苗的研发奠定基础。
1 材料和方法
1.1 主要实验材料 慢病毒表达系统(pZJ-CMVeGFP、pAX2、pVsvg)由南方医科大学生物技术学院李红卫教授馈赠;含BVDV E0 序列的pGSI-E0 重组质粒由中美泰和生物技术公司合成;HEK-293T 细胞为本室保存;E.coil 感受态DH5α 购自TaKaRa 公司;限制性内切酶及T4 DNA 连接酶均购自NEB 公司;DNA 琼脂糖凝胶回收试剂盒购自Axygen 公司;质粒小量提取试剂盒购自OMEGA 公司;PEI、HBS转染试剂由本实验室配置[3];HRP 标记的山羊抗兔IgG(IgG-HRP)购自北京中杉金桥生物技术有限公司;BVDV 多克隆抗体为本实验室自制。
1.2 引物设计及合成 P1 为构建载体pZJ-CMVeGFP-IgK-E0 时引入IgK 信号肽的上游引物,P2 为引入his 标签的下游引物;P3 为构建不含IgK 信号肽的对照载体pZJ-CMV-eGFP-E0 时的上游引物,下游引物同P2;PCR 验证构建的慢病毒载体中目的片段插入方向是否正确时上游引物为P4,下游引物为P2(表1)。引物由中美泰和生物技术(北京)有限公司合成。
1.3 重组慢病毒载体p ZJ-CMV-eGFP-IgK-E0及pZJ-CMV-eGFP-E0的构建 分别利用引物P1/P2和P3/P2 对pGSI-E0 进行PCR 扩增,得到含有IgK信号肽的E0 基因片段和不含IgK 信号肽的E0 基因片段,对上述两个扩增产物及慢病毒载体pZJ-CMVeGFP 进行NheⅠ酶切,胶回收PCR 目的片段及线性化后去磷酸化的pZJ-CMV-eGFP 载体,构建重组质粒。PCR 鉴定阳性重组质粒,进行酶切和测序验证,将鉴定正确的重组质粒命名为pZJ-CMV-eGFPIgK-E0 和pZJ-CMV-eGFP-E0。

表1 引物序列及引入序列和/或酶切位点Table 1 Primer sequences and the sequence and/or restriction enzyme sites that lead in
1.4 重组慢病毒质粒共转染HEK-293T细胞 转染前24 h 将5×106个/mL 的HEK-293T 细胞铺10 cm细胞培养皿,37 ℃5 % CO2培养过夜。当细胞汇合度达到80 %时进行转染。在1 mL PEI 转染试剂中加入pZJ-CMV-eGFP-IgK-E0 5 μg,pAX2 载体3.75 μg,pVsvg 载体1.25 μg,将其加入10 cm 细胞培养皿中,同样方法对pZJ-CMV-eGFP-E0 进行转染。转染48 h 后,观察荧光并收集细胞培养上清液,经浓缩柱浓缩后分装于-80 ℃保存备用。
1.5 慢病毒滴度测定 将生长状态良好的HEK-293T 细胞消化计数后稀释至1×105个/mL,加入96孔板,100 μL/孔,每株病毒准备10 个孔。用培养基将浓缩的病毒液按10 倍倍比稀释,取100 μL 稀释后的病毒液分别加入到相应孔中,48 h 后在荧光显微镜下观察各孔中GFP 的荧光表达情况,并对最后两个有荧光的荧光细胞克隆数计数。假设为X 和Y,则滴度(TU/mL)=[(X+Y×10)×1 000]/2 即为X 孔的病毒液的含量[3]。
1.6 Western blot鉴定 收集转染后HEK-293T 细胞上清液,以正常HEK-293T 细胞的上清液作为阴性对照,经SDS-PAGE 电泳分离蛋白后,将其电转移至PVDF 膜上,以抗BVDV 兔多克隆抗体(1∶2 000)为一抗,山羊抗兔IgG-HRP(1∶5 000)为二抗,DAB显色观察结果,进行western blot 鉴定。
2 结果
2.1 两种慢病毒重组质粒的构建及鉴定 采用P3/P4引物对构建的慢病毒重组质粒pZJ-CMV-eGFP-IgKE0 及pZJ-CMV-eGFP-E0 进行PCR 鉴定,结果表明目的片段插入方向正确(图1)。将构建的重组质粒进行测序分析,结果表明插入序列未发生突变。对慢病毒重组质粒进行NheⅠ酶切,分别得到与预期相符片段(726 bp 和705 bp)(图略)。
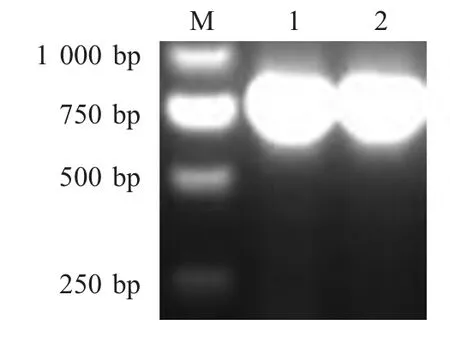
图1 pZJ-CMV-eGFP-IgK-E0 和pZJ-CMV-eGFP-E0 的PCR 鉴定Fig.1 PCR identification of pZJ-CMV-eGFP-IgK-E0 and pZJ-CMV-eGFP-E0 plasmid
2.2 两种慢病毒包装及滴度测定 按PEI 转染操作,将两种慢病毒重组质粒分别与病毒包装辅助重组质粒共转染于HEK-293T 细胞,结果显示转染24 h即可以观察的荧光,48 h 后荧光增强(图2)。pZJCMV-eGFP-IgK-E0 和pZJ-CMV-eGFP-E0 包装的慢病毒滴度分别为1×108TU/mL 和1×109TU/mL。

图2 两种慢病毒载体转染HEK-293T 细胞后不同时间段荧光情况Fig.2 Fluorescence identification of packaged the recombinant lentiviral viruses in HEK-293T cells
2.3 Western blot鉴定 将两种慢病毒重组质粒转染HEK-293T 细胞后,对收集的上清液进行western blot 检测,结果显示两个转染细胞样品均在33 ku~48 ku 出现特异性条带,对照样品无条带,表明转染操作中E0 蛋白得到表达,本研究包装了含BVDV E0 基因的慢病毒。

图3 PEI 方法转染HEK-293T 细胞后western blot 鉴定结果Fig.3 Western blot analysis of the BVDV E0 gene expression in the transfected HEK-293T cells
3 讨论
目前,发达国家主要通过免疫接种和扑杀持续感染动物来防控反刍动物感染BVDV[4]。用于免疫接种的疫苗主要有灭活苗和弱毒苗两种,前者的安全性高,但其存在免疫后刺激机体产生特异性抗体的能力弱,抗体维持时间短,与弱毒疫苗相比制造成本高等缺点。弱毒疫苗免疫后有效保护期长,但存在毒力返强的风险,目前仅批准用于疫区,并且不宜用于怀孕母畜的免疫。
研究表明E0 和E2 均可以诱导机体产生中和抗体,其中以E2 的免疫原性最强,是介导宿主细胞识别和吸附的主要部位,由于其具有较高的突变率,是导致疫苗失效和牛持续性感染的主要原因,其中和逃逸频率为10-2.47,这阻碍了E2 蛋白在亚单位疫苗方面的研究[5];E0 蛋白由227 个氨基酸残基组成,有8 个糖基化位点,保守性较高,其刺激机体产生的抗体具有中和CSFV 和HCV 的能力[6-7]。Langedijk 等确定了CSFV E0 蛋白的抗原表位,该表位位于C 端aa191~aa227 处[8]。由于E0 蛋白在黄病毒科中比较保守,为BVDV 外膜糖蛋白,其在病毒本身和宿主细胞活性酶以及信号肽的作用下,从前期蛋白剪切并分泌到病毒外[9]。IgK 信号肽能协助靶蛋白进行高效分泌,已经在哺乳动物细胞蛋白表达系统中得到广泛应用。因此,本研究以BVDV E0基因构建了重组慢病毒载体,并表达了E0 蛋白。
慢病毒载体是一种有效的基因转移载体,它能够在哺乳动物细胞中高效的转移、整合和表达外源基因[10]。它的主要优点在于能感染静止期和分裂期细胞、表达时间长、不引起宿主的免疫反应等。由哺乳动物细胞翻译后再加工修饰产生的外源蛋白质,在活性方面远胜于原核表达系统及酵母、昆虫细胞等真核表达系统,更接近于天然蛋白质。
本研究构建了携带BVDV E0 基因的重组慢病毒载体并包装慢病毒,为E0 蛋白在哺乳动物细胞中表达以及基因工程亚单位疫苗的研究奠定了基础。
[1]Ridpath J F.Bovine viral diarrhea virus:global status[J].Vet Clin North Am Food Anim Pract,2010,26:105-121.
[2]Houe H.Epidemiological features and economical importance of bovine virus diarrhoea virus(BVDV)infections[J].Vet Microbiol,1999,64:89-107.
[3]李振宇,徐开林,潘秀英,等.慢病毒载体介导绿色荧光蛋白基因在小鼠T 淋巴细胞中的表达[J].中国实验血液学杂志,2007,15:125-128.
[4]Endsley J J,Roth J A,Ridpath J,et al.Maternal antibody blocks humoral but not T cell responses to BVDV[J].Biologicals,2003,31:123-125.
[5]Cowley D J,Clegg T A,Doherty M L,et al.Bovine viral diarrhoea virus seroprevalence and vaccination usage in dairy and beef herds in the Republic of Ireland[J].Irish Vet J,2012,65:16-24.
[6]Thomas C,Young N J,Heaney J,et al.Evaluation of efficacy of mammalian and baculovirus expressed E2 subunit vaccine candidates to bovine viral diarrhoea virus[J].Vaccine,2009,27:2387-2393.
[7]Donofrio G,Bottarelli E,Sandro C,et al.Expression of bovine viral diarrhea virus glycoprotein E2 as a soluble secreted form in a mammalian cell line[J].Clin Vaccine Immunol,2006,13:698-701.
[8]Langedijk J P M,van Veelen P A,Schaaper W M M,et al.A structural model of pestivirus Erns based on disulfide bond connectivity and homology modeling reveals an extremely rare vicinal disulfide[J].J Virol,2002,76:10383-10392.
[9]Silva-Krott I U,Kennedy M A,Potgieter L N.Cloning,sequencing,and in vitro expression of glycoprotein gp48 of a noncytopathogenic strain of bovine viral diarrhea virus[J].Vet Microbiol,1994,39:1-14.
[10]Naldini L.Ex vivo gene transfer and correction for cell-based therapies[J].Nat Rev Genet,2011,12:301-315.

