N2O5/HNO3硝解乌洛托品制备RDX的机理
王志鑫,杨红伟,伍 波,吕春绪,程广斌
(南京理工大学化工学院,江苏南京210094)
N2O5/HNO3硝解乌洛托品制备RDX的机理
王志鑫,杨红伟,伍波,吕春绪,程广斌
(南京理工大学化工学院,江苏南京210094)
摘要:利用13C NMR谱监测了乌洛托品(HA)在N2O5/HNO3和N2O5/HNO3/CH2Cl2硝化体系中硝解反应的历程,根据实验13C NMR谱和计算13C NMR谱的解析结果,并结合HA硝解反应过程中可能存在中间体和副产物的13CNMR理论计算结果,提出了硝解历程中可能存在的中间体与副产物的结构,推测了HA在N2O5/HNO3体系中的硝解历程为:HA首先与两分子HNO3结合生成乌洛托品二硝酸盐(HADN);HADN再经环三亚甲基硝胺母体逐步降解为黑索今(RDX)。
关键词:有机化学;乌洛托品;HA;N2O5/HNO3;RDX;硝解机理;13C NMR
引言
黑索今(RDX)是一种性能优良的高能炸药,在军事领域得到广泛应用[1-2]。目前,RDX的生产工艺主要有直接硝解法和无水醋酸法等[3-5],我国主要采用直接硝解法生产RDX。关于硝酸直接硝解乌洛托品(HA)制备RDX的反应机理,国内外学者进行了大量研究,其机理一般分为两种:一是逐步降解机理,Dunning等[6]通过对比研究HA在浓硝酸中硝解的放热率与RDX的生成速率,认为从HA硝解到RDX的反应分为两个阶段,第1阶段是生成带有两个氮硝基的氮杂六元环(RDX母体),该阶段反应快、放热多;第2阶段是生成含3个氮硝基的RDX,该阶段反应较慢,为速度控制步骤;二是小分子环合机理,方志杰等[7-10]用核磁共振的方法监测了直接硝解法(浓硝酸硝化体系)和K法硝解法(浓硝酸/硝酸铵硝化体系)制备RDX的硝解反应进程,提出了小分子环合机理。
20世纪80年代,出现了采用N2O5/HNO3体系作为硝化剂的新型硝化技术,其硝化能力可调,反应选择性好,氧化副产物少,并用于HMX、CL-20等含能材料的制造中[11-12]。以N2O5/HNO3体系作为硝化剂硝解HA制备RDX的工艺已有较多的研究[12-14]。John等[13]考察了反应温度、反应时间、N2O5用量、HNO3用量对硝解反应的影响,并得到N2O5/HNO3硝解HA制备RDX的最佳反应条件;石煜等[15]提出了HA在N2O5/HNO3体系中可能的硝解历程,但未对该硝解历程进行验证研究。
本实验利用13C NMR监测了HA在N2O5/HNO3和N2O5/HNO3/ CH2Cl2体系中的硝解反应过程,并对硝解过程中可能存在中间体的13C NMR谱进行了理论计算,在解析核磁共振碳谱的基础上,推测了HA在N2O5/HNO3体系中可能的硝解机理,以期为N2O5/HNO3硝解HA制备RDX的生产提供参考。
1实验
1.1试剂与仪器
乌洛托品,AR、发烟硝酸(质量分数95%),南京化学试剂有限公司;五氧化二磷,AR,西陇化工股份有限公司;二氯甲烷,AR,上海凌峰化学试剂有限公司;HNO3(质量分数100%)、N2O5,自制。
JB50-D型增力电动搅拌机,上海标本模型厂;85-2型磁力搅拌器,上海司乐仪器有限公司;DFY-5型低温恒温反应浴,南京科尔仪器设备有限公司;SHB-D(III)循环水式多用真空泵,郑州长城科工贸有限公司;Bruker Avance 300核磁共振仪,瑞士Bruker公司;InVia 激光显微拉曼光谱仪,英国Renishaw公司。
1.2N2O5/HNO3硝解HA制备RDX
将一定浓度的N2O5/HNO3硝化液(0.75g N2O5和15g HNO3)倒入三口烧瓶中,剧烈搅拌,保持温度0℃,将1.5g HA缓慢加入到上述硝化体系中,控制加料温度为0~5℃,加料完毕后在0℃反应1h。反应结束后,向反应液中滴加一定量的去离子水使体系硝酸质量分数降为40%左右,氧化结晶20~30min,有大量白色晶体析出。减压抽滤,并将得到的滤饼用热水煮洗,降温后过滤再水洗至水洗液呈中性,60℃真空干燥10h即可得到产品RDX。
在硝解反应过程中,取0.25mL加料结束的硝解混合液与0.5mL DMSO-d6混合,并用13C NMR测试,取0.25mL反应结束的硝解混合液与0.5mL DMSO-d6混合,并用13C NMR测试。
1.3N2O5/HNO3/CH2Cl2硝解HA
配制100mL的N2O5/ HNO3/CH2Cl2硝解混合液(HNO3浓度为10mol/L),其中HNO3和N2O5的质量比为20∶1,硝解液低温避光保存。取10mL上述N2O5/HNO3/CH2Cl2硝解混合液倒入三口烧瓶中,剧烈搅拌,保持体系温度0℃,将0.7g HA(5mmol)缓慢加入到上述硝化体系中,控制加料温度为0~5℃,加料完毕后,在0℃反应1h。
在硝解反应过程中,取0.25mL加料结束的硝解混合液与0.5mL DMSO-d6混合,并用13C NMR测试;取0.25mL反应结束的硝解混合液与0.5mL DMSO-d6混合,并用13C NMR测试。
取0.7g HA(5mmol)分散于一定体积的CH2Cl2中,在充分搅拌下体系呈悬浮状,缓慢滴加一定体积的N2O5/HNO3/CH2Cl2硝解混合液(HNO3浓度为10mol/L的),控制加料温度为0~5℃,加料完毕后,取0.25mL硝解混合液与0.5mL DMSO-d6混合并用13C NMR测试。
2结果与讨论
2.1N2O5/HNO3体系硝解HA制备RDX过程中的13C NMR分析
N2O5/HNO3体系加料结束和反应结束时的13C NMR谱图如图1所示。
如图1所示,加料结束和反应结束两个阶段的谱图信息基本一致,这是由于加料方式采用的是将HA缓慢加入到N2O5/HNO3体系中,硝解反应速率快,加入的HA迅速反应至反应终点状态。将谱图中13C信号的化学位移与RDX的13C化学位移对比,可以确定硝解反应终点时各副产物的结构。反应结束时,δ为63.95处的13C信号远高于其他13C信号,归属为RDX的13C信号峰,这与实测的RDX标准物的13C化学位移61.72和理论计算所得RDX的13C化学位移60.42基本一致。根据文献[7-10]可知,δ为75.25处较高的13C信号峰归属为O2NN(CH2OH)2;δ为91.89处较高的13C信号峰归属为CH2(ONO2)2,这与两种化合物理论计算所得13C化学位移(δ为76.23和94.27)基本一致。
2.2N2O5/HNO3/CH2Cl2体系硝解HA过程中的13C NMR分析
根据对N2O5/HNO3体系硝解HA反应液的13C信号监测结果可知,N2O5/HNO3体系硝解HA的反应速率快,通过13C NMR监测虽可以确定该硝解反应终点时各产物的结构,但是无法准确监测反应进程来进行机理研究。因此,实验过程中改变加料方式,采用惰性有机溶剂CH2Cl2与N2O5/HNO3混合,将HA分散于一定体积的CH2Cl2中,并将N2O5/HNO3/CH2Cl2硝解混合液缓慢滴加到HA和CH2Cl2的混合物中,改变HNO3和HA的物质的量比,利用13C NMR监测反应进程。通过研究随着硝解剂N2O5/HNO3中HNO3物质的量的增加,硝解反应液中13C化学位移的变化,可以推测N2O5/HNO3体系硝解HA制备RDX的反应机理。
N2O5/HNO3/CH2Cl2体系加料结束和反应结束时的13C NMR谱图如图2所示。

图2 N2O5/HNO3/CH2Cl2体系的13C NMR谱图Fig.2 13C NMR spectra of N2O5/HNO3/CH2Cl2nitrating system
通过对比N2O5/HNO3体系和N2O5/HNO3/CH2Cl2体系硝解反应过程中同一阶段的碳谱(图1与图2加料结束时;图1与图2反应结束时),发现反应过程同一阶段的碳谱基本一致,因此认为CH2Cl2的加入可能仅是作为惰性有机溶剂存在,并未参与到硝解反应过程中,对实验结果没有影响。
当HA与HNO3物质的量比分别为1∶1、1∶2、1∶3、1∶4、1∶6、1∶7、1∶8、1∶9、1∶10、1∶11、1∶13、1∶18时,监测硝解反应液所得到的13C NMR谱图如图3~图5所示,其中HNO3与N2O5的质量比20∶1。

图3 HA与HNO3物质的量比为1∶1、1∶2、1∶3、1∶4时的13C NMR谱图Fig.3 13C NMR spectra of HA and HNO3with themolar ratio of 1∶1,1∶2,1∶3,1∶4

图4 HA与HNO3物质的量比为1∶6、1∶7、1∶8、1∶9时的13C NMR谱图Fig.4 13C NMR spectra of HA and HNO3with themolar ratio of 1∶6,1∶7,1∶8,1∶9
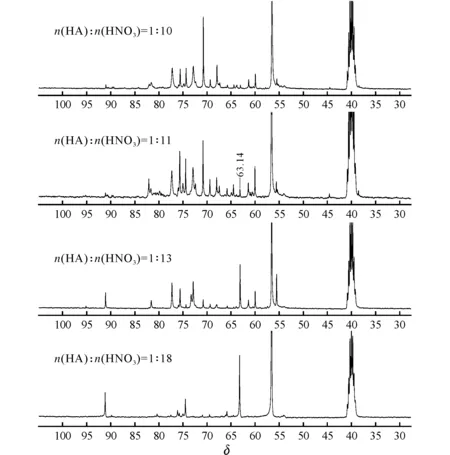
图5 HA与HNO3物质的量比为1∶10、1∶11、1∶13、1∶18时的13C NMR谱图Fig.5 13C NMR spectra of HA and HNO3with the molar ratio of 1∶10,1∶11,1∶13,1∶18
由图3可知,当HA与HNO3物质的量比为1∶1时,δ为72左右最强的13C信号峰可归属为乌洛托品一硝酸盐(HAMN)的13C信号;当HA与HNO3物质的量比为1∶2、1∶3、1∶4时,δ为72左右最强的13C信号峰可归属为乌洛托品二硝酸盐(HADN)的13C信号,即硝解剂N2O5/HNO3较少时,HA与硝解剂N2O5/HNO3反应的主要产物为HADN。
由图4可知,随着硝解剂N2O5/HNO3加入量的增加,HADN逐渐开环降解。
由图5可知,当HA与HNO3物质的量比为1∶10时,HADN的13C信号消失,HADN完全开环降解。当HA与HNO3物质的量比为1∶11时,谱图中δ为63附近出现明显的13C信号,在HA与HNO3物质的量比为1∶11时,硝解剂N2O5/HNO3的量已经能够将开环中间体进一步硝解得到RDX,此时,硝解液中大部分仍为开环中间体,只含有少量RDX。进一步增加硝解剂N2O5/HNO3的加入量,会使得硝解液中更多的开环中间体硝解为RDX,使得RDX的生成量增加。随着硝解剂N2O5/HNO3加入量的增加,谱图中RDX的13C信号峰的相对峰高也随之增高,即硝解液中RDX的含量也在增加。当HA与HNO3物质的量比为1∶18时,该谱图中RDX与副产物的相对含量与图1所示的N2O5/HNO3硝解HA反应终点时的谱图信息基本一致。
2.3硝解过程中可能存在中间体的13C NMR理论计算
在使用N2O5/HNO3体系硝解HA制备RDX的过程中,由于很多中间体和副产物稳定存在于强酸环境中,难以将其从反应体系中离析出来确定其结构,因此对硝解过程中可能存在中间体的13C NMR图谱进行了理论计算[16],并将计算结果、实验结果和相关文献[7-10]数据进行了对比,结果如表1所示。所有计算内容均在Gaussian 09程序[17]中完成,并采用B3LYP/6-311+G**[18]的方法对部分中间体与副产物的结构进行优化并计算了相应的13C化学位移。

表1 目标产物与中间体的13C NMR实验值、
由表1可知,中间体化合物13C化学位移的理论计算值与实验值基本一致,因此,可以确定中间体化合物的结构。
2.4键参数的理论计算[19]
为研究HA、HAMN和HADN的稳定性,计算了这几个化合物中各化学键的键离解能;HA、HAMN和HADN的结构如图6所示,HA、HAMN和HADN中各化学键的键参数计算结果如表2所示。由表2可知,HADN中CH2NH+-CH2的键离解能最弱(242.48kJ/mol),同时其键长也最长,最易发生断裂。因此,认为HA在N2O5/HNO3体系中首先形成的是HADN而不是HAMN。

图6 HA、HAMN和HADN的结构Fig.6 Structures of HA, HAMN and HADN

化合物化学键键长/nm键离解能/(kJ·mol-1)HAC-N0.1476257.86HAMNCpNH+-Cp0.1555256.86HAMNNCp-N0.1478278.78HADNCpNH+-Cp0.1574242.48HADNNH+Cp-NH+0.1503295.80HADNNCp-N0.1480301.67
2.5硝解机理分析

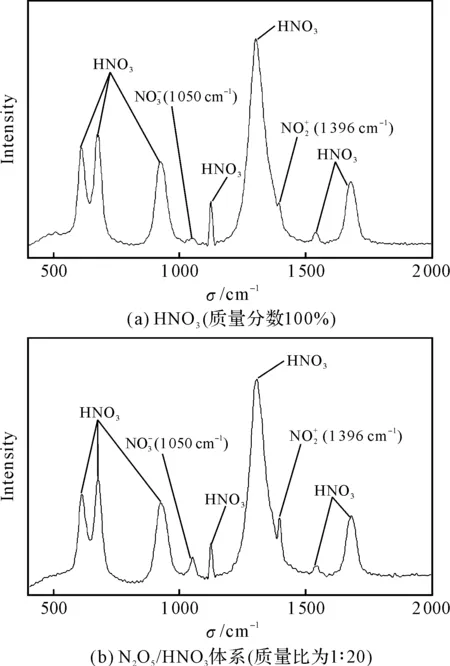
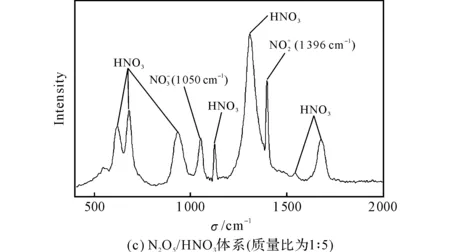
图7 HNO3及N2O5/HNO3体系的拉曼光谱图Fig.7 Raman spectra of HNO3and N2O5/HNO3system
综上所述,通过利用13C NMR监测HA在N2O5/HNO3和N2O5/HNO3/CH2Cl2体系中的硝解反应进程,并根据对硝解过程中碳谱的解析,部分中间体的13C NMR理论计算结果和HA、HAMN、HADN的稳定性计算结果,认为HA在N2O5/HNO3体系中可能主要经历了如图8所示的硝解历程。

图8 HA在N2O5/HNO3体系中生成RDX的主要途径Fig.8 The main approach of the formation of RDX from HA in the N2O5/HNO3system
3结论
(1)用13C NMR监测了HA在N2O5/HNO3体系中的硝解反应进程,并确定硝解反应过程中生成了O2NN(CH2OH)2和CH2(ONO2)2等副产物与中间体。
(2)推测N2O5/HNO3体系硝解HA制备RDX的反应过程是HA首先与两分子HNO3反应生成HADN,HADN再逐步降解形成RDX的途径。

参考文献:
[1]Olah G A, Squire D R. Chemistry of energetic materials[M]. SanDiego: Academic Press Inc., 1991.
[2]周敬, 杨丽侠, 陈晓明, 等. RDX基高能发射药的抗撞击损伤性能[J]. 火炸药学报, 2013, 36(6): 86-90.
ZHOU Jing, YANG Li-xia, CHEN Xiao-ming, et al. Anti-impact fracture property of RDX-based high-energy gun propellants[J]. Chinese Journal of Explosives and Propellants, 2013, 36(6): 86-90.
[3]曹端林, 曹明保, 李永祥. 绿色硝解技术合成RDX酮[J]. 火炸药学报, 2004, 27(1): 12-15.
CAO Duan-lin, CAO Ming-bao, LI Yong-xiang. Synthesis of keto-RDX using dinitrogen pentoxide as the nitrating agent[J]. Chinese Journal of Explosives and Propellants, 2004, 27(1): 12-15.
[4]George H C. The nitration of hexamethylenetetramine[J]. Journal of the American Chemical Society, 1925, 47(11): 2754-2763.
[5]Bachmann W E, John S C. A new method of preparing the high explosive RDX[J]. Journal of the American Chemical Society, 1949, 71(5): 1842-1845.
[6]Dunning W J, Millard B, Nutt C W. The heat of nitrolysis of hexamie in nitric acid[J]. Journal of the Chemical Society, 1952: 1264-1269.
[7]FANG Zhi-jie, LI Chen, WANG Shao-fang, et al. Study on the nitrolysis of hexamethylenetetramine by NMR spectrometry[J]. Propellants, Explosives, Pyrotechnics, 1995, 20(2): 83-86.
[8]FANG Zhi-jie, LI Chen, WANG Shao-fang, et al. Study on the nitrolysis of hexamethylenetetramine by NMR spectrometry II. some new evidences of the intermediate of HOCH2NHNO2as a possible precursor to RDX[J]. Propellants, Explosives, Pyrotechnics, 1997, 22(2): 78-80.
[9]FANG Zhi-jie, JU Chen, LI Fu-ping. Study on the nitrolysis of hexamethylenetetramine by NMR spectrometry. Part III: the NMR spectral data of some products and intermediates from the nitrolysis of HA[J]. Propellants, Explosives, Pyrotechnics, 1997, 22(6): 314-316.
[10]FANG Zhi-jie, WANG Shao-fang, LI Fu-ping. Study on the nitrolysis of hexamethylenetetramine by NMR-spectrometry. Part IV: a novel mechanism of the formation of RDX from HA[J]. Propellants, Explosives, Pyrotechnics, 1998, 23(6): 317-319.
[11]何志勇. 离子液体催化N2O5硝解反应制备HMX及硝解机理研究[D]. 南京:南京理工大学,2012.
HE Zhi-yong. Synthesis of HMX by nitrolysis with dinitrogen pentoxide catalyzed by acidic ionic liquid and study on the nitrolysis mechanism[D]. Nanjing: Nanjing University of Science and Technology, 2012.
[12]钱华, 叶志文, 吕春绪. N2O5/HNO3硝化硝解TAIW制备CL-20[J]. 应用化学, 2008(3): 378-380.
QIAN Hua, YE Zhi-wen, Lü Chun-xu. Nitration and nitrolysis of TAIW with N2O5/HNO3to synthesize CL-20[J]. Chinese Journal of Applied Chemistry, 2008(3): 378-380.
[13]John F W, Ronald A L. Direct preparation of 1,3,5-triaza-1,3,5-trinitrocyclohexane from hexamethylenetetramine [J]. Organic Preparations and Procedures International, 1986, 18(4): 281-283.
[14]覃光明, 葛忠学. 含能化合物合成反应与过程[M]. 北京: 化学工业出版社,2011.
[15]石煜. 黑索今的合成工艺研究[D]. 南京:南京理工大学,2010.
SHI Yu. Study on synthetic process of RDX [D]. Nanjing: Nanjing University of Science and Technology, 2010.
[16]张颖. 密度泛函方法在NMR理论计算中的系统研究[D]. 厦门:厦门大学,2008.
ZHANG Ying. Systematic study on DFT prediction of NMR properties[D]. Xiamen: Xiamen University, 2008.
[17]Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09[CP/CD]. Wallingford CT: Gaussian, Inc., 2009.
[18]John P A, Stephen B J, Rolf S. Theoretical models incorporating electron correlation[J]. International Journal of Quantum Chemistry, 1976, 10(S10): 1-19.
[19]WU Qiong, ZHU Wei-hua, XIAO He-ming. Molecular design of tetrazole- and tetrazine-based high-density energy compounds with oxygen balance equal to zero[J]. Journal of Chemical and Engineering Data, 2013, 58(10): 2748-2762.
[20]Goddard D R, Hughes E D, Ingold C K. Chemistry of nitronium salts. Part I: isolation of some nitronium salts[J]. Journal of the Chemical Society, 1950, 4: 2559-2575.
The Mechanism for the Preparation of RDX from the Nitrolysis of
Hexamethylenetetramine with N2O5/HNO3
WANG Zhi-xin, YANG Hong-wei, WU Bo, Lü Chun-xu, CHENG Guang-bin
(School of Chemical Engineering, Nanjing University of Science and Technology, Nanjing 210094, China)
Abstract:The reaction mechanism for the nitrolysis of hexamethylenetetramine (HA) in the nitrating system of N2O5/HNO3and N2O5/HNO3/CH2Cl2was monitored by using13C NMR spectroscopy. Based on the analytical result of the13C NMR spectrum, and combined the result of calculated13C NMR of the possible intermediates and by-products in the nitrolysis reaction process of HA, the structures of the possible intermediates and by-products in the nitrolysis reaction process of HA were presented. A possible mechanism for the nitrolysis of HA in the nitrating system of N2O5/HNO3was speculated. In the first step, hexamethylenetetramine dinitrate (HADN) was formed via one molecular HA and two molecular HNO3. And then, HADN gradually degrades to RDX via cyclotrimethylenenitramine matrix.
Keywords:organic chemistry; hexamethylenetetramine; HA; N2O5/HNO3; RDX ; nitrolysis mechanism;13C NMR
通讯作者:程广斌(1967-),男,教授,从事含能材料的合成与应用研究。
作者简介:王志鑫(1991-),男,硕士研究生,从事含能材料的合成。
基金项目:国家自然科学基金资助(21376121)
收稿日期:2015-07-03;修回日期:2015-10-23
中图分类号:TJ55; TQ203
文献标志码:A
文章编号:1007-7812(2015)06-0045-06
DOI:10.14077/j.issn.1007-7812.2015.06.009

