苯并[a]芘和菲对缢蛏血细胞DNA损伤的研究
蒋玫, 李磊, 沈新强, 许高鹏, 杨杰青
1. 中国水产科学研究院东海水产研究所,上海 200090 2. 上海海洋大学,上海,203360
苯并[a]芘和菲对缢蛏血细胞DNA损伤的研究
蒋玫1,*, 李磊1, 沈新强1, 许高鹏2, 杨杰青2
1. 中国水产科学研究院东海水产研究所,上海 200090 2. 上海海洋大学,上海,203360
为研究苯并[a]芘和菲对缢蛏的毒性效应,将缢蛏(Sinonovacula constricta) 分别暴露于浓度为0.45 mg·L-1、0.15 mg·L-1、0.05 mg·L-1苯并[a]芘溶液和0.45 mg·L-1、0.15 mg·L-1、0.05 mg·L-1菲的溶液中,采用单细胞凝胶电泳实验(彗星实验)技术检测不同暴露时间缢蛏血淋巴细胞的DNA损伤程度,对照组为清洁海水。结果显示,高浓度(0.45 mg·L-1) 苯并[a]芘溶液和(0.45 mg·L-1)菲溶液在短期(7 d) 内即可导致缢蛏血细胞显著的DNA损伤,并且随苯并芘[a]和菲浓度的增大和暴露时间的延长,DNA损伤程度增加。21 d恢复实验后,各浓度组DNA损伤又均有不同程度的恢复,但中高浓度组(0.45 mg·L-1和0.15 mg·L-1)与对照组仍显著性差异。两种多环芳烃物质对缢蛏血细胞的 DNA 损伤作用均存在较显著时间-剂量-效应关系。其中,苯并芘[a]对缢蛏血细胞的DNA损伤作用要高于菲。
苯并芘[a]和菲;缢蛏;血细胞;DNA 损伤;单细胞凝胶电泳; 彗星实验
多环芳烃(polycyclicaromatic hydrocarbons,PAHs)是一类典型的疏水性有机污染物[1],主要来源于生物燃料和与化石燃料的不完全燃烧[2-3]。多环芳烃广泛存在于环境介质中,含量水平较低,但是可通过大气、土壤、水、食物等多种途径进入人体并富集,是诱导人类癌症的重要环境污染物质之一[4-5]。其中苯并[a]芘(Benzo[a] pyrene,BaP)的致癌性是多环芳烃中最强的[6]。由于BaP 分布广泛,性质稳定,常被视为 PAHs 研究的指示物[7]。菲(phenanthrene,PHE)是一种具有三个苯环的,低分子量的最简单化学结构的多环芳经,对水生生物也有很大毒性,菲在污染场地的浓度水平也较高[8]。因而,菲常用作模式化合物研究相关的科学问题[9-10]。
双壳贝类由于分布广泛,移动能力弱,对污染物具有很强生物富集作用,常被作为海区污染监测的指示生物[11]。PAHs污染物通过贝类摄入的水流进入鳃丝,在经血淋巴循环到达各组织器官(主要是消化盲囊);贝类因代谢PAHs而产生大量的活性中间产物和活性氧类, 这些活性物质会对生物大分子和组织结构造成损伤,影响细胞的微核率、肝脏功能和DNA修复能力[12-13]。贝类细胞分子毒理学 (DNA损伤)对于解析污染物的致毒机理和毒性评定具有非常重要的意义。目前针对多环芳烃对水生生物DNA损伤的研究也开始逐渐得到关注[14-17],张晓勇等将马氏珠母贝暴露于苯并芘[a]中得出血淋巴细胞DNA受到一定的损伤,血细胞的 损伤程度随苯并芘[a]浓度增加而增加[18],但关于苯并[a]芘和菲对贝类的DNA损伤遗传毒性研究还相对较少。
彗星试验又名单细胞凝胶电泳(SCGE)被认为是一种简便、快速、敏感性高的DNA损伤与修复的检测技术[14]。本研究以缢蛏为实验材料,采用单细胞凝胶电泳实验(彗星实验)的方法检测了苯并[a]芘和菲胁迫对缢蛏血细胞的遗传损伤,探讨了DNA损伤作为多环芳烃污染暴露生物标记的可行性,同时为贝类养殖环境毒理学研究和近岸海区PAHs的污染监测提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验用缢蛏取自启东市黄海滩涂公司缢蛏养殖区,实验前暂养一周,贝体平均壳长(5.90±0.31) cm,壳宽为(1.99±0.11) cm,体重(14.60±2.62) g。实验用水来自经过滤的天然海水,盐度为20~21,pH为8.10~8.40。
实验所用苯并[a]芘和菲为Sigma公司产品,采用丙酮作为助溶剂溶解BaP和PHE配成储备液。海水中苯并[a]芘和菲浓度的测定采用气相色谱法[19]。
1.2 实验方法
随机选取缢蛏分为4组,对照组(天然海水、低浓度组、中浓度组和高浓度组(苯并芘[a]和菲溶液)。苯并[a]芘和菲的溶液实验浓度梯度分别为:0.45 mg·L-1、0.15 mg·L-1、0.05 mg·L-1。每组约40只缢蛏,置于含14 L沙滤海水的玻璃箱(容积30 L)中,24 h连续充氧,实验期间水温为23.60~25.40 ℃。每日100 %换水一次,更换相同浓度的实验液,及时清除排泄物和活力不好的贝体,贝类饵料为单独培养扁藻,每天定时定量喂食二次,藻液体积为80 mL,扁藻密度为2×104cell·mL-1,。胁迫实验进行15 d,15 d后将实验液全部换成清洁沙滤海水进行为期6 d的恢复实验。分别于实验开始后的第0、3、7、 15 d和21 d,每个实验组采集2只贝类样品。选取活力好的缢蛏,以洁净海水洗净外壳。先用75 %的酒精棉球消毒闭壳肌,再用预先吸入已消毒的预冷抗凝剂(8.0 g·L-1柠檬酸三钠、20.80 g·L-1葡萄糖、22.5 g·L-1NaCl、3.36 g·L-1Na2EDTA、pH=7.5)的无菌注射器,按抗凝剂:血淋巴为2:1的比例由闭壳肌处抽取血淋巴,在无菌的试管内用5 mL PBS将50 μL血样稀释,调节细胞浓度为1.4×107cell·mL-1,取此单细胞悬液1 mL加入灭菌eppendorf 管,放入冰盒内备用。
1.3 彗星实验
彗星实验方法参照Singh等[20]的实验方法并略加改进,应用细胞培养板板盖铺单层胶的彗星实验检测方式,对电泳条件进行了摸索。制片前用台酚蓝染色法测定细胞存活率。25 μL 受检细胞与8 %的75 μL低熔点琼脂糖(LMA)混合,铺于细胞培养板板盖的小圆凹槽中,每个样品平均加入3个圆凹槽中作为3个重复。待胶凝固后加入4 ℃新配制细胞裂解液(2.5 mol·L-1NaCl、0.1 mol·L-1EDTA、0.01 mol·L-1Tris、1% 肌氨酸钠、pH 10、1%曲拉通X-100、10 %二甲亚砜),浸泡2 h之后用磷酸缓冲液(pH 7.0)浸洗2次,再置于有新配置的碱性电泳缓冲液(0.3 mol·L-1NaOH、1 mmol·L-1EDTA,pH >13)的水平电泳槽中,在4 ℃避光解旋20 min。调节电泳液面高度,在300 mA、25 V电压下电泳5 min。然后用pH 7.5,0.4 mol·L-1的Tris-HCl浸洗2次,每次10 min。加50 μL 的25 μg·mL-1EB 水溶液染色30 min。置荧光显微镜下观察,拍照后进行分析。
1.4 数据处理
用Scion Image Beta 4.0.2 图像软件进行分析计算出尾长、头长、尾长/头长、尾矩、尾DNA 含量(Tail DNA%)等项DNA 损伤指标。Tail DNA%是国际上普遍采用的评价指标,不受单位影响,因此本实验利用它作为DNA 损伤的评价指标。以彗尾长度/核直径(TL/D) 值衡量损伤程度,比值小于0.3为1级损伤或轻微损伤,0.3~0.6 为2级损伤或中级损伤,0.6 以上为3级损伤或严重损伤[21]。用SPSS 9.0 对数据进行处理分析,用单因素方差分析进行显著性检验,q 检验进行两两比较。
2 结果(Results)
2.1 DNA损伤指标的统计
随着处理时间的延长,各浓度苯并[a]芘和菲处理组血细胞彗尾核DNA百分率均呈持续上升的趋势,比较各浓度染毒组与对照组发现(图1和图2):实验初期第3天,各浓度组尾核DNA百分率均与对照组无显著差异,到了实验第7天后,至染毒时间末期第15天,中、高浓度组(0.15 mg·L-1和0.45 mg·L-1)对血细胞DNA损伤效果显著(P<0.05), 低浓度组对 DNA 损伤均不显著。恢复试验期,各浓度组DNA百分率仍高于对照组,中、高浓度组与对照组依然差异性显著(P<0.05)。

图1 苯并[a]芘处理组带彗尾核DNA百分率注:*为与对照组相比显著性差异P<0.05Fig. 1 Percentage of damaged DNA with tail treatedby benzo[a]pyreneNote: significant differences from control at the same samplingtime are indicated with an asterisk at P<0.05

图2 菲处理组带彗尾核DNA百分率注:*为与对照组相比显著性差异P<0.05Fig. 2 Percentage of damaged DNA with tail treatedby phenanthreneNote: significant differences from control at the same samplingtime are indicated with an asterisk at P<0.05
2.2 DNA损伤程度
在苯并[a]芘和菲染毒下的缢蛏血细胞DNA损伤程度来看(表1),随着处理时间延长,3 d 时中、低浓度(0.15 mg·L-1和0.05 mg·L-1)苯并芘[a]和菲处理组DNA 损伤程度以2级为主(均小于0.6),高浓度组则以3级损伤为主(大于0.6),损伤率超过80%; 15 d 后除低浓度组外,其他各处理组DNA损伤程度呈现继续上升的趋势,造成DNA损伤严重级别(大于0.6)。与对照组差异性显著(P<0.05),21 d 恢复实验以后,各处理组DNA损伤程度均有所缓解,但中、高浓度组(0.15 mg·L-1和0.45 mg·L-1)与对照组差异性仍十分显著(P<0.05) 。
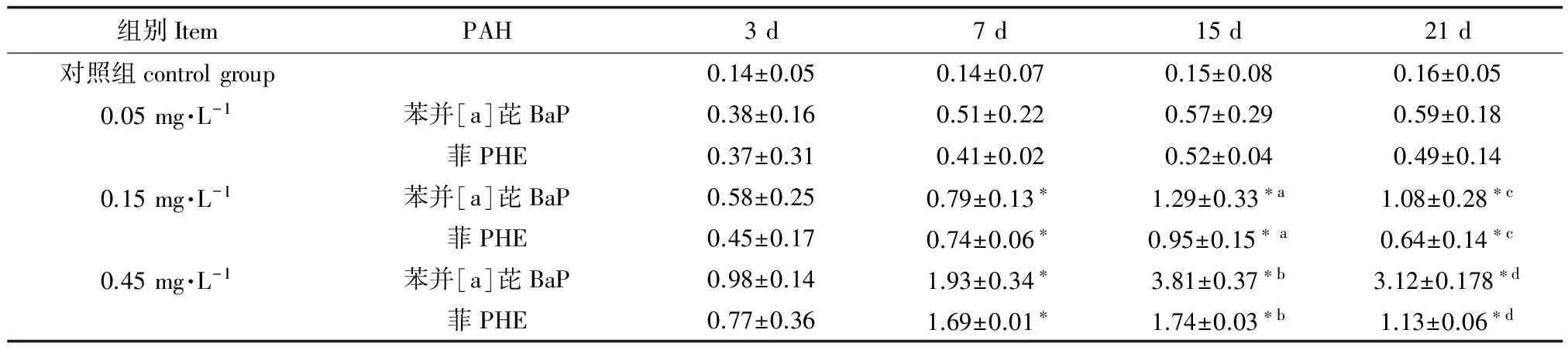
表1 处理受损DNA的TL/D值
注:*为与对照组相比显著性差异P<0.05, a,b,c,d分别为各纵列相比显著性差异P<0.05。
Note: significant differences from control at the same sampling time are indicated with an asterisk at P<0.05, a, b, c, d for each column compared with the significant difference in P<0.05, respectively.
2.3 损伤检测指标间的相关性
损伤检测指标间的相关系数列于表2。从表2可见,尾长、TDNA含量、尾长/核直径(TL/D)各指标间的相关系数均有显著性(P<0.05)。说明在本实验室条件下应用Scion Image Beta 4.0.2图像软件进行分析所得的尾长、TDNA含量、尾长/核直径(TL/D)3个指标值用来衡量血细胞DNA损伤具有较好的有效性。
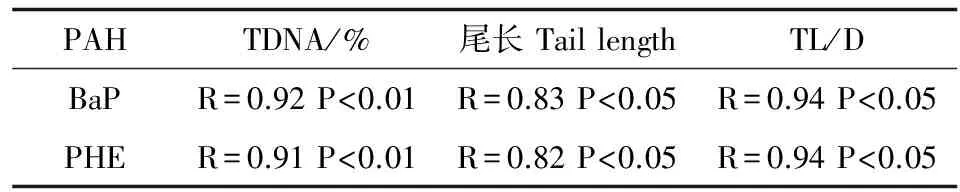
表2 彗星实验检测指标间的相关系数
2.4 DNA分子形态学的影响
在苯并[a]芘和菲染毒15 d后,缢蛏血细胞核DNA 单细胞凝胶电泳结果如图1所示。图1a和图1d显示对照组的血细胞核大小比较均一,为圆形荧光团,荧光强度均匀,边缘光滑,无拖尾现象,表明细胞没有断裂。中浓度(0.15 mg·L-1)组的苯并[a]芘和菲染毒后,断片离头部向阳极方向迁移,形成一个紧连荧光头部的尾部,缢蛏血细胞DNA发生断裂(图1b和图1e)。高浓度组(0.45 mg·L-1)的菲染毒后,出现一定数量的凋亡细胞,彗星头部很小,尾巴很大且偏圆,如同松鼠尾巴(图1f)。高浓度组的苯并[a]芘染毒后,出现分散暗淡的尾部,损伤更为严重(图1f)。

图1 苯并芘[a]和菲暴露后第15天分别对溢蛏血细胞的DNA 损伤作用注:a. 对照组 b. BaP (0.15 μg·L-1)染毒后15 d c. BaP (0.45 μg·L-1)染毒后15 dd. 对照组 e. PHE(0.15 μg·L-1)染毒后15 d f. PHE(0.45 μg·L-1)染毒后15 dFig. 1 The DNA damage of hemolymph cell exposed to benzo[a]pyrene and phenanthrene at the fifteenth dayNote: a. The DNA damage of hemolymph cell exposed to solvent control group; b. The DNA damage of hemolymph cell exposed to benzo[a]pyrene (0.15 μg·L-1); c. The DNA damage of hemolymph cell exposed to benzo[a]pyrene (0.45 μg·L-1); d. The DNA damage of hemolymph cell exposed to solvent control group; e. The DNA damage of hemolymph cell exposed tophenanthrene (0.15 μg·L-1); f. The DNA damage of hemolymph cell exposed to phenanthrene (0.45 μg·L-1)
3 讨论(Discussion)
大量研究证明持久性有机污染物进入生物体内经过I相细胞色素P450酶系代谢转化为更具极性的代谢中间产物,这些代谢产物在II相代谢酶谷胱甘肽-S-转移酶等催化下与内源物质分子结合,加速了代谢产物排出体外的速度;另一方面在代谢过程中产生大量的自由基,可被体内抗氧化防御系统所清除同时,这些自由基和活性中间产物超过一定限度时,可分别与分子发生反应,产生氧化性损伤和生成加合物,最终导致DNA链断裂和损伤[22-24]。
苯并[a]芘进入动物体后被转化成大量的代谢产物,其亲水性比苯并[a]芘更强[25],而这些代谢产物在生物体内经过代谢后产生致癌性物质——苯并(a)芘二氢二醇(BPDE),它与DNA共价结合形成稳定的加合物,从而导致DNA损伤。国内学者针对苯并[a]芘对生物遗传物质DNA的影响做了广泛的研究。周海龙等以及Liu等[26-27]的研究结果也显示,3种典型持久性有机污染物(多氯联苯Aroclor1254、苯并[a]芘和滴滴涕)对紫贻贝(Mytilusedulis)的鳃、性腺和消化腺各组织细胞以及栉孔扇贝血细胞的DNA 损伤作用均存在明显的时间-效应和剂量-效应关系。PAHs 代谢过程中产生的活性氧自由基能攻击DNA,导致DNA单链断裂或形成不稳定的无嘌呤的加合物[28]。菲能通过降低细胞膜的稳定性和吞噬能力,继而对大海扇蛤(Pectenmaximus)的遗传和免疫造成不利影响[29]。Oliveria等曾将金梭Lizaaurata短期暴露于菲溶液中,发现菲溶液浓度由0.1 μg·L-1提高到0.9 μg·L-1时其对肝脏DNA的完整性显著低于对照组[30]。本次实验亦发现经不同浓度的苯并[a]芘和菲溶液染毒下,缢蛏血细胞DNA受到了一定程度的链断裂损伤,其损伤效应表现出随苯并[a]芘和菲浓度的升高,损伤的细胞数量增多和损伤程度加重的现象(图1~图3)。从表3可见,实验第3d,对照组的血细胞未检测到DNA损伤;而中低浓度处理组实验检测到DNA损伤程度集中在2级;高浓度处理组检测到DNA损伤程度则在3级以上,损伤率超过80%;而且随着处理时间的延长,带彗尾核DNA百分率和TL/D值均呈上升趋势,DNA 损伤级别也逐步升高。王春光等报道的苯并[a]芘可对马氏珠母贝(Pinctadamartensi)血细胞DNA的损伤效应也与本实验相一致[14]。
DNA 损伤是评价环境毒物遗传毒性的一个重要参数。本研究中,随着苯并[a]芘和菲暴露时间的增加,两种污染物在缢蛏体内逐渐累积,组织解毒代谢酶受到抑制,诱导大量自由基产生,同时代谢形成的极性化合物与DNA发生反应,导致DNA链断裂和损伤,从而引发遗传毒性。从图3和表1可见,缢蛏血细胞暴露于高浓度苯并[a]芘和菲溶液中DNA损伤严重,均表现出不可逆转的遗传毒性,而中浓度处理组虽启动了DNA损伤修复功能,但仍造成损伤效应,在实验恢复期(21 d),DNA损伤性指标与对照组仍有显著差异。由此贝类DNA损伤可作为多环芳烃污染评价的毒性效应指标,亦作为海洋环境污染的潜在生物标志物。
此外,实验中也发现相同浓度作用下,苯并[a]芘和菲对缢蛏血细胞DNA损伤效应趋势虽然相同,但相较而言,苯并[a]芘对缢蛏血细胞DNA链断裂更为明显(表1),表明其对缢蛏血细胞的遗传毒性更显著。造成这种毒性的差异可能与两者之间的分子结构及毒性作用机制有一定关系,其机理还需待进一步验证和研究。
致谢:本实验得到了江苏省启东市金海岸水产研究所朱善央老师的大力支持和帮助。
[1] Menzie C A, Potocki B B, Santodonato J. Exposure to carcinogenic PAHs in the environment [J]. Environmental Science & Technology 1992, 26:1278-1284
[2] 秦宁, 何伟, 孔祥臻, 等. 中国水生生态系统中多环芳烃的生态毒性与生态风险研究进展[J]. 中国科技论文, 2013, 8(12): 1209-1218
Qin N, He W, Kong X Z, et al. Research progress in ecotoxicity and eco-risk assessment of polycyclicaromatic hydrocarbons in China’s aquatic ecosystems [J]. China Science Paper, 2013, 8(12): 1209-1218 (in Chinese)
[3] 袁馨, 潘声旺, 陈勇, 等. 蚯蚓对土壤-植物系统中菲,芘降解的强化效应研究[J]. 农业环境科学学报, 2011, 30(5): 904-911
Yuan X, Pan S W, Chen Y, et al. Enhancing effects of earthworms on the degradation of phenanthrene and pyrene in soil-plant system [J]. Journal of Agro-Environment Science, 2011, 30(5): 904-911(in Chinese)
[4] 杨涛. 菲、苯并(b)荧蒽胁迫对翡翠贻贝、红鳍笛鲷和紫红笛鲷的毒性效应[M]. 上海海洋大学. 2011
Yang T. Effects of Phenanthrene,benzo[b]fluoranthene on Perna Viridis,Lutjanus Erythropterus and Lutjanus Argentimaculatus [M]. Shanghai Ocean University, 2011 (in Chinese)
[5] Zhang J, Yang J, Wang R, et al. Effects of pollution sources and soil properties on distribution of polycyclic aromatic hydrocarbons and risk assessment [J]. Science of The Total Environment, 2013, (463): 1-10
[6] 岳敏, 谷学新, 邹洪. 多环芳烃的危害与防治[J]. 首都师范大学学报(自然科学版), 2003, 24(3): 40-44
Yue M, Gu X X, Zhou H. The analysis quantitatively the grating diffraction of electron probability wave [J]. Journal of Capital Normal University (Natural Science Edition), 2003, 24(3): 40-44 (in Chinese)
[7] 骆苑蓉, 胡忠, 郑天凌, 等. 红树林沉积物中的微生物对苯并[a]芘的降解研究[J]. 厦门大学学报(自然科学版), 2005, 44: 75-79
Luo F R, Hu Z, Zhen T L, et al. Biodegradation of benzo[a]pyrene by mangrove microbial consortium [J]. Journal of Xiamen University (Natural Science), 2005, 44: 75-79 (in Chinese)
[8] Hwang S, Cutright T. Biodegradability of aged pyrene and phenanthrene in a natural soil [J]. Chemosphere, 2002, 47: 891-899
[9] Cheema S A, Imran Khan M, Shen C, et al. Degradation of phenanthrene and pyrene in spiked soils by single and combined plants cultivation [J]. Journal of Hazardous Materials, 2010, 177: 384-389
[10] Khan M, Cheema S, Shen C, et al. Assessment of phenanthrene bioavailability in aged and imaged soils by mild extraction [J]. Environment Monitoring and Assessement, 2012, 184: 549-559
[11] 苗晶晶, 潘鲁青, 王静. 苯并[a]芘对栉孔扇贝(Chlamysfarreri)组织显微和超微结构的影响[J]. 环境科学学报, 2007, 27(9): 1497-1503
Miao J J, Pan L Q, Wang J. Effects of B[a]Ponmicro and ultrastructure of gill and digestive gland ofChlamysfarreri[J]. Acta Scientiae Circumstantiae, 2007, 27(9): 1497-1503 (in Chinese)
[12] Ching E W K, Siu W H L, Lam P K S, et al. DNA Adduct formation and DNA strand breaks in greenlipped mussels (Pernaviridis) exposed to benzo[a]pyrene: Doseand timedependent relationships [J]. Marine Pollution Bulletin, 2000, 42: 603- 610
[13] Deena M, Wassenberg E, Swails E, et al. Effects of single and combined exposures to benzo (a) pyrene and 3, 3 '4, 4 '5pentachlorobiphenylon EROD activity and development in Fundulus heteroclitus[J]. Marine Environmental Research, 2002, 54: 279-283
[14] 王春光, 李裕红, 林志勇, 等. 苯并[a]芘对真鲷(Pagrosomusmajor)血细胞DNA 损伤的慧星实验研究[J]. 农业环境科学学报, 2006, 25(6): 1446-1449
Wang C G, Li Y H, Lin Z Y, et al. DNA Damage in blood cells ofPagrosomusmajorexposed to benzo[a]pyrene (BaP) by the comet assay [J]. Journal of Agro-Environment Science, 2006, 25(6): 1446-1449 (in Chinese)
[15] 王晓艳, 蒋凤华, 冯丽娟, 等. 石油烃对栉孔扇贝血淋巴细胞DNA损伤的初步研究[J]. 生态毒理学报, 2012, 7(3): 305-311
Wang X Y, Jiang F H, Fen L J, et al. Effect of petroleum hydrocarbons on DNA damage of hemolymph cells scallopchalamysfarreri: A preliminary research [J]. Asian Journal of Ecotoxicology, 2012, 7(3): 305-311 (in Chinese)
[16] Hamoutene D, Payne J F, Rahimtula A, et al. Use of the comet assay to assess DNA damage in hemocytes and digestive gland cells of mussels and clams exposed to water contaminated with petroleum hydrocarbons [J]. Marine Environmental Research, 2002, 54(3-5): 471-474
[17] 郁昂, 陈荣, 王重刚, 等. 柴油水溶性成分对僧帽牡蛎DNA损伤的初步研究[J]. 海洋科学, 2004, 28(11): 10-14
Yu A, Chen R, Wang C G, et al. DNA damage in oyster (Ostereacucullata) exposed to water-soluble fraction of 0#diesel fuel [J]. Marine Sciences, 2004, 28(11): 10-14 (in Chinese)
[18] 张先勇, 刁晓平, 杨宝, 等. 苯并[a]芘对马氏珠母贝血淋巴细胞DNA损伤的研究[J]. 生态环境学报, 2011, 20(6-7): 1107-1110
Zhang X Y, Diao X P, Yang B, et al. Effect of benzo[a]pyrene on DNA damage of hemolymph cells inPinctadamartensi[J]. Ecology and Environmental Sciences, 2011, 20(6-7): 1107-1110 (in Chinese)
[19] 国家质量监督检验检疫总局. GB 17378-2007 海洋监测规范[S]. 北京, 2008
[20] Singh N P, McCoy M T, Tice R R, et al . A simple technique for quantitation of low levels of DNA damage in individual cells [J]. Experimental Cell Research, 1988, 175: 184- 191
[21] 张迎梅, 王叶菁, 虞闰六, 等. 重金属Cd2+、Pb2+和Zn2+对泥鳅DNA损伤的研究[J]. 水生生物学报, 2006, 30(4): 399-403
Zhang Y M, Wang Y J, Yu R L, et al. Effects of heavy metals Cd2+、Pb2+and Zn2+on DNA damage of loach Misgurnus angullicandatus [J]. Acta Hydrobillogica Sinica, 2006, 30(4): 399-403 (in Chinese)
[22] Walker C H. Avian forms of cytoehrome P450 [J]. Environmental Health Perspectives, 1998, 106(52): 613-620
[23] 朱琳, 钱芸, 刘广良. 等. 细胞色素P450酶系及其在毒理学上的应用[J]. 上海环境科学, 2001, 20(2): 88-91
Zhu L, Qian Y, Liu G L, et al. Cytochrome P450 enzyme family and its application to toxicology [J]. Shanghai Enviromnetal Sciences, 2001, 20(2): 88-91 (in Chinese)
[24] Goldstone J V, Goldstone H M. Cytoehrome P4501 genes in early deuterostomes (tunieates and sea urehins) andverteb rates (ehiekenandfrog): Originand diversifieation of the CYP1 gene family [J]. Molecular biology and evolution, 2007, 24(12): 2619-2631
[25] Baumann P C, Harsharge J C. Decline in liver neoplasms in wild brown bullhead catfish after Coking plant closes and environmental PAHs plummet [J]. Environmental Health perspectives, 1995, 103(2): 168-170
[26] 周海龙, 张林宝, 曲莹, 等. 三种典型POP对紫贻贝不同组织损伤的比较研究[J]. 海洋科学, 2011, 35(2): 32-37
Zhou H L, Zhang L B, Qu Y, et al. Comparative study of the DNA damage in three tissues of blue mussel (Mytilus edulis) after exposure to three typical POPs [J]. Marine Science, 2011, 35(2): 32-37 (in Chinese)
[27] Liu J, Pan L Q, Zhang L, et al. Immune responses, ROS generation and the haemocyte damage of scallop Chlamys farreri exposed to Aroclor 1254 [J]. Fish & Shellfish Immunology, 2009, 26(3): 422-428
[28] 蒋闰兰, 肖佰财, 禹娜, 等. 多环芳烃对水生动物毒性效应的研究进展[J]. 海洋渔业, 2014, 36(4): 372-384
Jiang R L, Xiao B C, Yu N, et al. Research advance in toxic effects of PAHs on aquatic animals [J]. Marine Fisheries, 2014, 36(4): 372-384
[29] Hannam M L, Bamber S D, Galloway T S, et al. Effects of the model PAH phenanthrene on immune function and oxidative stress in the haemolymph of the temperate scallopPectenmaximus[J].Chemosphere, 2010,78: 779-784
[30] Olivera M, Pacheco M, Santos M A, et al. Cytochrome P4501A, genotoxic and stress responses in golden grey mullet (Liza aurata) following short-term exposure to phenanthrene [J]. Chemosphere, 2007, 66: 1287-1291
◆
Effects of Benzo[a]pyrene and Phenanthrene on DNA Damage of Hemolymph Cell inSinonovaculaconstricta
Jiang Mei1,*, Li Lei1, Shen Xinqiang1,Xu Gaopeng2,Yang Jie qing2
1. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China 2. Shanghai Ocean University, Shanghai 201306, China
Received 8 February 2015 accepted 8 March 2015
The paper reported the DNA damage effect of Benzo[a]pyrene(BaP) and phenanthrene (PHE) on the calmSinonovaculaconstrictaunder different concentration conditions with the single cell microgel electrophoresis (SCGE) technique. The calm were treated with concentrations (BaP: 0.45, 0.15, 0.05 mg·L-1and PHE: 0.45, 0.15, 0.05 mg·L-1) in control group was 0.00 mg·L-1for 15 days and were removed pollution for 6 days. The result showed the tail DNA percentage (DNA%) and TL/D of the 0.45 mg·L-1groups were significantly different from the control group (P<0.05) after 7 days exposure period. Furthermore, the damage intensity of treated groups increased gradually with respect to the increasing of Bap and PHE. Under the same concentration, the tail DNA% and TL/D increased gradually with the time of exposure. The DNA damage induced by BaP and PHE was very serious under the concentration of 0.45 mg·L-1. There was significant time-nd dose-dependent damage to the hemolymph cells. In addition, the toxic effect of BaP was much more than PHE. The comet assay was proven to be a useful tool for detecting DNA damage induced by PAH in marine hemolymph cells.DNA damage in hemolymph cells of could indicate the effects of BaP and PHE in marine environment as a good biomarker to be used in early warning and monitoring.
benzo[a]pyrene and phenanthrene; Sinonovacula constricta; DNA damage; single cell gel electrophoresis (SCGE); Comet assay;
中国水产科学研究院基本科研业务费(2014A02XK01);农业部应对溢油关键技术专项(2012-2014);中央级公益性科研院所基本科研业务费专项(2014T06);国家现代农业产业技术体系建设项目(CARS-48)
蒋玫(1973-),女,研究员,研究方向为海洋生态环境和渔业生态学,E-mail: jiangrose73@163.com
10.7524/AJE.1673-5897-20150208001
2015-02-08 录用日期:2015-03-08
1673-5897(2015)3-281-07
X820.4
A
蒋玫,李磊,沈新强, 等. 苯并[a]芘和菲对缢蛏血细胞DNA损伤的研究[J]. 生态毒理学报,2015, 10(3): 281-287
Jiang M, Li L, Shen X Q, et al. Effects of benzo[a]pyrene and phenanthrene on DNA damage of hemolymph Cell in Sinonovacula constricta [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 281-287 (in Chinese)

