微囊藻毒素-LR通过线粒体途径诱导人支气管上皮细胞凋亡
薛利剑,刘晓蕙,杨明峰,刘 迎,朱 靖,乔 豆,庄东刚,崔留欣,张慧珍,*
1. 郑州大学公共卫生学院,郑州 450001 2. 河南中医学院基础医学院,郑州 450046
微囊藻毒素-LR通过线粒体途径诱导人支气管上皮细胞凋亡
薛利剑1,刘晓蕙2,杨明峰1,刘 迎1,朱 靖1,乔 豆1,庄东刚1,崔留欣1,张慧珍1,*
1. 郑州大学公共卫生学院,郑州 450001 2. 河南中医学院基础医学院,郑州 450046
探讨线粒体Caspase依赖性途径是否参与微囊藻毒素-LR (microcystin-LR, MC-LR)诱导人支气管上皮细胞(human bronchial epithelial cells, 16HBE)凋亡过程。将处于对数生长期的16HBE分别暴露于终浓度为0(对照组)、2.5、5、10 μg·mL-1的微囊藻毒素-LR和10 μg·mL-1MC-LR+50 μmol·L-1Caspase广谱抑制剂Z-VAD-FMK,持续24 h和48 h。检测细胞凋亡率,线粒体跨膜电位(ΔΨm),Caspase-3和Caspase-9相对表达量。结果显示,与对照组相比,各浓度染毒组细胞凋亡率和Caspase-3、Caspase-9相对表达量均升高,10 μg·mL-1MC-LR染毒组线粒体膜电位降低;与10 μg·mL-1MC-LR组相比,10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK组细胞凋亡率明显降低,Caspase-3和Caspase-9相对表达量降低,差异均有统计学意义(P<0.05)。且随着MC-LR染毒浓度的升高或染毒时间的延长,16HBE细胞凋亡率和Caspase-3、Caspase-9相对表达量呈升高趋势。研究表明,MC-LR可以通过线粒体Caspase依赖性途径诱导16HBE细胞凋亡。
微囊藻毒素-LR;线粒体途径;人支气管上皮细胞;凋亡
微囊藻毒素(microcystins, MCs)是蓝藻生长过程中释放的代谢产物,是一组具有生物活性的单环七肽化合物,由水体中的蓝藻如铜绿微囊藻等产生,是对人类及动物健康威胁最大的一种细胞内毒素。目前检测到90余种微囊藻毒素的异构体,其中微囊藻毒素-LR(microcystin-LR, MC-LR)是最常见,也是毒性最强的一种藻毒素[1]。2006年,MC-LR被国际癌症研究组织列为对人类可能致癌物,有可能是一种促癌剂。研究发现MC-LR可能的促肝癌机制是其能与蛋白磷酸酶PPl、PP2A的催化亚单位结合,抑制二者的活性,导致MAPK过度激活,使调控细胞增殖与凋亡的基因平衡失调,细胞生长失控,导致肝癌发生。也有报道称,MC-LR可通过诱导细胞c-fos、c-jun异常表达以及细胞周期的调控失衡,从而促进癌症的发生[2]。
目前对MCs研究较多的是其对肝、肾、淋巴细胞以及生殖细胞等的凋亡毒性作用以及机制探索[3-4],对呼吸系统的影响研究较少,然而二十世纪以来,在许多国家和地区均有发生产毒藻类引起人类呼吸系统中毒的事件[5-6]。研究发现MCs可能会因水体泡沫和娱乐过程中产生的浪花等通过肺部呼吸进入到人体,从而引起呼吸系统疾病[7]。MC-LR能刺激肺泡吞噬细胞释放炎性因子[8];破坏小鼠肺实质,引起肺间质性水肿以及炎性细胞的聚集,但并未抑制肺组织内蛋白磷酸酶PPl、PP2A的活性[9]。现已有报道都是关于MCs对呼吸系统的损伤,尚缺乏对其具体作用机制的研究。
细胞凋亡是一种程序性细胞死亡,在维持多细胞生物体内平衡,免疫力以及预防癌症中起着关键作用。线粒体在细胞凋亡中起着重要作用。通过线粒体途径执行细胞凋亡会导致线粒体结构和功能异常,如线粒体膜通透性增加,膜电位降低,其中在细胞凋亡中起作用的凋亡促进蛋白细胞色素C(cytochrome-c, Cyt-c)从线粒体释放到细胞质,Cyt-c的释放会刺激凋亡小体复合物的形成,然后通过切割裂解导致半胱氨酸天冬氨酸蛋白酶-9(Caspase-9)的激活,接着导致效应凋亡蛋白酶例如Caspase-3, Caspase-6, Caspase-7的激活。Caspase-3, Caspase-6, Caspase-7的激活会执行靶细胞凋亡的最后阶段[10]。
因此,本研究测定细胞凋亡率和线粒体膜电位以及Caspase-3和Caspase-9各指标的变化,观察MC-LR对人支气管上皮细胞(human bronchial epithelial cells, 16HBE)的凋亡作用,并且测定加入Caspase广谱抑制剂Z-VAD-FMK后Caspase-3, Caspase-9以及细胞凋亡率的变化,从而探讨线粒体Caspase依赖性途径是否参与MC-LR诱导 16HBE细胞凋亡过程。
1 材料与方法(Materials and methods)
1.1 细胞及受试物
16HBE获赠于纽约血液中心(New York Blood Center)安秀丽教授。MC-LR(纯度≥95%)购自北京伊普瑞斯科技有限公司。
1.2 培养基及试剂
RPMI-1640培养液购自北京索莱宝科技有限公司。胎牛血清购自杭州四季青生物工程材料有限公司。线粒体膜电位检测试剂盒和Caspase抑制剂Z-VAD-FMK(20 mmol·L-1)购自碧云天生物技术研究所。凋亡检测试剂盒和兔抗Caspase-3,Caspase-9,β-actin多克隆抗体及辣根过氧化物酶山羊抗兔IgG购自南京凯基生物科技发展有限公司。
1.3 器材
WJ-Ⅱ细胞培养箱购自美国Revco公司。流式细胞仪购自美国BD公司。DYCZ-24DN型垂直电泳仪,DYCZ-40D型湿转转电泳槽及WD-9405B型水平摇床购自北京六一仪器厂。
1.4 细胞培养
从-80°C冰箱中取出保存的16HBE细胞冻存管,迅速放入37 °C热水中,快速将冻存液融化后,然后加入10倍体积37 °C预热含10%胎牛血清的RPMI-1640培养液,1 000 r·min-1离心5 min,弃上清,用含10%胎牛血清的1640培养基重悬细胞,置于37°C、含5%CO2培养箱中培养,第二天更换新鲜培养基,待细胞密度达到90%时传代。
1.5 检测指标及方法
1.5.1 细胞凋亡率的测定( Annexin V/PI双染法)
取处于对数生长期终密度为1×105个·mL-1的16HBE细胞悬浮液,以每孔1 mL细胞悬浮液接种于12孔培养板中培养24 h后,吸出培养液,设置0 μg·mL-1MC-LR对照组和2.5、5、10 μg·mL-1MC-LR以及10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK实验组,每组3个平行样,放入孵育箱中分别培养24 h,48 h。染毒结束后,去除原液,缓冲液冲洗2次,加入胰酶消化细胞,收集细胞,Binding Buffer重悬细胞,混匀,分别加入10 μL FITC和10 μL PI,轻轻混匀,避光反应15 min,流式检测。本实验重复3次。
1.5.2 细胞线粒体膜电位的测定(JC-1法)
当细胞密度达到80%时,消化传代,调整细胞密度为1×105个·mL-1置于12孔培养板中,培养24 h,吸出培养液,设置10%血清RPMI-1640培养液的阴性对照组和终浓度分别为2.5、5、10 μg·mL-1MC-LR溶液的实验组,每个处理组3个平行样。各组分别培养24 h和48 h。去除各组原液,缓冲液冲洗2次,加入胰酶消化细胞,收集细胞,加入JC-1染色工作液培养箱中孵育25 min,4 °C,2 000 r离心收集细胞,最后加入JC-1染色缓冲液(1X)悬浮细胞,30分钟内用流式细胞仪检测各样本红、绿荧光强度比,检测JC-1单聚体时的激发光设置490 nm,发射光设置为530 nm,检测JC-1聚合物时,激发光设置为525 nm,发射光设置为590 nm。本实验重复3次。
1.5.3 细胞中Caspase-3和Caspase-9蛋白表达量的测定 (Western blot法)
不同浓度MC-LR及联合Caspase抑制剂染毒结束后,收集细胞到离心管中,各组离心管中加入蛋白裂解液200 μL,震荡混匀,冰上裂解30 min,用枪头反复吹打保证细胞充分裂解。然后4 °C,12 000 r·min-1,离心5 min,取上清液,BCA法测定蛋白浓度,分装,-80 °C保存备用。
根据目的蛋白分子量大小,配制12%分离胶和5%浓缩胶,蛋白变性后上样恒压电泳(浓缩胶:80 v,30min;分离胶:120 v,10min。根据预染marker标记的位置将目的蛋白切下,湿转法进行转膜。转膜后用5%脱脂奶粉室温下封闭2 h。室温下孵育一抗,一抗稀释浓度: Caspase-3 (1:200)和Caspase-9(1:200)。TBST漂洗15 min,重复3次。二抗(1:5 000)孵育1 h,TBST漂洗15 min,重复3次。ECL发光,暗室中曝光、显影及定影。Image Quant 300 成像系统处理蛋白条带图像。
1.6 统计学方法
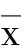

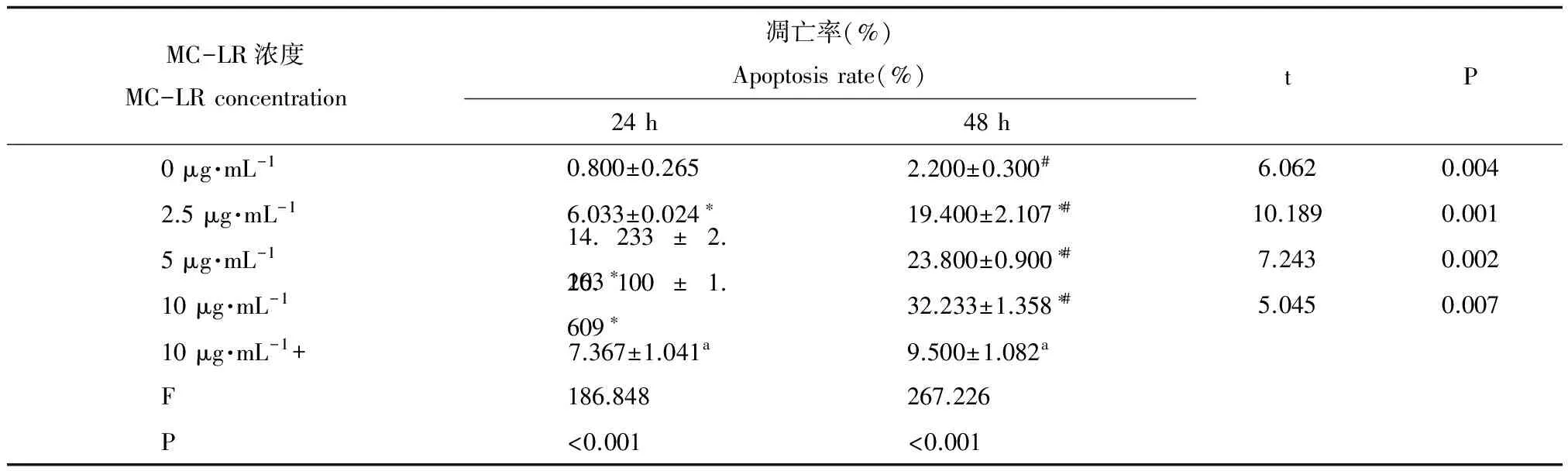
MC-LR浓度MC-LRconcentration凋亡率(%)Apoptosisrate(%)24h 48h tP0μg·mL-10.800±0.2652.200±0.300#6.0620.0042.5μg·mL-16.033±0.024∗19.400±2.107∗#10.1890.0015μg·mL-114.233±2.103∗23.800±0.900∗#7.2430.00210μg·mL-126.100±1.609∗32.233±1.358∗#5.0450.00710μg·mL-1+7.367±1.041a9.500±1.082aF186.848267.226P<0.001<0.001
注:*表示与对照(0 μg·mL-1)组相比,P<0.05。#表示同一MC-LR浓度下,与24 h组相比,P<0.05;a表示同一作用时间下,与10 μg·mL-1MC-LR组相比,P<0.05;10+表示10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK组。
Note: *P<0.05, compared with the control group(0 μg·mL-1).#P<0.05, compared with the 24 h at the same concentration of MC-LR. a representing P<0.05, compared with the 10 μg·mL-1at the same time of exposure. 10+representing 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK group.

图1 不同浓度MC-LR对16HBE细胞凋亡的影响注:A: 0 μg·mL-1MC-LR(24h) B: 2.5 μg·mL-1MC-LR(24h) C: 5 μg·mL-1MC-LR(24h) D: 10 μg·mL-1MC-LR(24h)E: 0 μg·mL-1MC-LR(48h) F: 2.5 μg·mL-1MC-LR(48h) G: 5 μg·mL-1MC-LR(48h) H: 10 μg·mL-1MC-LR(48h)P: 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK(24h) O: 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK(48h)。Fig. 1 Effect of MC-LR on apoptosis of 16HBE cellsNote: A: 0 μg·mL-1MC-LR (24h) B: 2.5 μg·mL-1MC-LR(24h) C: 5 μg·mL-1MC-LR(24h) D: 10 μg·mL-1MC-LR(24h)E: 0 μg·mL-1MC-LR (48h) F: 2.5 μg·mL-1MC-LR(48h) G: 5 μg·mL-1MC-LR(48h) H: 10 μg·mL-1MC-LR(48h)P: 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK(24h) O: 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK(48h).
2 结果(Results)
2.1 MC-LR对16HBE细胞凋亡的影响
流式检测不同浓度MC-LR对16HBE细胞凋亡率的影响见表1、图1。当暴露时间一定时,随着MC-LR暴露浓度的增加,16HBE细胞凋亡率呈上升趋势;当MC-LR暴露浓度一定时,随着暴露时间的增加,16HBE细胞凋亡率升高。当MC-LR浓度为10 μg·mL-1时,加Z-VAD-FMK组与不加组相比,细胞凋亡率明显降低,且差异有统计学意义(P<0.05)。
2.2 MC-LR对细胞线粒体膜电位的影响
JC-1法检测不同浓度MC-LR对16HBE细胞线粒体膜电位的影响见表2。当MC-LR作用细胞时间一定,MC-LR暴露浓度为10 μg·mL-1时,与对照组相比,线粒体膜电位明显降低,并有统计学意义(P<0.05);MC-LR暴露浓度分别为2.5、5 μg·mL-1时,线粒体膜电位的变化无统计学意义(P>0.05)。当MC-LR浓度为10 μg·mL-1时,48 h组与24 h组相比,16HBE细胞线粒体膜电位明显降低,且差异有统计学意义(P<0.05)。
2.3 MC-LR对细胞中Caspase-3和Caspase-9蛋白表达的影响
MC-LR作用于16HBE细胞24 h和48 h后, 细胞中Caspase-3和Caspase-9各蛋白相对表达量见表3、图2。16HBE细胞暴露于MC-LR 24 h后,2.5、5、10 μg·mL-1MC-LR剂量组Caspase-3,Caspase-9蛋白相对表达量与对照组相比升高,并且差异均有统计学意义(P<0.05)。 MC-LR作用16HBE细胞48 h后,各蛋白相对表达量的变化趋势与MC-LR作用24 h基本一致。当16HBE细胞暴露于相同MC-LR浓度时, 48 h组与24 h组相比,Caspase-3和Caspase-9蛋白相对表达量增加,且差异有统计学意义(P<0.05)。当MC-LR浓度为10 μg·mL-1时,加Caspase抑制剂Z-VAD-FMK组与不加抑制剂组相比,Caspase-3和Caspase-9蛋白相对表达量降低,并且差异有统计学意义(P<0.05)。

注:*表示与对照(0 μg·mL-1)组相比,P<0.05。#表示10 μg·mL-1MC-LR 组24 h 与48 h相比,P<0.05。Note: *P<0.05, compared with the control group(0 μg·mL-1). #P<0.05, 10 μg·mL-1MC-LR group (24 h) compared with the 10 μg·mL-1MC-LR group (48 h).

表3 不同浓度 MC-LR对细胞中Caspase-3和Caspase-9相对表达量的影响
注:*表示与对照(0 μg·mL-1)组相比,P<0.05。#表示同一MC-LR浓度下,与24 h组相比,P<0.05;a表示同一作用时间下,与10 μg·mL-1MC-LR组相比,P<0.05;10+表示10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK组。
Note:*P<0.05, compared with the control group(0 μg·mL-1).#P<0.05, compared with the 24 h at the same concentration of MC-LR. a representing P<0.05, compared with the control group (10 μg·mL-1) at the same time of exposure. 10+representing 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK group.
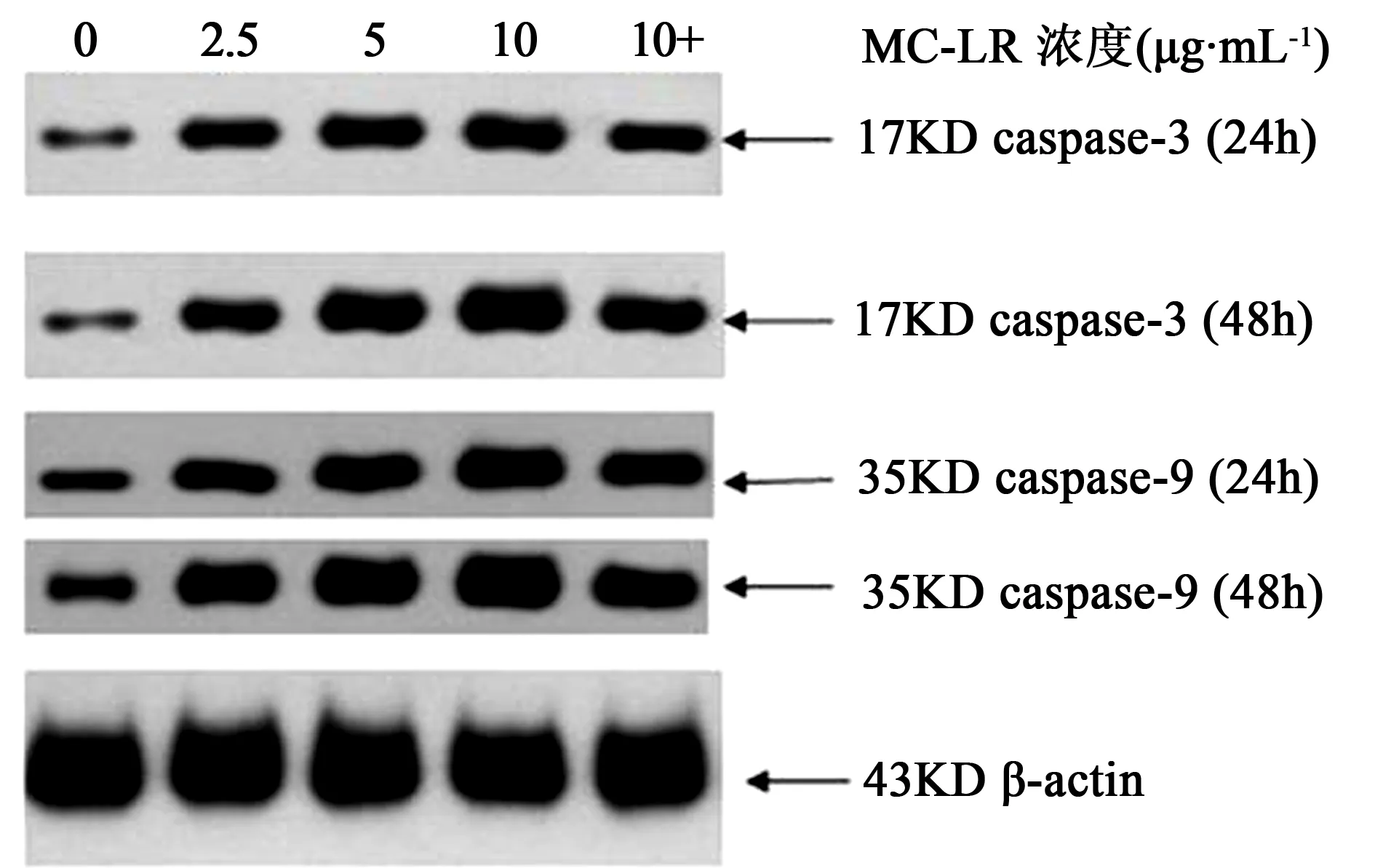
图2 MC-LR对16HBE细胞中caspase-3和caspase-9蛋白表达的影响注:+表示加入Caspase抑制剂Z-VAD-FMK (50 μmol·L-1)。Fig. 2 Effect of MC-LR on protein expression levels ofCaspase-3 and Caspase-9Note: + representing 10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK
3 讨论(Discussion)
支气管上皮细胞的增殖以及损伤是肺组织修复、再生、肺纤维化和致癌作用的关键。当支气管上皮细胞受到不良因素刺激时,可以引起细胞氧化应激,进一步引起基因的损伤、激活原癌基因或者抑制肿瘤抑制基因,以及引起凋亡调节基因的变化,进而引起支气管上皮细胞的癌变转化[11]。近半世纪以来,许多国家和地区肺癌的发病率和死亡率均大幅度的增加,已经发展成为死亡率最高的恶性肿瘤之一,严重威胁着人类健康和生命。肺癌的发病是一个多因素、多阶段的过程,是各种因素复杂交互作用的结果。虽然吸烟是肺癌发病的最主要危险原因,却无法解释很多肺癌患者并不吸烟的这一流行病学现象,因此环境因素与肺癌发生的相关研究已成为近年来肺癌分子流行病学热点[12]。
目前,被广泛认知的细胞两大凋亡途径包括:线粒体介导的内部途径和死亡受体介导的外部途径[13]。实验证明线粒体介导的凋亡是细胞凋亡的主要途径,它的主要分子生物学基础是线粒体膜结构表面的通透性转运孔(mitochondria permeability transition pore,MPTP)的开放,MPTP持续性的非特异性开放会导致细胞发生致死性结果,如跨膜电位消失、基质的Ca2+外流、超氧离子的产生,并且会释放一些膜蛋白成分等[14]。研究表明,线粒体膜电位下降,可导致细胞内能量代谢障碍,发生脂质过氧化反应,造成线粒体损伤,促使细胞色素C等大量的相关凋亡分子从线粒体中释放,从而引发细胞执行凋亡程序[15]。细胞色素C释放刺激凋亡小体复合物形成,然后通过切割裂解导致Caspase-9的激活,接着导致效应凋亡蛋白酶Caspase-3的激活,从而执行靶细胞凋亡这一途径被称为线粒体依赖性凋亡途径。Zhang等[16]的研究表明MC-LR能诱导黑斑蛙肝细胞氧化应激,细胞色素c释放,Caspase-3及Caspase-9的表达量增加,MC-LR可通过线粒体凋亡途径诱导肝细胞凋亡;也有研究表明MC-LR在不同类型细胞中都能诱导细胞内细胞色素C的释放,以及激活Caspase-3,Caspase-9的反应,从而导致细胞的凋亡作用[17]。
本实验中,当16HBE细胞经MC-LR分别暴露24 h和48 h之后,细胞凋亡率和线粒体膜电位以及Caspase-3和Caspase-9相对表达水平检测结果显示,随着MC-LR染毒浓度的升高,线粒体膜电位呈下降趋势,Caspase-3和Caspase-9的相对表达量呈升高趋势,同时细胞凋亡率也呈现升高趋势,具有剂量依存关系;在相同浓度染毒组,48 h组和24 h组相比,线粒体膜电位呈下降趋势,Caspase-3和Caspase-9的相对表达量以及细胞凋亡率呈升高趋势。说明MC-LR暴露16HBE细胞可导致其线粒体膜电位丢失,造成线粒体功能损伤,促使凋亡相关蛋白Caspase-9的激活,接着激活凋亡执行因子Caspase-3,进而诱导16HBE细胞发生凋亡。说明线粒体参与了MC-LR诱导的16HBE细胞凋亡过程,并起着非常关键的作用,表明MC-LR可通过线粒体Caspase依赖性途径诱导16HBE细胞凋亡。
此外,本研究中利用Caspase广谱抑制剂Z-VAD-FMK提前处理30 min后,发现暴露于10 μg·mL-1MC-LR+50 μmol·L-1Z-VAD-FMK组细胞与10 μg·mL-1MC-LR单独作用组细胞相比,Caspase-3和Caspase-9相对表达量降低,细胞凋亡率明显降低。说明Caspase广谱抑制剂Z-VAD-FMK一定程度上阻止MC-LR诱导16HBE细胞发生凋亡,进一步证实MC-LR可通过线粒体Caspase依赖性途径诱导16HBE细胞凋亡。
致谢:感谢河南农业大学生命科学学院郭红祥老师在实验设计和英文写作上的帮助和支持。
[1] Welker M, von Dohren H. Cyanobacterial peptides-nature's own combinatorial biosynthesis [J]. FEMS Microbiology Reviews, 2006, 30(4): 530-563
[2] Sueoka E, Sueoka N, Okabe S, et al. Expression of the tumor necrosis factor alpha gene and early response genes by nodularin, a liver tumor promoter, in primary cultured rat hepatocytes [J]. Journal of Cancer Research and Clinical Oncology, 1997, 123(8): 413-419
[3] Sun Y, Meng G M, Guo Z L, et al. Regulation of heat shock protein 27 phosphorylation during microcystin-LR-induced cytoskeletal reorganization in a human liver cell line [J]. Toxicology Letters, 2011, 207(3): 270-277
[4] Zhang H Z, Zhang F Q, Li C F, et al. A cyanobacterial toxin, microcystin-LR, induces apoptosis of sertoli cells by changing the expression levels of apoptosis-related proteins [J]. The Tohoku Tournal of Experimental Medicine, 2011, 224(3): 235-242
[5] Turner P C, Gammie A J, Hollinrake K, et al. Pneumonia associated with contact with cyanobacteria [J]. British Medical Journal, 1990, 300(6737): 1440-1441
[6] Duy T N, Lam P K, Shaw G R, et al. Toxicology and risk assessment of freshwater cyanobacterial (blue-green algal) toxins in water [J]. Reviews of Environmental Contamination and Toxicology, 2000, 163: 113-185
[7] 唐宝莲, 蒋岚, 宋海燕. 蓝藻治理对策建议[J]. 江苏科技信息, 2008, (1): 27-29
[8] Naseem S M, Hines H B, Creasia D A. Effect of toxins on arachidonic acid metabolism in rat cultured pulmonary alveolar macrophages [J]. Biochemistry International, 1989. 19(3): 583-592
[9] Soares R M. Effects of microcystin-LR on mouse lungs [J]. Toxicon, 2007, 50(3): 330-338
[10] Giam M, Huang D C, Bouillet P. BH3-only proteins and their roles in programmed cell death [J]. Oncogene, 2008, 27(Suppl. 1): S128-136
[11] 戚胜波, 于奇. MMP-2、IL- 21 与非小细胞肺癌关系的研究[J]. 临床肺科杂志, 2014, 19(4): 734-737
[12] 孙政. 苯并(a)芘对人支气管上皮细胞BEAS-2B线粒体损伤的研究[D]. 昆明:昆明医科大学, 2012: 40-41
[13] Spencer S L, Sorger P K. Measuring and modeling apoptosis in single cells [J]. Cell, 2011, 144(6): 926-939
[14] Bernardi P, Krauskopf A, Basso E, et al. The mitochondrial permeability transition from in vitro artifact to disease target [J]. Febs Journal, 2006, 273(10): 2077-2099
[15] Hüttemann M, Lee I, Grossman L I, et al. Phosphorylation of mammalian cytochrome c and cytochrome c oxidase in the regulation of cell destiny: Respiration, apoptosis, and human disease [J]. Advances in Experimental Medicine and Biology, 2012, 748: 237-264
[16] Zhang H, Cai C, Fang W, et al. Oxidative damage and apoptosis induced by microcystin-LR in the liver of Rana nigromaculata in vivo [J]. Aquat Toxicol, 2013, (140-141): 11-18
[17] Meng G, Liu J, Lin S, et al. Microcystin-LR-Caused ROS generation involved in p38 activation and tau hyperphosphorylation in neuroendocrine (PC12) cells [J]. Environmental Toxicology, 2013, 29(5): 487-603
◆
Apoptosis Induced by Microcystin-LR in Human Bronchial Epithelial Cell through Mitochondrial Pathway
Xue Lijian1, Liu Xiaohui2, Yang Mingfeng1, Liu Ying1, Zhu Jing1, Qiao Dou1, Zhuang Donggang1, Cui Liuxin1, Zhang Huizhen1,*
1. College of Public Health, Zhengzhou University, Zhengzhou 450001, China 2. School of Basic Medicine, Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China
Received 14 May 2014 accepted 26 August 2014
To verify that mitochondrial Caspase-dependent pathway is involved in apoptosis in human bronchial epithelial cells induced by microcystin-LR (MC-LR), the logarithmic phase 16HBE cells were exposed to final concentrations of 0(control group), 2.5, 5, 10 μg·mL-1MC-LR, as well as 10 μg·mL-1MC-LR and 50 μmol·L-1Z-VAD-FMK (a broad-spectrum Caspase inhibitor) for 24 h or 48 h in vitro. The apoptosis rate, mitochondrial membrane potential (ΔΨm), and the expression of Caspase-3 and Caspase-9 were detected. Compared with the control group, the apoptosis rate, the expression levels of Caspase-3 and Caspase-9 increased significantly (P<0.05) in the treatment groups, and the ΔΨm decreased markedly (P<0.05) in the group treated with 10 μg·mL-1MC-LR. The apoptosis rate, the expression levels of Caspase-3 and Caspase-9 in the group treated with both 10 μg·mL-1MC-LR and 50 μmol·L-1Z-VAD-FMK were lower than that in the group treated only with the 10 μg·mL-1MC-LR. In addition, the apoptosis rates, the expression levels of Caspase-3 and Caspase-9 had a positive correlation with MC-LR concentrations and treatment time. These results suggested that MC-LR can induce 16HBE cells apoptosis through the mitochondrial Caspase-dependent pathway.
microcystin-LR; mitochondrial pathway; human bronchial epithelial cell; apoptosis
国家自然科学基金(81472948);河南省科技攻关计划(142102310344);河南省科技发展计划(132102310051);河南省科技重点攻关项目(122102310208);河南省高等学校青年骨干教师资助计划(2011GGJS-012)
薛利剑(1989-),男,硕士研究生,从事环境医学与毒理学研究。E-mail: 18339919221@163.com;
*通讯作者(Corresponding author), E-mail: huizhen18@126.com
10.7524/AJE.1673-5897-20140514001
2014-05-14 录用日期:2014-08-26
1673-5897(2015)3-123-06
X171.5
A
张慧珍(1972-),女,医学博士,教授,主要研究方向为环境医学与毒理学,发表学术论文60余篇。
薛利剑,刘晓蕙,杨明峰, 等. 微囊藻毒素-LR通过线粒体途径诱导人支气管上皮细胞凋亡[J]. 生态毒理学报,2015, 10(3): 123-128
Xue L J, Liu X H, Yang M F, et al. Apoptosis induced by microcystin-LR in human bronchial epithelial cell through mitochondrial pathway [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 123-128 (in Chinese)

