微粒皮复合人工真皮构建的组织工程皮肤用于大鼠巨大创面修复的研究
汤永喆 何奇 亓发芝
(1.上海交通大学医学院附属国际和平妇幼保健院乳腺外科,上海 200030;
2.复旦大学附属中山医院整形外科,上海 200032)
微粒皮复合人工真皮构建的组织工程皮肤用于大鼠巨大创面修复的研究
汤永喆1何奇1亓发芝2
(1.上海交通大学医学院附属国际和平妇幼保健院乳腺外科,上海200030;
2.复旦大学附属中山医院整形外科,上海200032)
摘要目的:评价微粒皮复合人工真皮构建的组织工程皮肤用于修复大鼠背部巨大创面的效果。方法: 选取32只8周龄SD大鼠,制备鼠背巨大创面模型,并随机分为空白对照组(A组)、人工真皮组(B组)、微粒皮组(C组)及组织工程皮肤组(D组)。B、C、D组大鼠分别以打孔拉网的人工真皮、自体原位微粒皮移植物、自体原位微粒皮复合人工真皮构建的组织工程皮肤移植物修复创面,A组创面仅覆盖油纱布。观察术后第1、3、5周时的创面愈合情况;通过CK15及CD29免疫组织化学染色法观察表皮干细胞(epidermal stem cells, ESCs)在创面愈合过程中的作用;对鼠背组织切片进行HE染色、Masson染色后镜下观察,并结合扫描电镜下观察,了解创面真皮层的愈合质量。结果:D组大鼠背部创面的修复效果最佳,术后第5周时创面已基本愈合。免疫组织化学染色结果显示,D组大鼠ESCs逐渐向表皮层迁移并参与创面的愈合;D组真皮层的厚度大于其余3组(P<0.01),D组真皮层胶原纤维排列致密整齐。结论:微粒皮复合人工真皮构建的组织工程皮肤用于创面修复的效果优于微粒皮及人工真皮。
关键词微粒皮;组织工程皮肤;修复
如何修复因手术切除体表良恶性肿瘤、体表皮肤撕脱、大面积的Ⅱ度及Ⅲ度烧伤或烫伤等所致的大面积皮肤缺损的创面,一直是外科修复研究的重要课题。微粒皮移植术所需设备简单、操作容易,故在临床广泛应用。但是,由于真皮基质的不足,微粒皮移植术后创面修复区域易出现色素沉着、破溃、瘢痕增生,甚至因表皮挛缩而出现关节活动受限、肢体功能障碍等现象。近年来发现,具有多向分化能力的皮肤干细胞能够通过定向诱导分化而形成毛囊、汗腺、皮脂腺等皮肤附属器细胞,具有广阔的应用前景[1]。本研究拟通过改良微粒皮移植的方法,以微粒皮基底层内的表皮干细胞(epidermal stem cells,ESCs)和毛囊隆突部位的毛囊干细胞(hair follicle stem cells,FSCs)作为自体种子细胞的来源,并以脱细胞人工真皮作为支架材料,复合构建一种组织工程皮肤,期盼即刻修复创面及提高创面修复的质量。
1资料与方法
1.1一般资料与及分组取8周龄SD大鼠32只(中国科学院上海分院实验动物中心提供),雌雄不拘,体质量200~250 g,单笼饲养,将其随机分为空白对照组(A组)、人工真皮组(B组)、微粒皮组(C组)及组织工程皮肤组(D组)。
1.2试剂与仪器小鼠抗大鼠CK15单克隆抗体(美国Santa Cruz公司);兔抗大鼠integrin beta-1(CD29)单克隆抗体(美国Epitomics公司);显微解剖器械、游标卡尺(中国上海精密仪器仪表厂);Atrauman油纱布(德国Hartmann公司);S-520型扫描电镜(日本Hitachi公司);光学显微镜(日本Olympus公司);HCP-2型临界点干燥仪(日本Hitachi公司);IB-3型离子溅射仪(日本EIKO公司)。
1.3实验方法
1.3.1皮肤巨大创面模型的建立SD大鼠背部备皮后,于鼠背部正中制备直径约30 mm的圆形全层创面,深至肉膜层,创面内放置限制框,以限制皮肤收缩。
1.3.2自体原位微粒皮的制备采用称质量法称取制备创面时切取的鼠背皮肤的1/10,将其反削成0.4 mm中厚皮,以锋利小剪刀反复修剪,使最终微粒皮成品的最大颗粒小于1 mm×1 mm,备用。
1.3.3修复材料覆盖创面A组大鼠的创面仅覆盖与创面等大的油纱布;B组大鼠的创面覆盖打孔拉网的人工真皮后,外覆与创面等大的油纱布;C组大鼠的创面均匀涂抹自体原位微粒皮移植物后,外覆与创面等大的油纱布;D组大鼠的创面覆盖自体原位微粒皮复合人工真皮构建的组织工程皮肤移植物后,外覆与创面等大的油纱布。各组创面覆盖内层移植物后均以6-0尼龙线打包缝合、加压固定。
1.3.4修复效果观察术后第1、3、5周时观察创面愈合情况,测量创面愈合面积,并计算创面愈合率。创面愈合率(%)=创面愈合面积/创面总面积×100%。术后第1、3、5周时分别取全层创面及相邻创缘的部分正常皮肤1块。将所取组织以10%甲醛溶液固定24 h,然后用石蜡包埋后切片;对切片行CK15及CD29免疫组织化学染色,观察ESCs在创面愈合过程中的作用;行HE染色及Masson染色,观察创面真皮层胶原纤维的密度、排列及结构。术后第5周时,各组随机取1只SD大鼠,于鼠背部创面正中定位,自长轴最远端向创面中心方向切取包含创缘正常皮肤的创面全层约2 mm×5 mm的长方体组织块,制作扫描电镜样本,通过扫描电镜了解各组创面真皮层厚度及修复效果。
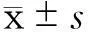
2结果
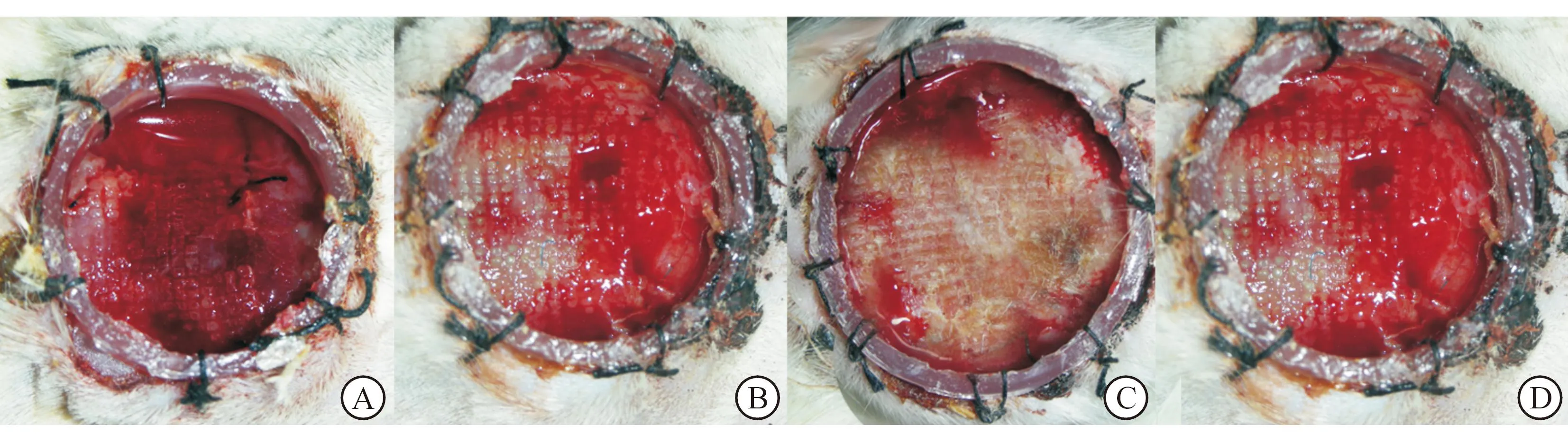
2.1各组大鼠术后创面的大体观察结果术后第1周时,A、B两组创面裸露,仅可见新鲜肉芽组织生长;C组创面微粒皮连接成片,已覆盖大部分创面;D组创面有上皮岛形成,周围有新鲜肉芽组织生长;见图1。术后第3周时,各组大鼠的限制框逐渐脱落,创面均明显收缩,A组创面收缩最明显;B组创面收缩受到人工真皮移植物的限制,未见有明显的表皮覆盖;C组创面可见菲薄的新生皮肤覆盖;D组创面新生皮肤与正常皮肤相连接。术后第5周时,B组创面明显收缩,呈直线形,其余3组创面大小无明显变化;C组创面的外观更接近正常皮肤的质地,但愈合创面未见毛发生长;D组新生皮肤覆盖面积更大,可见陈旧血痂边缘剥离,痂下可见新生皮肤覆盖创面;见图2。
A:空白对照组(A组);B:人工真皮组(B组);C:微粒皮组(C组);D:组织工程皮肤组(D组)
A:空白对照组(A组);B:人工真皮组(B组);C:微粒皮组(C组);D:组织工程皮肤组(D组)
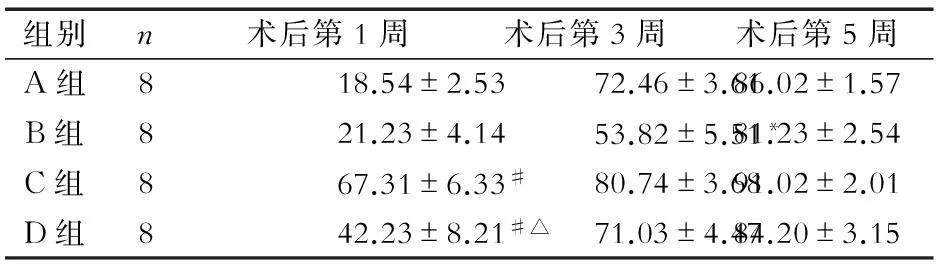
组别n术后第1周术后第3周术后第5周A组818.54±2.5372.46±3.6186.02±1.57B组821.23±4.1453.82±5.51*81.23±2.54C组867.31±6.33#80.74±3.6891.02±2.01D组842.23±8.21#△71.03±4.4784.20±3.15
注:与A、B组比较,#P<0.05;与C组比较,△P<0.05;与其他3组比较,*P<0.05
2.3ESCs的分布和迁移CK15及CD29免疫组织化学染色结果有一定的一致性。术后第1周时,各组创面的新生表皮中均可见CK15及CD29阳性的ESCs分布。CK15及CD29阳性细胞主要分布在棘层和颗粒层,并集中在部分区域呈高表达;同时,CD29阳性细胞在表皮基底层及新生腺体中也有一定的分布。C、D组中CK15及CD29阳性细胞在创面全层均匀分布,皮肤的毛囊处也可见CK15及CD29高表达。修复过程中,CK15及CD29阳性细胞逐渐向表层迁移,且它们在包括表皮及毛囊在内的创面全层的分布均有不同程度的减少。见图3。
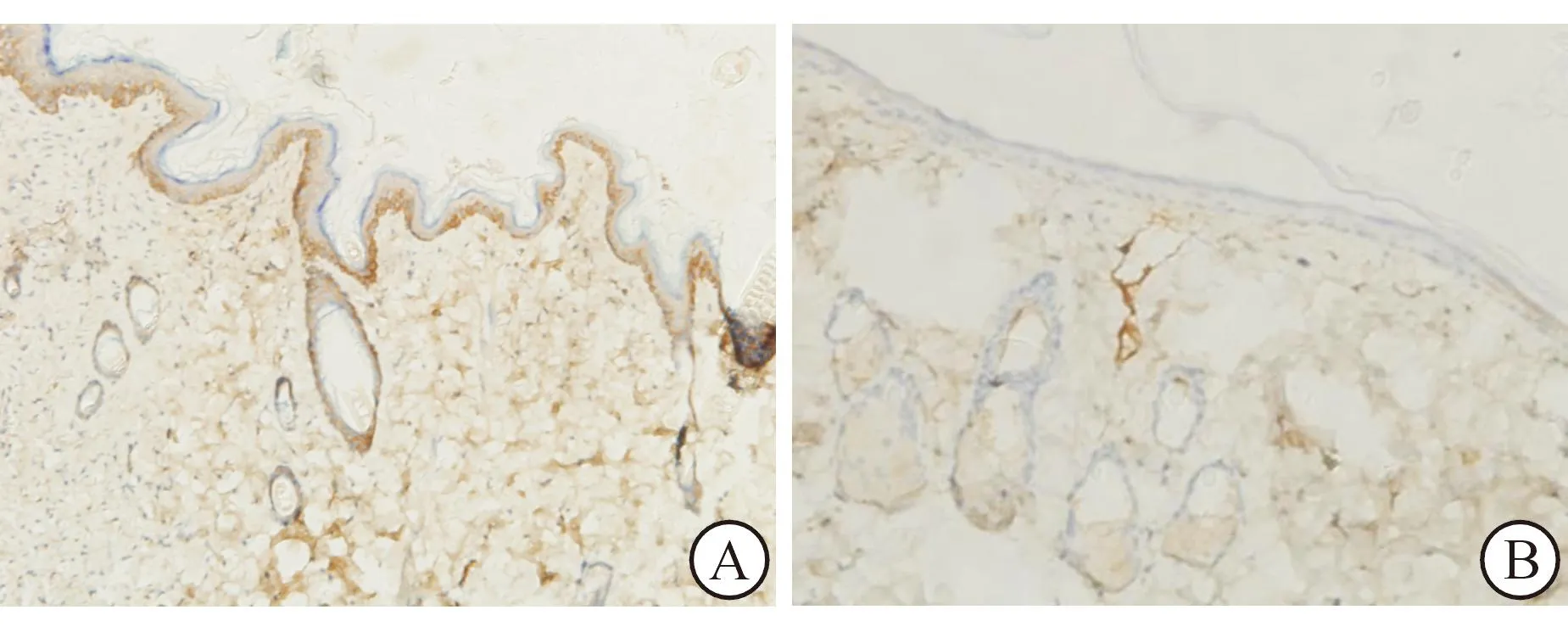
A:CK15阳性细胞在毛囊处高表达,且阳性细胞带与表皮基底相连续;B:毛囊向表皮聚集,参与创面修复,毛囊处的CD29阳性细胞带接续表皮基底,CD29在新生腺体结构中呈阳性表达
图3术后第3周时组织工程皮肤组(D组)
鼠背创面的免疫组织化学染色结果(×200)
2.4真皮层修复效果的评价HE染色结果显示,术后第1周时,4组创面的真皮层中即有淋巴细胞及中性粒细胞的全层浸润,并有散在分布的小血管;淋巴细胞及中性粒细胞的浸润在术后第3周及第5周逐渐减少;小血管的分布密度在术后第3周时增高,而在术后第5周时下降。C、D组在术后第3周时已可见完整连续的表皮基底膜。Masson染色结果显示,4组真皮中均可见表皮下方胶原重构;B、D组中,自体新生的胶原在愈合过程中逐渐取代人工真皮支架结构,且其排列从松散凌乱趋于整齐;C、D组中的成纤维细胞分布较A、B组更为密集。见图4。
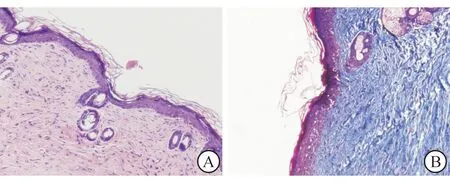
A:微粒皮结构和毛囊结构明显向表皮迁移,并与表皮融合;B:人工真皮结构基本已被自体新生胶原所替代,真皮层成纤维细胞分布密集,胶原排列整齐
图4术后第5周时组织工程皮肤组(D组)鼠背创面
HE染色(A)和Masson染色(B)结果(×200)
术后第5周时,取各组鼠背创面的组织切片,在扫描电镜下随机测量3处真皮层的厚度并计算平均值,A、B、C、D组真皮层厚度分别为(235.53±14.34)μm、(518.79±29.86)μm、(123.35±8.41)μm、(768.15±24.22)μm,D组真皮层厚度大于其余3组,B组真皮层厚度大于A、C组,差异均有统计学意义(P<0.01)。
扫描电镜下观察发现,各组创面真皮层中均未见典型的乳头层和网状层结构及层次形成。C组的真皮层内有较多的胶原沉积,胶原纤维结构粗糙,表现为疏松而粗大的网状层结构,胶原束间呈现纤维交叉联系;B、D组的人工真皮支架结构中可见排列整齐的胶原纤维及血管长入,形成一层致密的真皮样结缔组织;B组创面表皮结构基本形成,但其下缺乏基底膜及乳头层结构支持,故有所脱落;D组真皮层结构致密,与其上层表皮衔接稳定。见图5。
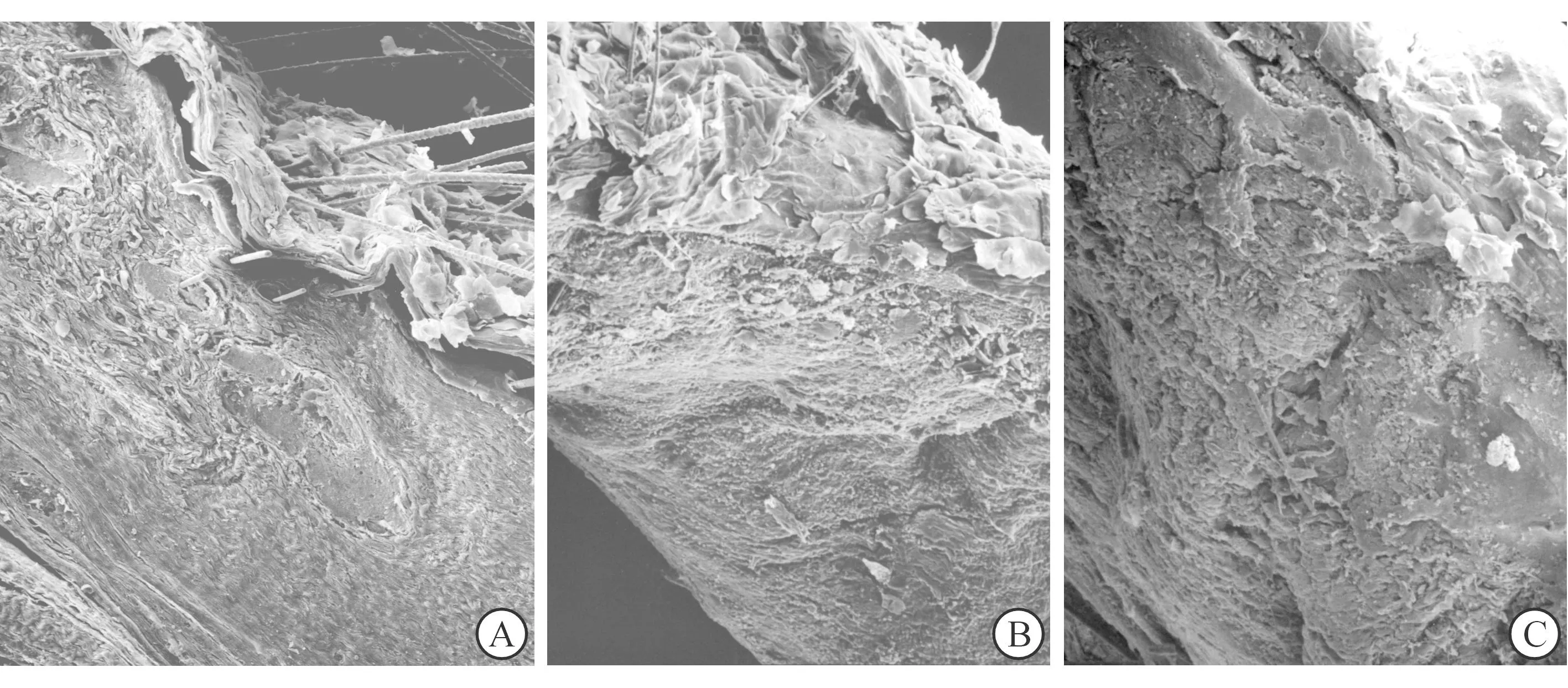
A:人工真皮组(B组)创面表皮结构基本形成,但其下缺乏基底膜及乳头层结构支持;B:微粒皮组(C组)真皮层内有较多的胶原沉积,胶原纤维结构粗糙,表现为疏松而粗大的网状层结构,胶原束间呈现纤维交叉联系;C:组织工程皮肤组(D组)表皮覆盖完整,与其下真皮层衔接稳定,真皮层重建为较为成熟的层次和结构
图53组术后第5周时创面真皮层的扫描电镜照片(×50)
3讨论
组织工程皮肤对于改善创面愈合环境、提高创面修复质量,作用非常明显。本研究用于修复创面的微粒皮除含有表皮、真皮等基本结构外,还含有血管、毛囊等皮肤附属器结构。这些皮肤附属器结构可提供多种作为种子细胞的皮肤干细胞,包括基底层内的ESCs和毛囊隆突部位的FSCs,故微粒皮的移植是一种复合移植。创面修复过程中,ESCs被诱导后可向表皮细胞分化;毛囊隆突部位的表皮生长因子受体(epidermal growth factor receptor, EGFR)表达升高,表皮生长因子诱导FSCs向上迁移,参与表皮的形成,并阻止FSCs向毛发分化[2]。
啮齿类动物的皮肤在创面修复的过程中表现出强烈的收缩特性。本实验初期,为了减少创面收缩对实验的干扰,在大鼠背部创面内放置限制框并严格打包,起到了良好的限制作用。然而,实验后期在限制框脱落后,可观察到4组大鼠的创面明显收缩。B组中,人工真皮移植物的物理结构起到了限制创面收缩的作用,但同时也影响了创面的愈合速度;D组中,组织工程皮肤移植物对创面的覆盖弥补了创面愈合速度的缺陷,并限制了创面收缩,保证了创面的愈合质量。
本研究采用CK15和CD29对皮肤干细胞进行双重标记,以了解皮肤干细胞在表皮愈合中的作用。CK15(cytokeratin 15)是一种角蛋白,是构成表皮细胞骨架结构的主要成分。毛囊隆突部的FSCs表达CK15,且CK15的表达量会在干细胞的分化过程中率先减少,提示CK15可能对于ESCs的鉴别有一定意义[3]。Piwko-Czuchra等[4]研究发现CD29高表达的细胞贴壁速度快,增殖能力强,对基底膜的形成颇为重要。本研究中免疫组织化学染色结果显示,CK15阳性细胞和CD29阳性细胞的分布具有一致性;CK15阳性细胞及CD29阳性细胞在皮肤创伤初期主要分布在表皮的棘层和颗粒层(CD29在表皮基底也呈阳性高表达),CK15和CD29在创面中的毛囊分布区也有高表达。制备微粒皮的过程中,机械切割使ESCs在全层均匀地散在分布。在创面愈合过程中,CK15阳性细胞及CD29阳性细胞呈现出逐渐向表皮迁移的趋势,可以观察到毛囊的阳性细胞带在修复过程中与表皮基底衔接融合。术后第5周时,CK15阳性细胞及CD29阳性细胞在创面全层、表皮及毛囊等的分布均有不同程度减少。以上提示,初期创面可能缺乏足够的表皮生长因子等细胞因子,后期创缘反应性分泌的细胞因子启动了创面修复,促进了ESCs与FSCs的分化,使得各组创面的阳性细胞均有消耗减少;而D组在创面修复过程中,细胞因子不仅来源于创缘的反应性分泌,同时来源于人工支架内长入的成纤维细胞,诱导ESCs向表皮分化,保证创面的表皮覆盖。
皮肤创面修复时,创面真皮层的厚度和胶原排列情况反映了真皮层的愈合质量;创面真皮层,有一定的厚度,有利于减少创面收缩,胶原纤维的整齐排列则有利于提高皮肤的耐磨程度,血管的形成和淋巴细胞的浸润则有助于改善创面微环境[5]。HE染色显示,大鼠背部创面的愈合过程中,成纤维细胞和微血管不断迁入人工真皮支架的空间结构内。扫描电镜下观察及Masson染色结果则提示,人工真皮支架为新生胶原的排列提供了空间,随着支架结构内胶原纤维新生重塑,支架结构逐渐降解,在人工真皮残存结构内可观察到平行排列、致密有序的胶原束形成,这些胶原束最终与微粒皮完全融合而修复创面,保证了真皮层的厚度。本研究中,在第5周时,D组大鼠的创面真皮层厚度达(768.15±24.22)μm;创面真皮层上方为微粒皮胶原直接覆盖,表现为排列紊乱的粗大波形的胶原结构,胶原间的空隙较大;创面真皮层下方为长入人工真皮支架结构中平行排列的胶原束及部分残存支架结构,胶原纤维之间空隙较小,致密有序,两层之间有过渡。创面的微观结构体现了组织工程皮肤组的真皮层修复效果具有明显的优势。
综上所述,微粒皮复合人工真皮构建的组织工程皮肤用于大鼠背部巨大创面的修复,愈合质量较好。鉴于大鼠与人类皮肤的收缩特性差异较大,微粒皮复合人工真皮构建的组织工程皮肤能否在临床应用中达到与动物实验相近的效果,尚待深入探讨。
参考文献
[1]Chen M,Przyborowski M,Berthiaume F.Stem cells for skin tissue engineering and wound healing[J].Crit Rev Biomed Eng,2009,37(4-5):399-421.
[2]Plikus MV,Gay DL,Treffeisen E,et al.Epithelial stem cells and implications for wound repair [J].Semin Cell Dev Biol,2012,23(9):946-953.
[3]Bose A,Teh MT,Mackenzie IC,et al.Keratin k15 as a biomarker of epidermal stem cells[J].Int J Mol Sci,2013,14(10):19385-19398.
[4]Piwko-Czuchra A,Koegel H,Meyer H,et al.Beta1 integrin-mediated adhesion signalling is essential for epidermal progenitor cell expansion[J]PLoS One,2009,4(5):e5488.
[5]Wong AK,Schonmeyr B,Singh P,et al.Histologic analysis of angiogenesis and lymphangiogenesis in acellular human dermis[J].Plast Reconstr Surg,2008,121(4):1144-1152.
Tissue Engineering Skin Made of Microskin Combined with Artificial Dermis in the Application of Huge Wound Healing in Rats
TANGYongzhe1HEQi1QiFazhi2
1.DepartmentofBreastSurgery,InternationalPeaceMaternityandChildHealthHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200030,China;2.DepartmentofPlasticSurgery,ZhongshanHospital,FudanUniversity,Shanghai200032,China
AbstractObjective:To evaluate the effect of tissue engineering skin(TES), which was made of microskin combined with artificial dermis, in the healing of huge wound on the back of SD rats. Methods:The models of huge wound on the back were made from the selected 32 SD rats at 8 weeks old. They were randomly divided into blank control group (Group A), artificial dermis group (Group B), microskin group (Group C) and TES group (Group D). The wounds in Group B, Group C and Group D were healed by artificial dermis with punching net, in-situ microskin autografts, the TES made of autogenous in-situ microskin combined with artificial dermis, respectively. The wounds in Group A were covered with vaseline gauze. The situations of wound healing at the 1st, 3rd and 5th week after operation were observed.The effects of ESCs during the wound healing process were observed by the CK15 and CD29 immunohistochemical staining.The healing quality of dermis on wound was evaluated by HE staining and Masson staining of tissue biopsies of the back of rats and observation under scanning electronic microscopy. Results: The best healing effect was in Group D and the wounds were almost healed at the 5th week after grafting. The results of immunohistochemical staining showed that ESCs of rats in Group D had moved to the epidermal layer gradually and took part in the wound healing. The thickness of dermal layer in Group D was larger than that in the other 3 groups(P<0.01) and the collagen fibers in dermal layer were arranged compactly and neatly in Group D. Conclusions: The effect of the TES made of microskin combined with artificial dermis in the application of wound healing is superior to that of microskin and artificial dermis.
Key WordsMicroskin;Tissue engineering skin;Healing
中图分类号R 622
文献标识码A
通讯作者何奇,E-mail:drheqi@hotmail.com
基本项目:国家863课题资助项目(编号:2014AA020705)
·论著·

