禽流感病毒H9和N2亚型双重RT-PCR检测方法的建立
徐 倩,谢芝勋,谢丽基,邓显文,谢志勤,罗思思,黄 莉,黄娇玲,曾婷婷
(1.广西大学动物科技学院,广西南宁 530001;2.广西壮族自治区兽医研究所广西畜禽疫苗新技术重点实验室, 广西南宁 530001)
禽流感病毒H9和N2亚型双重RT-PCR检测方法的建立
徐 倩1,谢芝勋2*,谢丽基2,邓显文2,谢志勤2,罗思思2,黄 莉2,黄娇玲2,曾婷婷2
(1.广西大学动物科技学院,广西南宁 530001;2.广西壮族自治区兽医研究所广西畜禽疫苗新技术重点实验室, 广西南宁 530001)
为建立简便快速检测H9及N2亚型禽流感病毒(AIV)的方法,根据AIV H9亚型和N2亚型基因序列,分别设计了2对针对H9亚型AIV的HA基因和N2亚型AIV的NA基因的引物,建立了H9亚型和N2亚型AIV双重RT-PCR检测方法。对H9N2亚型AIV的RNA模板进行RT-PCR扩增,可得到545 bp H9基因特异性条带和341 bp N2基因的特异性条带;对非H9亚型的N2亚型AIV进行扩增,则仅出现1个特异性扩增条带,即341 bp N2基因条带;对非H9或N2亚型AIV和其他禽呼吸道病原体进行PCR扩增,结果均为阴性。结果表明该双重RT-PCR最低能检出100 fg H9N2亚型AIV的cDNA模板。
禽流感病毒;H9亚型;N2亚型;双重逆转录-聚合酶链反应
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科(Orthomyxoviridae)A型流感病毒属流感病毒,能够引起禽类的感染和疾病。目前按照A型流感病毒囊膜糖蛋白血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的差异,可将其分为18个HA亚型(H1~H18)和11个NA亚型(N1~N11)[1-3]。其中H9亚型禽流感虽然属于低致病性禽流感,但是该亚型流感病毒一直在我国的一些主要养禽地区传播和流行并形成地方流行性疫病[4-5]。1996年-2000年,我国H9N2亚型禽流感的发病率占总禽流感发病率的93.89%,成为影响我国养禽业的主要AIV亚型[6]。Peng Y等[7]在对我国广西地区开展的H9亚型AIV流行病学调查中发现H9亚型AIV在禽群中仍然广泛流行。不仅如此,H9亚型AIV还可以感染人、猪等哺乳动物,具有重要的公共卫生意义[8]。N2亚型是能导致禽类感染的常见AIV亚型,在中国主要是H9N2亚型。
目前,对于H9N2亚型AIV的检测,主要是病原学分离鉴定与血清学试验,但是这些方法存在耗时长和敏感性差等不足,并且不能同时检测出H9亚型及N2亚型AIV。双重及多重RT-PCR可同时检测不同病原体(或不同亚型病原体),在临床上具有较高的应用价值,并且由于其具有特异性好及敏感性高的优点而得到了广泛的应用[9-13]。本研究设计2对特异性引物,建立了H9亚型和N2亚型禽流感病毒的双重RT-PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF鸡胚为北京梅里亚公司产品。
1.1.2 主要仪器和试剂 NanoDrop 2000 超微量分光光度计为美国Thermo Scientific公司产品; Hema 9700梯度基因扩增仪为中国珠海黑马医学仪器有限公司产品;病毒DNA/RNA抽提试剂盒、2×EasyTaqPCR SuperMix为北京全式金生物技术有限公司产品;AMV反转录酶、dNTP、DNA Marker DL 1 000为TaKaRa公司产品。
1.1.3 病毒株 H1N1、H1N2、 H3N2、H3N6、H3N8、H4N2、H4N6、 H6N2、H6N6及H9N2亚型禽流感病毒株由广西畜禽疫苗新技术重点实验室分离鉴定,H5N2、H7N2亚型AIV RNA由美国宾夕法尼亚州立大学禽病诊断研究室惠赠,新城疫病毒(NDV) La Sota、传染性支气管炎病毒(IBV)M41、传染性喉气管炎病毒(ILTV)北京、鸡毒支原体(MG)S6及番鸭呼肠病毒(ARV)由广西畜禽疫苗新技术重点实验室保存提供。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中H9亚型AIV的HA基因和N2亚型AIV的NA基因的核苷酸序列,用DNA Star软件进行比对,以GenBank中1条鸡源H9N2亚型AIV-HA基因(登录号为JQ770141.1)和1条鸡源H9N2亚型AIV-NA基因(登录号为AF156398.1)为参考序列,用Primer 5.0生物软件设计针对H9亚型、N2亚型AIV的2对特异性引物,引物核酸序列见表1。引物由北京六合华大基因科技有限公司合成,储存液浓度为25 pmol/μL,置-30 ℃保存备用。

表1 H9、N2引物的核苷酸序列Table 1 Nucleotide sequences of H9 and N2 primers
1.2.2 病毒RNA/DNA抽提与RNA反转录 参照Viral DNA/RNA Kit使用说明书对所用的病毒RNA或DNA进行抽提,抽提后的RNA或DNA分别用33 μL、50 μL DEPC水溶解。向RNA抽提产物中加入1.5 μL 反转录引物,70 ℃ 10 min,冰浴5 min,加入反转录体系:10 μL 5×AMV buffer、4 μL dNTP、0.5 μL RNA酶抑制剂、1 μL AMV,瞬时离心,42 ℃ 90 min制备cDNA。所得到的DNA及cDNA置-30 ℃保存备用。
1.2.3 双重RT-PCR扩增条件的优化 通过对双重PCR 的引物浓度配比及反应参数(包括时间和温度)进行优化,筛选出双重RT-PCR最佳反应体系及反应条件。
1.2.4 双重RT-PCR的特异性试验 用已优化的双重PCR方法,分别对H9N2、H1N1、H1N2、 H3N2、H3N6、H3N8、H4N2、H4N6、H5N2、H6N2、H6N6、H7N2亚型AIV、NDV、IBV、ILTV、ARV及MG的核酸进行扩增,以检测建立的双重RT-PCR的特异性。同时,用已优化的双重PCR方法,分别对20株广西畜禽疫苗新技术重点实验室保存的,广西地区不同年份(近4年)不同宿主的H9N2亚型AIV进行扩增,评价所建立的双重RT-PCR方法的实用性。毒株背景如表2所示。
1.2.5 双重RT-PCR的敏感性试验 利用超微量分光光度计测定H9N2亚型AIV cDNA模板的浓度,并用超纯水将其倍比稀释成10和1 ng/μL、100、10和1 pg/μL、100、10和1 fg/μL。用本研究中上述最佳反应体系和反应条件进行扩增。
1.2.6 临床样品检测 应用所建立的双重RT-PCR方法,随机选择120份从广西南宁市活禽市场
采集的口腔和粪便拭子进行检测。同时将相同的120份临床样品,用传统鸡胚接种的方法进行病原分离,并与双重PCR检测的结果进行比较。对双重RT-PCR检测为阳性的样品,进行HA、NA基因全长扩增并克隆测序,验证双重RT-PCR所得结果。
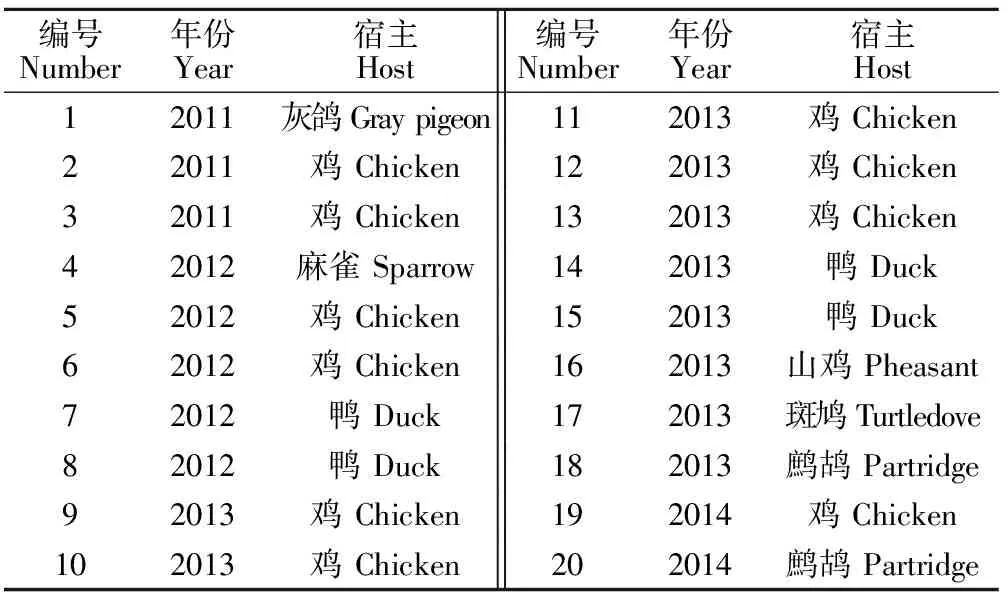
表2 20株H9N2亚型AIV毒株背景Table 2 Background of 20 strains of H9N2 subtype AIVs
2 结果
2.1 双重RT-PCR条件的优化
通过对H9和N2亚型AIV基因引物浓度的测定及双重PCR扩增的温度、时间等的优化,最后确定双重PCR最佳反应体系:2×EasyTaqPCR SuperMix 12.5 μL,H9N2亚型 AIV cDNA共1 μL作为模板,引物H9-F、H9-R(25 pmol/μL)各加入0.5 μL,N2-F、N2-R(25 pmol/μL)各0.3 μL,最后用三蒸水补充至25 μL。双重PCR的最佳反应条件为:94 ℃预变性 5 min;94 ℃ 40 s,57 ℃ 40 s,72 ℃ 50 s,35个循环;72 ℃10 min,4 ℃结束反应。
2.2 双重RT-PCR的特异性
所建立的双重RT-PCR方法,对H9N2亚型AIV 的扩增出现2条与试验设计大小相符的条带(545 bp和341 bp);对H1N2、H3N2、H4N2、H5N2、H6N2、H7N2亚型AIV的扩增出现了1个条带(314 bp),而对H1N1、H3N6、H3N8、H4N6、H6N6亚型AIV核酸和对NDV、IBV、ILTV、MG及ARV核酸的扩增未出现任何条带。扩增结果如图1所示。以上结果均与预期结果相一致,说明所建立的双重RT-PCR方法具有良好的特异性。对20株不同年份、不同宿主的H9N2亚型AIV进行扩增后,均出现2条与试验设计大小相符的条带,扩增结果如图2所示。
2.3 双重RT-PCR的敏感性
敏感性试验结果表明,该双重RT-PCR最低能检出100 fg H9N2亚型AIV cDNA模板。扩增结果如图3所示。
2.4 临床样品检测结果
120份从广西南宁市活禽市场采集的口腔和粪便拭子样品,经双重RT-PCR检测,有11份呈H9N2亚型AIV阳性,阳性率为9.17%;18份呈N2亚型(非H9亚型)AIV阳性,阳性率为15%,91份呈阴性。其中样品编号为1~20的样品电泳结果如图4所示,该结果与病毒分离鉴定结果相一致。测序结果表明,双重RT-PCR扩增的为H9 亚型AIV的HA基因和N2亚型AIV的NA基因。检测结果说明,所建立的双重RT-PCR方法具有较好的临床实用性。

图1 双重RT-PCR 的特异性Fig.1 Specificity results of duplex RT-PCR

图2 双重RT-PCR对20株H9N2亚型AIV毒株扩增结果Fig.2 The detection results of 20 strains of H9N2 AIVs by duplex RT-PCR

图3 双重RT-PCR 的敏感性Fig.3 Sensitivity results of duplex RT-PCR
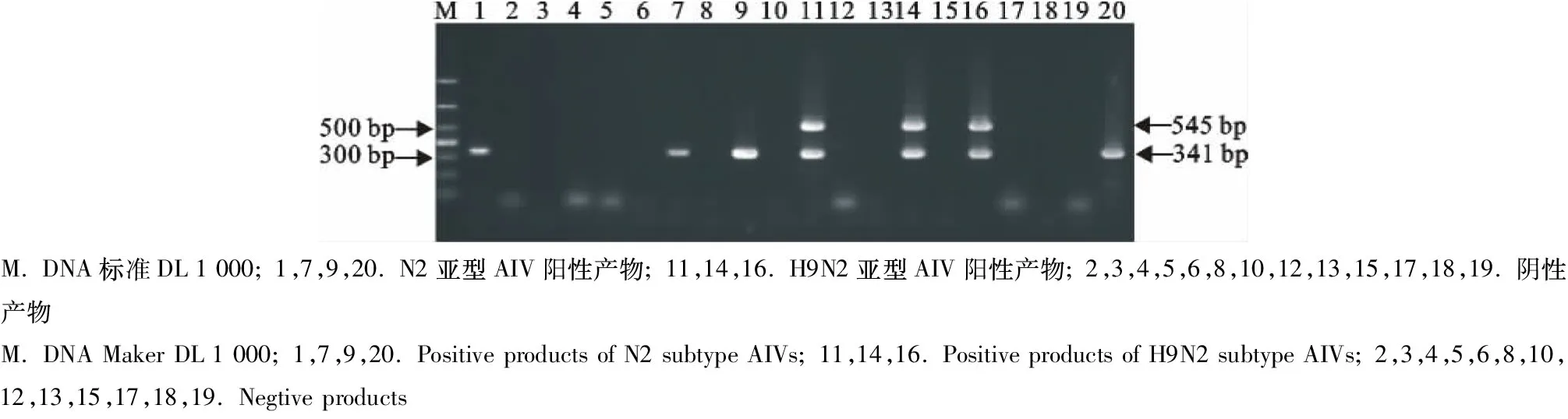
图4 双重RT-PCR临床样品检测结果Fig.4 The detection results of clinical samples by duplex RT-PCR
3 讨论
H9亚型禽流感病毒虽然为低致病性禽流感病毒,但是由于其自20世纪90年代出现了感染人的事例,并且一些病毒呈现出了人类流感病毒样受体特异性,引起了全世界的关注[14-16]。借助Influenza Virus Resource网站可以查询到GenBank中公布的中国地区H9亚型AIV序列中,除了个别为H9N1和H9N6亚型外,绝大均为H9N2亚型。值得注意的是,2013年流行的H7N9 AIV各基因节段中,除了HA和NA基因,其他重组来源均来自H9N2[17]。建立一种直观、简便的方法检测出H9N2亚型AIV是十分必要的。N2亚型是我国所流行的AIV中比较常见且比较重要的亚型,但以往的AIV的多重RT-PCR所建立的方法,多为针对HA基因,而对于NA基因的检测相对较少。因此,本研究分别针对H9亚型AIV的HA基因和N2亚型AIV的NA基因设计2对引物,同时扩增H9亚型和N2亚型AIV的目的片段,不仅可以直接检测出H9N2亚型AIV,还可以初步确定H9亚型AIV和N2亚型AIV,可为H9、N2亚型AIV提供准确快速的检测结果。
病原学分离鉴定与血清学试验方法操作相对繁琐,且各亚型之间容易相互影响[18],敏感性相对较低。本研究所建立的双重RT-PCR的方法,对于H9亚型AIV和N2亚型AIV的检测均可出现与试验设计大小相符的条带,而对于其他亚型AIV及其他禽呼吸道疾病病原的扩增结果均为阴性,表现出较好的特异性;通过敏感性试验,本方法最低能检出100 fg的H9N2亚型AIV模板,证明该方法的敏感性较高。临床样品检测结果及基因测序结果相比较,该方法表现了高度的准确性、简便性。值得注意的是,由于受到实验条件的限制,并不能用所建立的方法对所有HA亚型和NA亚型进行检测验证,因此尚需要对更多的临床样品进行检测,以评价其在实际应用中的检测效果。总之,本研究所建立的双重RT-PCR对于同时检测H9亚型和N2亚型AIV具有方便快捷、特异性良好、敏感性较高的特点,对H9、N2亚型AIV的监测和防控有重要意义。
[1] Munster V J, Fouchier R A. Avian influenza virus: of virus and bird ecology[J].Vaccine,2009,27(45):6340-6344.
[2] Li Q, Sun X, Li Z, et al. Structural and functional characterization of neuraminidase-like molecule N10 derived from bat influenza A virus[J].Proc Natl Acad Sci U S A,2012,109(46):18897-18902.
[3] Tong S, Zhu X, Li Y, et al. New world bats harbor diverse influenza a viruses[J/OL].PLoS Pathog,2013,9(10):e1003657.
[4] 李树纯, 李心海, 仲书官等. H9N2亚型禽流感病毒基因组的遗传进化分析[J].病毒学报,2012,28(1):7-13.
[5] Xie Z X, Dong J B, Tang X F, et al. Sequence and phylogenetic analysis of three isolates of avian influenza H9N2 from chickens in southern china[J].Scholarly Research Exchange, Volume 2008.1-7, Article ID 802317. doi:10.3814/2008/802317.
[6] Guo Y J, Krauss S, Senne D A, et al. Characterization of the pathogenicity of members of the newly established H9N2 influenza virus lineages in Asia[J].Virology,2000,267:279-288.
[7] Peng Y, Xie Z X, Liu J B, et al. Epidemiological surveillance of low pathogenic avian influenza virus (LPAIV) from poultry in guangxi province, southern china[J].PLoS One,2013,8(10):e77132doi:10.1371/journal.pone.0077132.
[8] Cong Y L, Pu J, Liu Q F, et al. Antigenic and genetic characterization of H9N2 swine influenza viruses in China[J].J Gen Virol,2007,88(Pt 7):2035-2041.
[9] 庞耀珊, 谢芝勋, Khan M I,等. 应用多重PCR检测人工感染及呼吸道疾病的研究[J].中国预防兽医学报,2001,11(6):415-418.
[10] 郭 捷, 谢芝勋, 彭 宜,等. 禽流感HI和H3二重PCR检测方法的建立[J].动物医学进展,2012,33(12):31-34.
[11] Xie Z X, Pang Y S, Liu J B, et al. A multiplex RT-PCR for detection of type A influenza virus and differentiation of avian H5, H7, and H9 hemagglutinin subtypes[J].Mol Cell Probes,2006,20(3-4):245-249.
[12] Xie Z X, Pang Y S, Deng X W, et al. A multiplex RT-PCR for simultaneous differentiation of three viral pathogens of penaeid shrimp[J].Dis Aquat Organ,2007,76:77-80.
[13] Xu X G, Chen G D, Huang Y, et al. Development of multiplex PCR for simultaneous detection of six swine DNA and RNA viruses[J].J Virol Meth,2012,183(1):69-74.
[14] Chu Y C, Cheung C L, Hung Leung C Y, et al. Continuing evolution of H9N2 influenza viruses endemic in poultry in southern China[J].Influenza Other Respi Viruses,2011,5(S1):68-71.
[15] Fusaro A, Monne I, Salviato A, et al. Phylogeography and evolutionary history of reassortant H9N2 viruses with potential human health implications[J].J Virol,2011,85:8413-8421.
[16] Xu C T, Fan W X, Wei R, et al. Isolation and identification of swine influenza recombinant A/Swine/Shandong/1/2003(H9N2) virus[J].Microbes Infect,2004,6:919-925.
[17] 张 宝,黄克勇,郭劲松,等. H7N9病毒的来源和重组模式[J].南方医科大学学报,2013,33(7):1017-1021.
[18] 郭 捷,谢芝勋,罗思思,等. H1亚型禽流感病毒实时荧光定量PCR检测方法的建立[J].动物医学进展,2013,34(7):29-34.
Development of Duplex RT-PCR Assay for Detection of AIV H9 and N2 Subtype
XU Qian1,XIE Zhi-xun2,XIE Li-ji2,DENG Xian-wen2,XIE Zhi-qin2,LUO Si-si2,HUANG Li2,HUANG Jiao-ling2,ZENG Ting-ting2
(1.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530004,China; 2.GuangxiVeterinaryResearchInstitute,GuangxiKeyLaboratoryofAnimalVaccinesandDiagnostics,Nanning,Guangxi,530001,China)
A duplex reverse transcription-polymerase chain reaction(duplex RT-PCR)was developed to detect H9 and N2 subtype avian influenza viruses(AIVs)simultaneously. Two pairs of specific primers were designed according to the conserved regions on the sequences of H9 AIV-HA gene and N2 AIV-NA gene in GenBank. It was shown that all samples containing H9N2 subtype AIV could be amplified into two specific bands, 545 bp for H9 subtype AIV and 341 bp for N2 subtype AIV by this duplex RT-PCR. All samples containing N2 subtype AIV with different HA genes (not H9) could be amplified into one specific band, 341 bp for N2 subtype AIV. No specific bands of the same sizes were amplified from other subtypes of AIVs and other avian pathogenic virus. As little as 100 fg of H9N2 subtype AIV could be detected by this duplex RT-PCR.
Avian influenza virus;H9 subtype;N2 subtype;duplex RT-PCR
2014-05-28
广西特聘专家专项项目(2011B020);广西自然科学基金项目(2013GXNSFDA019015);广西科技攻关重大专项项目(1222003-2-4);桂渔牧科项目(14-1)
徐 倩(1987-),女,河北石家庄人,硕士研究生,主要从事兽医生物技术学研究。*
S852.659.5;Q789
:A
:1007-5038(2015)01-0011-05

