经皮胆道金属支架置入姑息性治疗肝门部胆管癌
周 磊 刘会春 李宗狂 鲁贻民 金 浩
(蚌埠医学院第一附属医院肝胆外科,蚌埠 233004)
·临床研究·
经皮胆道金属支架置入姑息性治疗肝门部胆管癌
周 磊 刘会春*李宗狂 鲁贻民 金 浩
(蚌埠医学院第一附属医院肝胆外科,蚌埠 233004)
目的 探讨经皮经肝胆道引流(percutaneous transhepatic cholangial drainage,PTCD)途径胆道金属支架置入姑息性治疗失去手术切除机会的肝门部胆管癌(hilar cholangiocarcinoma,HCCA)的临床应用价值。 方法 2008年4月~2012年3月,对21例失去切除机会的HCCA,先在超声引导下行PTCD,1周后在DSA透视下行胆道金属支架置入,将PTCD的外引流转为胆道支架内引流。 结果 21例HCCA血清总胆红素(TBIL)从术前(290.29±155.98)μmol/L术后1周降至(103.01±53.83)μmol/L (t=7.00,P=0.00);血清直接胆红素(DBIL)从术前(199.46±128.73)μmol/L术后1周降至(45.71±25.99)μmol/L (t=6.19,P=0.00),丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GT)术后1周均明显下降(P<0.01),术后平均生存时间10.2月,95%置信区间7.74~12.69月。 结论 经PTCD途径胆道金属支架置入是姑息性治疗失去手术切除机会的HCCA的一种有效方法,具有简便、创伤小、安全、可重复等优点。
肝门部胆管癌; 超声; 胆道支架; 并发症; 姑息性
肝门部胆管癌(hilar cholangiocarcinoma,HCCA)是指发生于胆囊管开口以上的肝总管和左右肝管的黏膜上皮癌[1~5],根治性手术切除是治愈该病的唯一方法[6,7]。然而,由于HCCA发生部位特殊、肿瘤局部浸润性生长,加之与肝门部重要血管的关系密切,故其手术切除率低,术后死亡率高[8,9]。HCCA患者胆汁排出受阻,进而引起胆汁在体内淤积,造成全身多器官损害,这是造成晚期HCCA死亡的主要原因,因此,对不能手术切除的HCCA患者采取及时有效的减黄治疗具有十分重要的意义[6,8,10,11]。本文回顾性分析我科2008年4月~2012年3月21例采用经皮胆道金属支架置入术姑息性治疗失去手术切除机会的HCCA患者的临床资料,初步探讨其在肝门部胆管癌的临床应用价值。
1 临床资料与方法
1.1 一般资料
本组21例,男14例,女7例。年龄40~79岁,(64.3±11.2)岁。均因无痛性进行性黄疸为首发症状,通过上腹部CT平扫及增强、MRI及MRCP证实为失去手术切除时机的晚期肝门部胆管癌。按Bismuth分型标准:Ⅲa型6例,Ⅲb型5例,Ⅳ型10例(其中3例行肝门部胆管癌根治手术,术后10、14及15个月复发)。术前血清总胆红素(TBIL)(292.29±155.98)μmol/L,直接胆红素(DBIL)(199.46±128.73)μmol/L,丙氨酸氨基转移酶(ALT)(205.81±130.66)U/L,天冬氨酸氨基转移酶(AST)(179.19±122.31)U/L,γ-谷氨酰转肽酶(γ-GT)(753.29±617.07)U/L。
1.2 手术方法
行经皮经肝胆道引流(percutaneous transhepatic cholangial drainage,PTCD)途径胆道金属支架置入术。PTCD采用广州凌捷医疗器械有限公司生产的亲水性涂层猪尾巴导管;金属胆道支架为南京微创医学科技有限公司生产的自膨式记忆合金支架[国食药监械(准)字2012第3460992号];超声仪为日立2000型配合常规腹部探头,频率为3.5 MHz;数字减影血管造影系统(DSA)放射机为美国GE公司的Innova3100。
1.2.1 超声引导下PTCD 穿刺靶点和穿刺管型号的选择根据超声检查及肝内胆管扩张的具体情况决定,常用穿刺点有第7或第8肋间隙与右腋前线交界处和剑突下。穿刺点由超声定位,2%利多卡因局部浸润麻醉,用18G穿刺针进行穿刺,到达靶点后退出针芯,再置入导丝至肝门部,扩皮刀扩皮,沿导丝置入7F~8.5F亲水性涂层猪尾巴导管,拔去导丝,引流管接引流袋后缝固于皮肤表面。
1.2.2 胆道金属支架置入 PTCD后1周左右在DSA透视下行胆道金属支架置入。平卧位,经PTCD引流管用20%泛影葡胺造影,显示胆道梗阻部位,经PTCD管送入导丝至肝内胆管,拔出PTCD管,反复调整导丝方向,使导丝越过梗阻部位。沿导丝置入外鞘管至梗阻部位远端,再次注入20%泛影葡胺,DSA透视下测量梗阻胆管长度和梗阻近端胆管直径,根据梗阻胆管长度和梗阻近端胆管直径选择支架规格。拔出外鞘管,沿导丝置入胆道金属支架推送器,DSA透视下调整支架位置,使支架两端Mark越过梗阻两端各1 cm,缓慢推放支架(若单个支架长度不够,可置入双支架)。拔出导丝,沿原PTCD窦道插入PTCD管后注入20%泛影葡胺行胆道造影,造影剂顺利进入梗阻远端胆道表明支架推放成功。重新放置PTCD管。术后2、12 h抽血查血清淀粉酶,并于术后1周复查生化常规及血常规。术后常规予以抗感染、保肝及营养支持等治疗。支架置入后1周间断夹闭PTCD管,1周后经PTCD管造影提示支架完全膨胀且无移位后拔除PTCD管,出院。
1.3 观察和随访
比较治疗前及支架置入后1周的胆红素及转氨酶变化情况,采用门诊、电话等方式随访,记录胆道支架通畅时间(黄疸复发伴发热视为支架阻塞)和生存时间。随访至死亡或失访。
1.4 统计学处理
2 结果
2.1 临床疗效
21例住院时间12~29 d,(20.4±4.2)d。所有患者术后第1天起黄疸逐渐消退,皮肤瘙痒于1周后消失。术后1周ALT、AST、γ-GT、TBIL、DBIL明显下降(表1)。
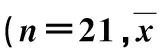
表1 肝门部胆管癌经PTCD途径胆道金属支架置入术前后肝功能变化±s)
2.2 术后并发症及处理
并发症发生率38.1%(8/21),其中5例支架置入后血淀粉酶升高(其中1例合并低钾、低钠),经4~7天应用生长抑素及纠正电解质紊乱后治愈;2例PTCD后出现低钾、低钠,经2~7天纠正;1例PTCD后胆漏,经腹腔穿刺置管引流7天治愈。
2.3 支架通畅性
15例金属支架置入术后出现支架阻塞,再梗阻时间(9.3±5.4)月,中位数8个月。
2.4 生存分析
到随访结束20例死亡,仅1例生存,平均生存时间10.2月,95%置信区间7.74~12.69月;中位生存时间9.0月,95%置信区间7.65~10.35月。生存曲线见图1。

图1 21例肝门部胆管癌患者经PTCD途径胆道金属支架置入姑息性治疗的生存曲线
3 讨论
HCCA是发生于胆囊管开口以上的肝总管和左右肝管的恶性肿瘤。由于该起病较隐匿,多数患者诊断明确后已失去手术切除机会,即使行根治性切除,其5年生存率也仅为20%~35%[6,12,13]。因此,对失去手术切除时机的HCCA患者,及时有效的减黄治疗具有十分重要的意义。从理论上讲,对HCCA患者进行合理有效的胆道引流不仅可快速减轻黄疸症状,而且可改善黄疸所致的多器官的损害,进而延长生存时间。文献报道[14~16]对恶性梗阻性黄疸患者姑息性引流术后的平均生存期为6~9个月。
临床上常用的解除HCCA胆道梗阻的方法有手术切除+胆道重建和PTCD或ERCP联合胆道支架置入[17]。HCCA的根治性手术及手术切除率均比较低,仅为30%左右[9,18]。随着影像技术的快速发展,尤其是增强CT和MRI技术的发展,绝大多数HCCA术前可充分评估,判断手术切除的可能性,因此开腹手术探查的时代已结束[19];随着超声技术与放射治疗技术的快速结合,对于失去手术切除机会的HCCA,经PTCD途径胆道金属支架置入具有简便、创伤小、安全、可重复等优点,可延长生存时间,改善生活质量,逐渐成为不能手术切除的恶性梗阻性黄疸患者的首选治疗措施[20]。本组21例在置入支架后减黄效果明显,肝功能、全身状况及患者生活质量都得到明显改善,平均生存期达到10.2月。
胆道支架技术失败的主要原因是胆道再梗阻,其常见原因有肿瘤浸润生长致再梗阻、支架移位、胆管瘢痕形成和胆汁淤积[21]。为了延长HCCA的生存时间、改善患者的生活质量,我们认为即便胆道支架置入后胆道再梗阻,也应积极给予再次甚至三次胆道支架置入。
经PTCD途径胆道金属支架置入在姑息性治疗HCCA时仅能解除胆道梗阻,而对肿瘤本身无任何治疗作用,随着肿瘤的进展,胆道很容易再次梗阻。Chen等[22]报道在治疗恶性梗阻性黄疸患者置入胆道支架的同时置入125I进行持续腔内照射,其支架的通畅时间显著延长。本组15例因支架阻塞,导致胆道再梗阻,多器官功能衰竭而死亡。另外本组1例支架置入3个月支架通畅性尚可,因对肿瘤的恐惧自杀死亡。因此,为延长HCCA患者的生存时间、改善患者的生活质量,我们主张对条件允许的患者辅以放化疗、免疫治疗、生物疗法及必要的针对性的心理辅导。在治疗HCCA时,经PTCD途径胆道金属支架置入与其他技术的联合仍值得进一步研究。
综上所述,对于失去手术切除机会的HCCA患者,施行以经PTCD途径胆道金属支架置入为主的综合治疗,具有简便、创伤小、安全、可重复等优点。
1 Kang MJ,Jang JY,Kwon W,et al.Does preoperative portal vein embolization have any impact on the outcome of right-side hepatectomy for Klatskin tumor?J Gastrointest Surg,2013,17(9):1592-1599.
2 Robles R,Sánchez-Bueno F,Ramírez P,et al.Liver transplantation for hilar cholangiocarcinoma.World J Gastroenterol,2013,19(48):9209-9215.
3 Suarez-Munoz MA,Fernandez-Aguilar JL,Sanchez-Perez B,et al.Risk factors and classifications of hilar cholangiocarcinoma.World J Gastrointest Oncol,2013,5(7):132-138.
4 Ratti F,Cipriani F,Ferla F,et al.Hilar cholangiocarcinoma: preoperative liver optimization with multidisciplinary approach.Toward a better outcome.World J Surg,2013,37(6):1388-1396.
6 Ito F,Cho CS,Rikkers LF,et al.Hilar cholangiocarcinoma: current management.Ann Surg,2009,250(2):210-218.
7 Bělina F.Hilar cholangiocarcinoma (Klatskin tumor)-current treatment options.Rozhl Chir,2013,92(1):4-15.
8 Kaiser GM,Paul A,Sgourakis G,et al.Novel prognostic scoring system after surgery for Klatskin tumor.Am Surg,2013,79(1):90-95.
9 van Gulik TM,Ruys AT,Busch OR,et al.Extent of liver resection for hilar cholangiocarcinoma (Klatskin tumor): how much is enough?Dig Surg,2011,28(2):141-147.
10 van Gulik TM,Kloek JJ,Ruys AT,et al.Multidisciplinary management of hilar cholangiocarcinoma (Klatskin tumor):extended resection is associated with improved survival.Eur J Surg Oncol,2011,37(1):65-71.
11 Pisello F,Geraci G,Modica G,et al.Cholangitis prevention in endoscopic Klatskin tumor palliation:air cholangiography technique.Langenbecks Arch Surg,2009,394(6):1109-1114.
12 Dinant S,Gerhards MF,Rauws EA,et al.Improved outcome of resection of hilar cholangiocarcinoma (Klatskin tumor).Ann Surg Oncol,2006,13(6):872-880.
13 Jarnagin WR,Fong Y,DeMatteo RP,et al.Staging, resectability, and outcome in 225 patients with hilar cholangiocarcinoma.Ann Surg,2001,234(4):507-517.
14 Choi JM,Kim JH,Kim SS,et al.A comparative study on the efficacy of covered metal stent and plastic stent in unresectable malignant biliary obstruction.Clin Endosc,2012,45(1):78-83.
15 Maluf-Filho F,Retes FA,Neves CZ,et al.Transduodenal endosonography-guided biliary drainage and duodenal stenting for palliation of malignant obstructive jaundice and duodenal obstruction. JOP,2012,13(2):210-214.
16 姜中华,管 敬,范志宁,等.经皮肝穿刺置入胆管支架对胃癌术后复发致胆管梗阻的治疗价值.中国微创外科杂志,2015,15(5):410-413.
17 周 磊,刘会春,李宗狂,等.改良经皮经肝胆汁引流术在治疗116例恶性梗阻性黄疸种的应用.蚌埠医学院学报,2009,34(12):1075-1077
18 Ruys AT,van Haelst S,Busch OR,et al.Long-term survival in hilar cholangiocarcinoma also possible in unresectable patients.World J Surg,2012,36(9):2179-2186.
19 Liang C,Mao H,Wang Q,et al.Diagnostic performance of magnetic resonance cholangiopancreatography in malignant obstructive jaundice.Cell Biochem Biophys,2011,61(2):383-388.
20 范恒伟,刘会春,崔培元,等.经皮经胆道支架置入与姑息性胆肠内引流对胰头癌所致梗阻性黄疸的疗效比较.中华肝胆外科杂志,2014,20(2):92-96.
21 Sakai Y,Tsuyuguchi T,Ishihara T,et al.Cholangiopancreatography troubleshooting: the usefulness of endoscopic retrieval of migrated biliary and pancreatic stents.Hepatobiliary Pancreat Dis Int,2009,8(6):632-637.
22 Chen Y,Wang XL,Yan ZP,et al.The use of 125I seed strands for intraluminal brachytherapy of malignant obstructive jaundice.Cancer Biother Radiopharm,2012,27(5):317-323.
(修回日期:2015-08-03)
(责任编辑:王惠群)
Percutaneous Biliary Metal Stent Implantation for Hilar Cholangiocarcinoma
ZhouLei,LiuHuichun,LiZongkuang,etal.
DepartmentofHepatobiliarySurgery,FirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China
LiuHuichun,E-mail:doctorlhc2000@aliyun.com
Objective To discuss the clinical application value of biliary metal stent implantation by percutaneous transhepatic cholangial drainage (PTCD) to cure advanced hilar cholangiocarcinoma (HCCA). Methods Twenty-one cases of HCCA were treated from April 2008 to March 2012. All the cases were given PTCD under the guidance of ultrasonography, and then were placed a biliary metal stent under DSA after one week. The external drainage of PTCD was used as internal biliary drainage. Results The total bilirubin (TBIL) was decreased from (290.29 ± 155.98) μmol/L preoperatively to (103.01±53.83) μmol/L at 1 week after surgery (t=7.00,P=0.00). The direct bilirubin (DBIL) was decreased from (199.46±128.73) μmol/L preoperatively to (45.71±25.99) μmol/L at 1 week after surgery (t=6.19,P=0.00). The levels of ALT, AST, and γ-GT were all decreased significantly after surgery (P<0.01). The average survival time was 10.2 months after surgery (95%CI: 7.74-12.69 months). Conclusion The biliary metal stent implantation is an effective method for palliative treatment of advanced HCCA with advantages of simple performance, minimal invasion, safety, and repeatable manipulation.
Hilar cholangiocarcinoma; Ultrasound; Biliary stent; Complication; Palliative
R735.8
A
1009-6604(2015)11-0998-04
10.3969/j.issn.1009-6604.2015.11.011
2015-03-04)
*通讯作者,E-mail:doctorlhc2000@aliyun.com

