绿原酸调节肥胖大鼠胰岛素抵抗作用的研究*
杨 辉,周远大,何海霞
(重庆医科大学附属第一医院:1.药学部;2.临床药理研究室 400016)
胰岛素抵抗(IR)在2型糖尿病和心血管病的发病机制中起到重要作用,改善IR 是2型糖尿病患者治疗的一个主要目标[1]。肥胖和缺乏锻炼是IR 的主要原因,减体质量和生活方式改变是IR 治疗的基石和最有效的治疗方法[2]。现有的针对IR 的药物如二甲双胍、噻唑烷二酮类,并不能保持血糖在正常范围内且有显著的不良反应。从天然药物中寻找能改善IR 的药物,逐渐成为研究重点。新近研究发现,中药金银花在抗氧化、降脂降糖[3-5]方面有独到之处,而金银花中最重要的活性物质是3-O-咖啡酰奎尼酸,简称绿原酸(chlorogenieacids,CHA)。本实验拟采用饲喂高脂饲料的方法建立肥胖大鼠IR模型,从生理生化等多方面观察CHA 的作用,旨在为研究CHA 改善IR 作用及其机制提供实验依据。
1 材料与方法
1.1 实验动物 健康清洁级SD 大鼠,雄性,5~6周龄,体质量160~180g,购于重庆医科大学试验动物中心[动物生产许可证号:SCXF(渝)2007-0001]。大鼠由专人标准化饲养房饲养,室内温度保持25 ℃左右,湿度50%左右,明暗周期12h,自由饮水和进食(饲以普通饲料)。适应性喂养1周后进行分组饲养。
1.2 材料与试剂 大鼠基础饲料由重庆医科大学试验动物中心提供;高脂饲料由课题组自制:即在基础饲料中添加10%的蔗糖、2.5%的胆固醇、12%的熟猪油、1%的胆酸盐,总热量为3.867kcal/g,金银花提取物(含98.19% CHA)购自西安开来生物工程有限公司,批号K130224;吡格列酮购自北京太洋药业有限公司,批号120902。胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、游离脂肪酸(FFA)、肌糖原及肝糖原测定试剂盒均由南京建成生物工程研究所提供;胰岛素放射免疫试剂盒由北京北方生物技术研究所提供。
1.3 方法
1.3.1 营养型肥胖大鼠IR 模型的建立及实验分组 健康大鼠喂以高脂饲料。饲喂6周后,测定大鼠体质量、体长和口服糖耐量。以体质量超过正常组大鼠20%,Lee′s指数增加且口服糖耐量测试(OGTT)降低作为模型成功的标志[6],未达标大鼠弃用。以健康大鼠(喂以基础饲料)为空白组,造模成功的大鼠分为模型组、吡格列酮组、CHA 大剂量组、CHA 小剂量组,每组10只。每天上午,CHA 大、小剂量组分别灌服60mg/kg和30mg/kg CHA,吡格列酮组灌服吡格列酮4.5 mg/kg[7-8](CHA 和吡格列酮均以0.5%羧甲基纤维素钠溶液配置,现配现用),模型组和空白组灌服羧甲基纤维素钠溶液,各组动物给药容量均为0.5mL/100g。除空白组每天按常规给予基础饲料外,其余实验组给予高脂饲料。实验期间观察大鼠摄食量、饮水量、活动及死亡情况,每周称体质量,连续喂养4周。
1.3.2 Lee′s指数、OGTT 的测定 测定各组大鼠体质量和体长,计算Lee′s指数,Lee′s指数=体质量(g)×1/3×1 000/体长(cm)。OGTT 方法为大鼠禁食过夜,以葡萄糖水2g/kg灌胃,在0、30、60、120min分别测定血糖,计算血糖曲线下面积(AUC)[9]。
1.3.3 生化指标的测定 用水合氯醛麻醉大鼠,颈动脉插管取血,3 500r/min离心,分离血清,-20 ℃保存待测。用全自动生化分析仪测定大鼠血清中TC、TG、HDL-C、LDL-C 水平,用SOD 和MDA 测试盒测定肝脏组织中SOD 活力和MDA 水平,采用FFA 测试盒测定血清中FFA,大鼠肝糖原、肌糖原的测定用肌糖原及肝糖原测定试剂盒,血清胰岛素水平采用放射免疫方法测定。
1.3.4 脏器系数及体脂比的测定 采血结束后,大鼠断头处死后解剖,取肝脏、肾脏、胰腺和生殖器周围、肾周及肠系膜脂肪,用生理盐水漂净,用滤纸滤干后称质量,计算脏器系数及体脂比。
1.3.5 胰岛素敏感指数(HOMA-ISI)及胰岛抵抗指数(HOMA-IR)的测定 取分离后的血清,测空腹胰岛素(FINS),再结合空腹血糖值(FBG),计算HOMA-ISI=ln[1/(FBG×FINS)]及HOMA-IR=(FBG×FINS)/22.5[10]。
1.4 统计学处理 采用SPSS13.0软件进行数据处理,计量数据用±s表示,组间均数比较用单因素方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 CHA 对肥胖大鼠体质量及Lee′s指数的影响 由表1可知,造模成功后,模型组,CHA 大、小剂量组,吡格列酮组大鼠体质量组间差异无统计学意义(P>0.05),但显著高于空白组(P<0.01)。给予药物干预4 周后,CHA 大剂量组大鼠体质量增长幅度减缓,与模型组比较,差异有统计学意义(P<0.01)。而吡格列酮组大鼠体质量增长幅度与模型组比较,差异无统计学意义(P>0.05)。
2.2 CHA 对肥胖大鼠脏器系数及Lee′s指数的影响 由表2可知,与模型组比较,CHA 大剂量组的肝脏系数、肾脏系数和体脂比均有下降的趋势,尤其是肝脏系数和体脂比(P<0.01);而吡格列酮组大鼠的肝脏系数、肾脏系数和体脂比与模型组比较没有显著变化(P>0.05)。造模成功后,模型组,CHA 大、小剂量组,吡格列酮组大鼠的Lee′s指数显著高于空白组(P<0.01)。给予药物干预4 周后,CHA 大、小剂量组Lee′s指数显著下降,与模型组比较,差异有统计学意义(P<0.05、P<0.01)。而吡格列酮组大鼠Lee′s指数与模型组比较差异无统计学意义(P>0.05)。
2.3 CHA 对肥胖大鼠糖耐量的影响 第6周末,从表3中可知,与空白组比较,高脂饲料各组大鼠的1.0h血糖值显著增加(P<0.01),其余各时间点血糖差异无统计学意义(P>0.05);高脂饲料各组的AUC 显著增加(P<0.05),提示肥胖大鼠的糖耐量降低。第10周末(数据未列出),与空白组大鼠比较,模型组0.5、1.0和2.0h的血糖值显著增加(P<0.01),AUC显著增加(P<0.01);与模型组比较,CHA 大、小剂量和吡格列酮能够明显降低大鼠口服葡萄糖1.0、2.0h后的血糖水平和AUC(P<0.01)。表明CHA 和吡格列酮能显著改善糖耐量。
表1 CHA 对肥胖大鼠体质量的影响(±s,g)
a:P<0.05、b:P<0.01,与空白组比较;c:P<0.05、d:P<0.01,与模型组比较。
组别 6周 7周 8周 9周 10周空白组 292±52d 327±47d 369±50d 387±51d 405±38 d模型组 402±30b 451±43b 473±43b 491±51b 504±42b CHA大剂量组 400±35b 414±28bc 439±27bc 444±34bc 457±27bd CHA小剂量组 403±41b 432±32b 450±32b 468±42b 484±46b吡格列酮组 401±31b 449±37b 471±38b 485±22b 496±26 b
2.4 CHA 对肥胖大鼠肝糖原、肌糖原、血清胰岛素及抗氧化指标的影响 由表4可知,与空白组大鼠比较,模型组,CHA大、小剂量组,吡格列酮组肝糖原和肌糖原水平显著降低(P<0.01)。与模型组比较,吡格列酮组和CHA 大、小剂量组大鼠肝糖原和肌糖原水平均显著升高(P<0.01)。模型组大鼠血清胰岛素水平较正常组比较显著上升(P<0.01),出现高胰岛素血症,表明产生了IR。给予药物干预后,与模型组比较,CHA 大、小剂量组和吡格列酮组大鼠胰岛素水平显著下降(P<0.01)。表明CHA 和吡格列酮可改善肥胖大鼠的高胰岛素血症。由表4可知,与空白组比较,模型组大鼠肝脏SOD 水平下降,MDA 水平增加;与模型组比较,CHA 大、小剂量组,吡格列酮组大鼠肝脏SOD 水平升高,MDA 水平显著降低,差异有统计学意义(均P<0.01)。
表2 CHA 对肥胖大鼠脏器系数、体脂比及Lee′s指数的影响(±s)
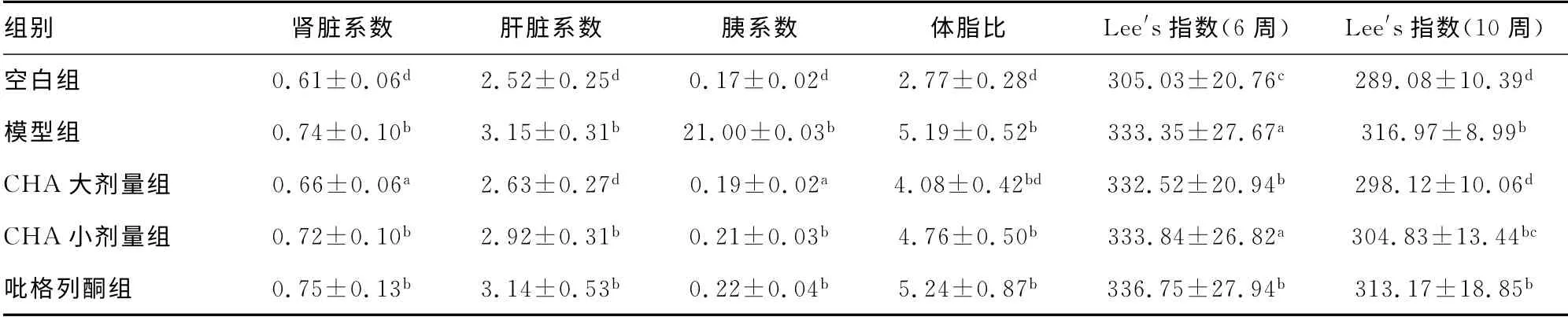
表2 CHA 对肥胖大鼠脏器系数、体脂比及Lee′s指数的影响(±s)
a:P<0.05、b:P<0.01,与空白组比较;c:P<0.05、d:P<0.01,与模型组比较。
组别 肾脏系数 肝脏系数 胰系数 体脂比 Lee′s指数(6周) Lee′s指数(10周)空白组 0.61±0.06d 2.52±0.25d 0.17±0.02d 2.77±0.28d 305.03±20.76c 289.08±10.39 d模型组 0.74±0.10b 3.15±0.31b 21.00±0.03b 5.19±0.52b 333.35±27.67a 316.97±8.99b CHA 大剂量组 0.66±0.06a 2.63±0.27d 0.19±0.02a 4.08±0.42bd 332.52±20.94b 298.12±10.06d CHA 小剂量组 0.72±0.10b 2.92±0.31b 0.21±0.03b 4.76±0.50b 333.84±26.82a 304.83±13.44bc吡格列酮组 0.75±0.13b 3.14±0.53b 0.22±0.04b 5.24±0.87b 336.75±27.94b 313.17±18.85 b
表3 6周末CHA 对肥胖大鼠糖耐量的影响(±s)

表3 6周末CHA 对肥胖大鼠糖耐量的影响(±s)
a:P<0.05、b:P<0.01,与空白组比较。
组别血糖(mmol/L)0min 0.5h 1.0h 2.0h AUC(mm2)空白组 4.37±0.69 6.07±0.69 6.09±0.53 4.30±0.56 10.84±0.99模型组 4.59±0.33 6.15±0.73 7.37±093b 4.64±1.26 12.07±1.29a CHA 大剂量组 4.62±0.39 6.04±0.73 7.46±1.01b 4.59±0.81 12.07±1.01a CHA 小剂量组 4.57±0.34 6.09±0.73 7.38±1.11b 4.71±1.02 12.08±0.85a吡格列酮组 4.79±0.39 6.14±0.82 7.37±1.17b 4.41±0.85 12.00±0.84 a
表4 CHA 对肥胖大鼠肝糖原、肌糖原、血清胰岛素及抗氧化指标的影响(±s)

表4 CHA 对肥胖大鼠肝糖原、肌糖原、血清胰岛素及抗氧化指标的影响(±s)
a:P<0.05、b:P<0.01,与空白组比较;d:P<0.01,与模型组比较。
组别 肝糖原(mg/g)肌糖原(mg/g)胰岛素(mU/L)SOD活力(U/mgprot)MDA 水平(nmol/mgprot)CAT 活力(U/mL)空白组 11.16±0.78 1.95±0.41 13.81±078 91.10±12.37 3.54±0.87 4.16±1.44模型组 6.19±0.89b 1.25±0.28b 17.49±090b 55.04±7.61b 11.91±3.32b 1.55±0.62b CHA 大剂量组 9.48±1.47bd 1.80±0.34d 12.98±1.47d 88.18±15.16bd 6.27±3.82ad 3.92±0.67d CHA 小剂量组 8.12±0.70bd 1.74±0.29d 13.12±0.70d 70.47±11.31bd 9.10±3.03bd 2.62±1.71a吡格列酮组 9.74±1.40bd 1.81±0.34d 12.74±1.40ad 69.11±12.24bd 6.49±1.54bd 1.83±0.86 d
表5 CHA 对肥胖大鼠血脂水平的影响(±s)
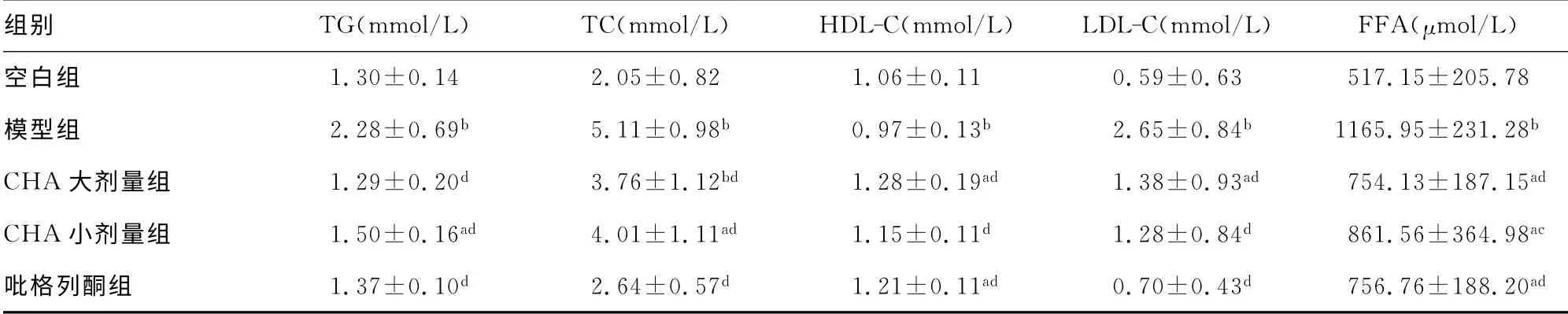
表5 CHA 对肥胖大鼠血脂水平的影响(±s)
a:P<0.05、b:P<0.01,与空白组比较;c:P<0.05、d:P<0.01,与模型组比较。
组别 TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) FFA(μmol/L)空白组 1.30±0.14 2.05±0.82 1.06±0.11 0.59±0.63 517.15±205.78模型组 2.28±0.69b 5.11±0.98b 0.97±0.13b 2.65±0.84b 1165.95±231.28b CHA 大剂量组 1.29±0.20d 3.76±1.12bd 1.28±0.19ad 1.38±0.93ad 754.13±187.15ad CHA 小剂量组 1.50±0.16ad 4.01±1.11ad 1.15±0.11d 1.28±0.84d 861.56±364.98ac吡格列酮组 1.37±0.10d 2.64±0.57d 1.21±0.11ad 0.70±0.43d 756.76±188.20 ad
2.5 CHA 对肥胖大鼠血脂水平的影响 由表5可知,与空白组比较,模型组大鼠血清TG、TC、HLD 和FFA 水平显著升高(P<0.01),HDL水平则显著降低(P<0.01)。给予药物干预后,CHA 大、小剂量,吡格列酮组TG、TC、HLD 和FFA 水平均有不同程度地降低(P<0.05或P<0.01),HDL 水平均有不同程度的升高(P<0.01)。
2.6 CHA 对肥胖大鼠HOMA-IR和HOMA-ISI影响 由表6可知,实验结束时与空白组比较,模型组HOMA-IR 增加,HOMA-ISI下降,差异均有统计学意义(P<0.01)。CHA 大、小剂量组、吡格列酮组与模型组比较,HOMA-IR 明显下降,HOMA-ISI增加,差异均有统计学意义(P<0.01)。
表6 CHA 对肥胖大鼠HOMA-ISI和HOMA-IR 的影响(±s)

表6 CHA 对肥胖大鼠HOMA-ISI和HOMA-IR 的影响(±s)
b:P<0.01,与空白组比较;d:P<0.01,与模型组比较。
组别HOMA-ISI HOMA-IR空白组 -(1.09±0.10)2.87±0.27模型组 -(1.26±0.04)b 3.88±0.51b CHA 大剂量组 -(1.01±0.18)d 2.71±0.25d CHA 小剂量组 -(1.03±0.10)d 2.72±0.24d吡格列酮组 -(0.97±0.14)d 2.72±0.39 d
3 讨 论
IR是2型糖尿病和心血管疾病的共同发病基础,改善IR是2型糖尿病患者治疗的一个主要目标。肥胖和缺乏锻炼是IR的主要原因,减体质量和改变生活方式是IR 治疗的基石和最有效的治疗方法。Lee′s指数与腹腔脂肪湿质量、脂肪细胞及血脂等指标高度相关,可作为评价成年肥胖模型大鼠肥胖程度的指标。肥胖往往伴有体内脂肪组织聚集和高脂血症,特别是血清FFA 的增高在IR 的发病过程中发挥重要作用[11-12]。FFA 与IR 互为因果,互相促进。肥胖(尤其是腹型肥胖)机体,其脂肪分解活跃,脂肪细胞的FFA 释放增多,导致高FFA血症,进而产生IR[13]。本实验采用高脂饲料喂养6周制备肥胖大鼠IR 模型,再继续给予高脂饮食的情况下给予药物干预4周,实验结果表明CHA 可显著降低Lee′s指数、脏器指数及体脂比,减肥效果优于吡格列酮。同时,CHA 可降低高脂诱导的大鼠血清TC、TG、LDL-C、FFA 水平,提高HDL-C 水平,表明CHA 改善胰岛素抵抗的作用可能与减体质量降脂有关。
研究发现,肥胖与自由基损伤有着密切的关系[14]。SOD和CAT 是机体自由基清除酶,MDA 是脂质过氧化产物。实验结果表明CHA 可明显增加肝脏SOD 水平和血清CAT 水平,降低肝脏中MDA 水平,其中CHA 大剂量组效果最为显著,表明CHA 改善肥胖大鼠IR 的作用可能与降低氧化应激,防止脂质过氧化有关。胰岛素调节血糖作用的主要靶器官是肝脏、骨骼肌和脂肪组织。IR 状态下,内源性葡萄糖的增多,肝脏和骨骼肌糖原储存减少。实验结果表明,CHA 能显著增加糖耐量,降低血清胰岛素水平,增加肝糖原、肌糖原的水平,降低HOMA-IR,升高HOMA-ISI。
本研究结果显示CHA 具有良好的抑制内脏脂肪聚积和改善胰岛素抵抗的作用,并能促进外周组织吸收利用葡萄糖,降低血清FFA 水平,降低肥胖大鼠的氧化应激,防止脂质过氧化,其分子机制值得进一步研究。
[1] Smyth S,Heron A.Diabetes and obesity:the twin epidemics[J].Nature Medicine,2006,12(1):75-80.
[2] Altaf Q,Barnett AH,Tahrani AA,et al.Novel therapeutics for type 2 diabetes:insulin resistance[J].Diabetes Obes Metab,2015,17(4):319-334.
[3] Karthikesan K,Pari L,Menon VP.Combined treatment of tetrahydrocurcumin and chlorogenic acid exerts potential antihyperglycemic effect on streptozotocin-nicotinamideinduced diabetic rats[J].Gen Physiol Biophys,2010,29(1):23-30
[4] Pari L,Karthikesan K,Menon VP.Comparative and combined effect of chlorogenic acid and tetrahydrocurcumin on antioxidant disparities in chemical induced experimental diabetes[J].Mol Cell Biochem,341(1/2):109-117.
[5] 王强,陈东辉,邓文龙.金银花提取物对血脂与血糖的影响[J].中药药理与临床,2007,23(3):40-42
[6] 祝莹,董英,钱希文,等.苦瓜冻干超微粉调节肥胖大鼠胰岛素抵抗及其作用机制研究[J].中国食品学报,2014,14(7):5-13.
[7] Lee YS,Kim WS,Kim KH,et al.Berberine,a natural plant product,activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulinresistant states[J].Diabetes,2006,55(8):2256-2264.
[8] 李延兵,廖志红,黄知敏,等.吡格列酮和二甲双胍对2型糖尿病胰岛素抵抗的影响[J].中国内分泌代谢杂志,2004,20(1):30-32.
[9] 陈清光,陆灏,李俊燕,等.健脾清化方对2型糖尿病大鼠胰岛素抵抗的影响[J].中华中医药杂志,2014,29(10):3239-3242.
[10] Rong X,Li Y,Ebihara K,et al.Angiotensin Ⅱtype 1receptor-independent beneficial effects of telmisartan on dietary-induced obesity,insulin resistance and fatty liver in mice[J].Diabetologia,2010,53(8):1727-1731.
[11] Savage DB,Petersen KF,Shulman GI.Disordered lipid metabolism and the pathogenesis of insulin resistance[J].Physiological Reviews,2007,87(2):,507-520.
[12] Lee YS,Cha BY,Saito K,et al.Effects of a Citrus depressa Hayata(shiikuwasa)extract on obesity in high-fat diet-induced obese mice[J].Phytomedicine,2011,18(8/9):648-654.
[13] 李佳,徐玲,蒋岚.血脂异常对胰岛β细胞功能和胰岛素敏感性的影响[J].重庆医学,2010,39(17):2264-2269.
[14] 罗蓉,瞿颂义.肥胖与自由基[J].国外医学:内分泌学分册,2004,24(B5):9-10.

